Expression and significance of endothelial cell-derived extracellular vesicles in peripheral blood of patients with sepsis-induced cardiomyopathy
-
摘要:目的
探讨脓毒症心肌病(SIC)患者外周血内皮细胞来源细胞外囊泡(EC-EVs)的表达特征及临床意义。
方法选取143例脓毒症患者作为研究对象,根据是否发生SIC将其分为心肌病组72例和非心肌病组71例。采集2组患者入院时外周血样本,分离并鉴定EC-EVs。比较2组患者外周血EC-EVs数量、凋亡情况以及EC-EVs中胱天蛋白酶-1(Caspase-1)的活性与表达水平。采用Spearman相关性分析法评估EC-EVs数量、Caspase-1活性与N末端脑钠肽前体(NT-proBNP)和心肌肌钙蛋白Ⅰ(cTnⅠ)的相关性; 采用多因素Logistic回归分析探讨脓毒症患者发生SIC的影响因素; 绘制受试者工作特征(ROC)曲线,分析EC-EVs数量、Caspase-1活性对SIC的预测价值。
结果2组样本中均成功分离出直径约为100 nm、具有完整膜结构并表达细胞外囊泡(EVs)标志分子(CD9、CD63、CD81)的EC-EVs。心肌病组外周血EC-EVs数量、EC-EVs凋亡水平、Caspase-1活性及蛋白表达水平均高于非心肌病组,差异有统计学意义(P < 0.05)。Spearman相关性分析结果显示, EC-EVs数量、Caspase-1活性分别与NT-proBNP(r=0.603、0.685, P < 0.001)、cTnI(r=0.474、0.711, P < 0.001)呈正相关。多因素Logistic回归分析结果显示, EC-EVs数量、Caspase-1活性、NT-proBNP水平、cTnI水平均为脓毒症患者发生SIC的独立影响因素(P < 0.05)。ROC曲线显示,外周血EC-EVs数量、Caspase-1活性预测SIC的曲线下面积分别为0.721、0.858。
结论SIC患者外周血EC-EVs数量及EC-EVs中Caspase-1活性显著增加,且EC-EVs数量、Caspase-1活性与脓毒症患者心功能及心肌损伤密切相关,有望成为预测SIC的生物标志物。
Abstract:ObjectiveTo investigate the expression characteristics and clinical significance of endothelial cell-derived extracellular vesicles (EC-EVs) in the peripheral blood of patients with sepsis-induced cardiomyopathy (SIC).
MethodsA total of 143 sepsis patients were enrolled and divided into cardiomyopathy group (n=72) and non-cardiomyopathy group (n=71) based on occurrence of SIC. Peripheral blood samples were collected from patients in both groups upon admission for isolation and identification of EC-EVs. The number of EC-EVs, apoptosis, and the activity and expression levels of caspase-1 in EC-EVs were compared between the two groups. Spearman correlation analysis was used to assess the correlations of the number of EC-EVs, caspase-1 activity, and N-terminal pro-brain natriuretic peptide (NT-proBNP) with cardiac troponin Ⅰ (cTnⅠ). Multivariable Logistic regression analysis was conducted to explore the factors influencing the occurrence of SIC in sepsis patients. Receiver operating characteristic (ROC) curves were plotted to analyze the predictive value of the number of EC-EVs and caspase-1 activity for SIC.
ResultsEC-EVs with a diameter of approximately 100 nm, intact membrane structure, and expression of extracellular vesicles (EVs) marker molecules (CD9, CD63, CD81) were successfully isolated from samples in both groups. The cardiomyopathy group had significantly higher numbers of EC-EVs in peripheral blood, EC-EV apoptosis levels, caspase-1 activity, and protein expression levels compared to the non-cardiomyopathy group(P < 0.05). Spearman correlation analysis revealed positive correlations between the number of EC-EVs and NT-proBNP (r=0.603, 0.685, P < 0.001), and between caspase-1 activity and cTnI (r=0.474, 0.711, P < 0.001). Multivariable Logistic regression analysis showed that the number of EC-EVs, caspase-1 activity, NT-proBNP levels, and cTnI levels were all independent influencing factors for the occurrence of SIC in sepsis patients (P < 0.05). The ROC curves indicated that the areas under the curve for predicting SIC based on the number of EC-EVs and caspase-1 activity in peripheral blood were 0.721 and 0.858, respectively.
ConclusionThe number of EC-EVs and caspase-1 activity in EC-EVs in the peripheral blood of SIC patients are significantly increased, and are closely related to cardiac function and myocardial injury in sepsis patients. Thus, they have the potential to become biomarkers for predicting SIC.
-
脓毒症是由微生物感染引发宿主免疫调节功能失调,进而导致致命性器官功能障碍的一种综合征,是重症监护病房的常见疾病,具有高发病率和高致死率的特点[1]。脓毒症心肌病(SIC)是脓毒症的常见并发症,发生率达65%, 且致死率极高[2]。SIC的主要临床表现为心室扩大、射血分数降低、心肌收缩与舒张功能减退,对液体复苏及血管活性药物反应不佳,病变可累及局部心肌或全心[3]。SIC的发病机制涉及微循环障碍诱发的血管炎症反应、血管内皮水肿及损伤等,最终导致心肌细胞损伤与凋亡等病理改变[4]。细胞外囊泡(EVs)是一种直径为0.03~2.00 μm的亚细胞质膜包裹颗粒,由磷脂双层膜包围,富含蛋白质、微小RNA(miRNA)等多种信号分子,在细胞活化和凋亡过程中通过复杂的出芽机制脱落,参与体内细胞间信号传导[5]。外周血Evs来源于血小板、内皮细胞、中性粒细胞、单核细胞、淋巴细胞、红细胞及其前体细胞,在维持血管稳态中发挥重要作用[6]。近年来,外周血EVs作为生物标志物和介质在脓毒症病理生理学中的作用受到关注,研究[7-8]发现其在脓毒症凝血功能障碍进展中具有重要作用。本研究探讨内皮细胞来源EVs(EC-EVs)与SIC的相关性,旨在评估EC-EVs对SIC预后的预测价值,现报告如下。
1. 资料与方法
1.1 一般资料
选取2023年1月—2023年11月上海交通大学医学院附属松江医院急诊科收治的143例脓毒症患者作为研究对象。纳入标准: ①符合《2021年国际脓毒症和脓毒性休克管理指南》中的脓毒症诊断标准者; ②首次发病者; ③资料完整者; ④入组前未接受抗生素、糖皮质激素及免疫抑制剂等药物治疗者。排除标准: ①合并心脑血管疾病、严重肝肾功能不全、凝血功能障碍者; ②伴有支气管扩张、肺动脉高压等其他肺部疾病者; ③有其他部位栓塞史或恶性肿瘤者; ④妊娠期或哺乳期女性; ⑤存在SIC以外的其他并发症者。SIC诊断标准: 心肌损伤标志物肌钙蛋白和(或)心功能标志物脑钠肽(BNP)或N末端脑钠肽前体(NT-proBNP)升高,心电图检查可见心动过速或心房颤动,心脏超声可见心肌收缩及舒张功能障碍,左心室射血分数 < 50%。根据是否发生SIC,将143例患者分为心肌病组72例和非心肌病组71例。心肌病组男42例,女30例,平均年龄(47.62±11.31)岁,平均体质量指数(23.63±3.64) kg/m2; 非心肌病组男40例,女31例,平均年龄(46.55±10.02)岁,平均体质量指数(23.29±3.51) kg/m2。2组患者基线资料(年龄、性别、体质量指数)比较,差异无统计学意义(P>0.05), 具有可比性。本研究经医院伦理委员会审核批准,且所有患者均知情同意并签署知情同意书。
1.2 EC-EVs分离鉴定
取脓毒症患者入院时的静脉血,置于抗凝管中。将收集到的1 mL血液样本在4 ℃条件下以2 000×g离心30 min, 取上清液,随后将上清液在4 ℃条件下以12 000×g离心30 min, 再次取上清液。将上清液在4 ℃条件下以100 000×g超速离心2 h, 弃去上清液,所得沉淀即为EVs。使用磷酸盐缓冲液(PBS)重悬EVs, 并通过生物素化的抗CD9、CD63、CD81抗体(购自Thermo Fisher Scientific公司)进行免疫共沉淀,以富集内皮细胞特异性EVs。
1.3 EC-EVs形态及粒径观察检测
1.3.1 透射电镜观察:
取稀释后的EVs样本,用2%戊二醛固定,取10 μL滴加至铜网,随后依次滴加3%磷钨酸和纯水(两者操作间隔2 min); 吸取多余液体,待干燥后,使用HITACHI H-9500透射电镜(日本HITACHI公司)观察EVs的形态结构,并拍照记录。
1.3.2 纳米粒子示踪分析:
将EVs样本按1: 50比例用无菌PBS重悬,取1 mL稀释后样本,使用NanoSight NS300纳米颗粒示踪分析仪(英国Malvern Panalytical公司)对EVs中的颗粒数进行定量分析。每个样本重复测定3次,取平均值作为最终结果。
1.4 EVs凋亡检测及胱天蛋白酶-1(Caspase-1)活性检测
1.4.1 EVs凋亡检测:
取上述分离提取的EC-EVs, 加入Annexin V-FITC试剂后,在冰上共同孵育30 min。随后,使用流式细胞仪对各组EVs的凋亡情况进行分析。
1.4.2 Caspase-1活性检测:
取上述分离提取的EC-EVs,使用Caspase-1活性检测试剂盒(Abcam公司)检测EVs中Caspase-1的活性,具体操作严格参照试剂盒说明书进行。
1.5 蛋白质印迹法(Western blotting)检测
取上述分离提取的EC-EVs,向样本中加入上样缓冲液后,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)和转膜操作。将转印蛋白的膜用5%脱脂奶粉于37 ℃封闭2 h,之后分别加入抗人CD9抗体(1∶ 1 000)、CD63抗体(1∶ 1 000)、CD81抗体(1∶ 1 000)、Caspase-1抗体(1∶ 1 000)及GAPDH抗体(1∶ 1 000), 于4 ℃孵育12 h。随后,使用辣根过氧化物酶(HRP)标记的二抗于37 ℃孵育1 h, 最后加入ECL发光液进行曝光检测。所有一抗和二抗均购自Abcam公司。
1.6 统计学处理
采用GraphPad 8.0软件进行统计学分析。计量资料首先进行正态性检验,服从正态分布的数据以(x±s)表示, 2组间比较采用t检验,多组间比较采用单因素方差分析; 若数据不服从正态分布,则采用非参数秩和检验。计数资料的比较采用卡方检验。采用多因素Logistic回归分析探讨脓毒症患者发生SIC的影响因素; 采用Spearman相关性分析法评估EC-EVs数量、Caspase-1活性与NT-proBNP和心肌肌钙蛋白Ⅰ(cTnⅠ)的相关性。绘制受试者工作特征(ROC)曲线评估EC-EVs数量、Caspase-1活性对脓毒症患者发生SIC的预测效能,并计算曲线下面积(AUC), AUC>0.5~0.7为预测效能低, AUC>0.7~0.9为预测效能较高, AUC>0.9为预测效能高。P < 0.05表示差异有统计学意义。
2. 结果
2.1 脓毒症患者外周血EC-EVs鉴定结果
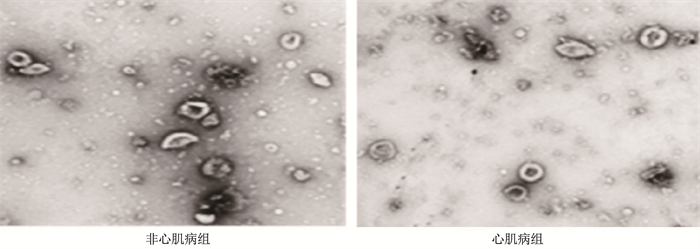
透射电镜观察结果显示,非心肌病组和心肌病组的EC-EVs均具有完整膜结构,平均直径较为接近,约为100 nm, 且2组样本中均检测到EVs的特异性标志物CD9、CD63和CD81, 见图 1。
2.2 2组患者外周血EC-EVs数量及NT-proBNP、cTnI水平比较
心肌病组外周血中EC-EVs数量及NT-proBNP、cTnI水平均高于非心肌病组,差异有统计学意义(P < 0.05), 见表 1。
表 1 2组脓毒症患者外周血EC-EVs数量及NT-proBNP、cTnI水平比较(x±s)组别 n EC-EVs数量/(×108个/mL) NT-proBNP/(pg/mL) cTnI/(ng/mL) 非心肌病组 71 19.71±4.46 1 012.13±246.59 0.15±0.05 心肌病组 72 42.86±6.92* 2 202.73±370.50* 0.83±0.16* EC-Evs: 内皮细胞来源细胞外囊泡; NT-proBNP: N末端脑钠肽前体; cTnⅠ: 心肌肌钙蛋白Ⅰ。与非心肌病组比较, * P < 0.05。 2.3 2组患者外周血EC-EVs凋亡情况及EC-Evs中Caspase-1水平比较
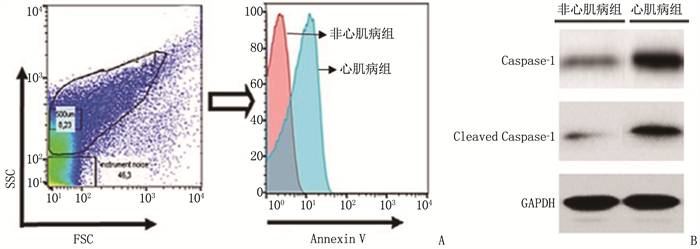
心肌病组患者外周血EC-EVs凋亡水平高于非心肌病组,EC-Evs中Caspase-1活性及剪切Caspase-1(Cleaved Caspase-1)蛋白水平高于非心肌病组,差异有统计学意义(P < 0.05), 见图 2、表 2。
表 2 2组患者外周血EC-Evs中Caspase-1活性及蛋白水平比较(x±s)组别 n Annexin V荧光强度(MFI) Caspase-1活性(RFU) (Cleaved Caspase-1/Caspase-1)/% 非心肌病组 71 1 322.54±135.65 792.11±57.01 2.81±0.36 心肌病组 72 4 682.77±489.43* 1 803.62±106.17* 168.31±23.08* MFI: 平均荧光强度; Caspase-1: 胱天蛋白酶-1; RFU: 相对荧光强度; Cleaved Caspase-1: 剪切胱天蛋白酶-1。
与非心肌病组比较, * P < 0.05。2.4 脓毒症患者外周血EC-EVs数量及EC-Evs中Caspase-1活性与NT-proBNP、cTnI的相关性
Spearman相关性分析结果显示, EC-EVs数量分别与NT-proBNP、cTnI呈正相关(r=0.603、0.474, P < 0.001); EC-Evs中Caspase-1活性分别与NT-proBNP、cTnI呈正相关(r=0.685、0.711, P < 0.001)。
2.5 多因素Logistic回归分析
多因素Logistic回归性分析结果显示, EC-EVs数量、Caspase-1活性、NT-proBNP水平、cTnI水平均为脓毒症患者发生SIC的独立影响因素(P < 0.05), 见表 3。
表 3 脓毒症患者发生脓毒症心肌病的多因素Logistic回归分析结果因素 回归系数 标准误 Wald χ2 P OR 95%CI EC-EVs数量 0.833 0.296 10.353 0.001 3.653 1.492~5.079 Caspase-1活性 1.832 0.366 20.757 < 0.001 6.057 2.376~12.836 NT-proBNP 1.146 0.198 8.188 0.002 3.261 1.326~4.803 cTnI 0.472 0.149 7.093 0.010 1.470 1.139~2.791 2.6 EC-EVs数量、Caspase-1活性对脓毒症患者发生SIC的预测效能
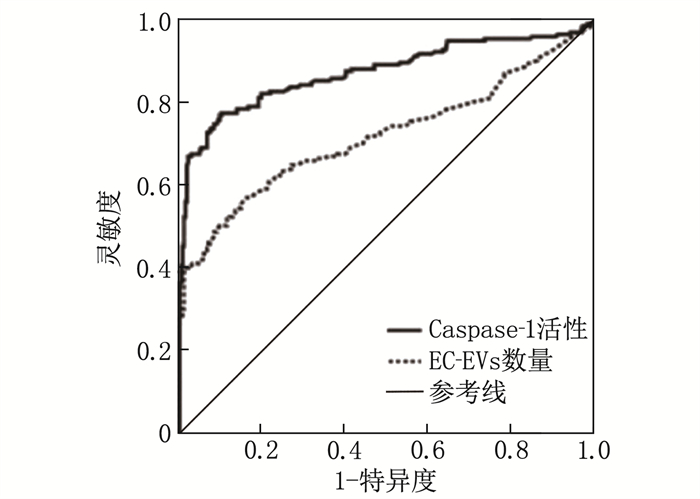
ROC曲线分析结果显示, EC-EVs数量、Caspase-1活性预测脓毒症患者发生SIC的AUC分别为0.721、0.858, 灵敏度分别为66.13%、81.16%, 特异度分别为75.93%、87.92%, 见图 3。
3. 讨论
SIC是脓毒症患者常见的早期并发症,也是影响患者预后的关键因素之一。病原体入侵机体后,会释放大量病原体相关分子模式及损伤相关分子模式,进而触发过度应激及炎症反应,导致大量细胞因子和补体生成,引起线粒体功能障碍和细胞代谢紊乱,诱发心肌细胞自噬、凋亡、坏死,最终造成心功能受损[9]。研究[10]发现,约50%的脓毒症患者会出现不同程度的心肌损伤,其预后显著较差,且发生SIC的脓毒症患者病死率显著高于未发生SIC者。临床研究[11]发现,SIC在初期通常具有可逆性,然而,一旦进入心功能失代偿阶段,预后往往极差,严重时可危及患者生命。因此,早期诊断脓毒症患者是否发生SIC具有重要的临床意义。
在脓毒症期间,白细胞、内皮细胞和血小板释放大量EVs, 这些EVs携带多种RNA和蛋白质,可调节受体细胞功能[12]。循环EVs可被受体细胞快速摄取与释放,因此具有动态特性,能够反映细胞活化的时间变化[12]。循环内皮细胞被认为是内皮细胞损伤的标志物,有研究[13]报道在脓毒症条件下其数量显著增加。另有研究[14]发现,在脓毒症期间,血管内皮细胞受刺激或发生凋亡时可释放EVs,导致外周血中EVs数量显著增加。本研究结果显示,SIC患者外周血中EC-EVs数量显著多于无心肌病的脓毒症患者。
Caspase-1是半胱氨酸蛋白酶家族的重要成员,在调控炎症反应、细胞凋亡和焦亡中发挥关键作用,而炎症反应及细胞凋亡、焦亡在脓毒症的发生和发展中起重要作用[15]。研究[16]表明, EVs中的Caspase-1活性可诱导内皮细胞损伤,而脓毒症诱导的单核细胞和内皮细胞焦亡可释放含Caspase-1的EVs。研究[17]显示,抑制Caspase-1能够减少炎症、细胞凋亡和焦亡,从而减轻器官损伤,改善脓毒症病情。此外,从脓毒症患者样本中分离的循环EVs可通过Caspase-1诱导淋巴细胞凋亡[18]。本研究发现,SIC患者EC-EVs凋亡水平显著高于非SIC患者,且SIC患者EC-EVs中Caspase-1活性及Cleaved Caspase-1蛋白水平显著高于非SIC患者,提示EC-EVs及其携带的Caspase-1可能参与SIC的发生与发展。
SIC患者因心肌受累出现心力衰竭及心肌损伤,故其外周血中心力衰竭标志物NT-proBNP及心肌损伤标志物cTnI水平显著升高。本研究发现,外周血EC-EVs数量分别与NT-proBNP、cTnI水平呈正相关。由于纳入患者的发病时间存在差异,单一时点检测可能造成EC-EVs数量、Caspase-1活性及血清NT-proBNP水平存在差异,但考虑到上述指标随病情进展而同步变化,相关性分析结果仍具有科学性和有效性。本研究通过多因素Logistic回归分析进一步发现,EC-EVs数量、Caspase-1活性均为SIC发生的独立影响因素。此外, ROC曲线分析结果显示,外周血EC-EVs数量、Caspase-1活性预测脓毒症患者发生SIC的AUC分别为0.721、0.858,提示两者具有较高的预测效能,可为脓毒症患者的预后评估提供重要参考依据。
综上所述, SIC患者外周血EC-EVs数量及EC-EVs中Caspase-1活性显著增加,且EC-EVs数量、Caspase-1活性与脓毒症患者的心功能及心肌损伤密切相关,有望成为预测SIC的生物标志物。
-
表 1 2组脓毒症患者外周血EC-EVs数量及NT-proBNP、cTnI水平比较(x±s)
组别 n EC-EVs数量/(×108个/mL) NT-proBNP/(pg/mL) cTnI/(ng/mL) 非心肌病组 71 19.71±4.46 1 012.13±246.59 0.15±0.05 心肌病组 72 42.86±6.92* 2 202.73±370.50* 0.83±0.16* EC-Evs: 内皮细胞来源细胞外囊泡; NT-proBNP: N末端脑钠肽前体; cTnⅠ: 心肌肌钙蛋白Ⅰ。与非心肌病组比较, * P < 0.05。 表 2 2组患者外周血EC-Evs中Caspase-1活性及蛋白水平比较(x±s)
组别 n Annexin V荧光强度(MFI) Caspase-1活性(RFU) (Cleaved Caspase-1/Caspase-1)/% 非心肌病组 71 1 322.54±135.65 792.11±57.01 2.81±0.36 心肌病组 72 4 682.77±489.43* 1 803.62±106.17* 168.31±23.08* MFI: 平均荧光强度; Caspase-1: 胱天蛋白酶-1; RFU: 相对荧光强度; Cleaved Caspase-1: 剪切胱天蛋白酶-1。
与非心肌病组比较, * P < 0.05。表 3 脓毒症患者发生脓毒症心肌病的多因素Logistic回归分析结果
因素 回归系数 标准误 Wald χ2 P OR 95%CI EC-EVs数量 0.833 0.296 10.353 0.001 3.653 1.492~5.079 Caspase-1活性 1.832 0.366 20.757 < 0.001 6.057 2.376~12.836 NT-proBNP 1.146 0.198 8.188 0.002 3.261 1.326~4.803 cTnI 0.472 0.149 7.093 0.010 1.470 1.139~2.791 -
[1] L'HEUREUX M, STERNBERG M, BRATH L, et al. Sepsis-induced cardiomyopathy: a comprehensive review[J]. Curr Cardiol Rep, 2020, 22(5): 35. doi: 10.1007/s11886-020-01277-2
[2] YE R Z, LIN Q Y, XIAO W K, et al. miR-150-5p in neutrophil-derived extracellular vesicles associated with sepsis-induced cardiomyopathy in septic patients[J]. Cell Death Discov, 2023, 9(1): 19. doi: 10.1038/s41420-023-01328-x
[3] HABIMANA R, CHOI I, CHO H J, et al. Sepsis-induced cardiac dysfunction: a review of pathophysiology[J]. Acute Crit Care, 2020, 35(2): 57-66. doi: 10.4266/acc.2020.00248
[4] HOLLENBERG S M, SINGER M. Pathophysiology of sepsis-induced cardiomyopathy[J]. Nat Rev Cardiol, 2021, 18(6): 424-434. doi: 10.1038/s41569-020-00492-2
[5] VAN NIEL G, CARTER D R F, CLAYTON A, et al. Challenges and directions in studying cell-cell communication by extracellular vesicles[J]. Nat Rev Mol Cell Biol, 2022, 23(5): 369-382. doi: 10.1038/s41580-022-00460-3
[6] MARGOLIS L, SADOVSKY Y. The biology of extracellular vesicles: the known unknowns[J]. PLoS Biol, 2019, 17(7): e3000363. doi: 10.1371/journal.pbio.3000363
[7] MARKI A, BUSCHER K, LORENZINI C, et al. Elongated neutrophil-derived structures are blood-borne microparticles formed by rolling neutrophils during sepsis[J]. J Exp Med, 2021, 218(3): e20200551. doi: 10.1084/jem.20200551
[8] HE Z H, WANG H X, YUE L J. Endothelial progenitor cells-secreted extracellular vesicles containing microRNA-93-5p confer protection against sepsis-induced acute kidney injury via the KDM6B/H3K27me3/TNF-α axis[J]. Exp Cell Res, 2020, 395(2): 112173. doi: 10.1016/j.yexcr.2020.112173
[9] SONG J, FANG X, ZHOU K, et al. Sepsis-induced cardiac dysfunction and pathogenetic mechanisms (Review)[J]. Mol Med Rep, 2023, 28(6): 227. doi: 10.3892/mmr.2023.13114
[10] WANG R Z, XU Y R, FANG Y X, et al. Pathogenetic mechanisms of septic cardiomyopathy[J]. J Cell Physiol, 2022, 237(1): 49-58. doi: 10.1002/jcp.30527
[11] SONG M J, LEE S H, LEEM A Y, et al. Predictors and outcomes of sepsis-induced cardiomyopathy in critically ill patients[J]. Acute Crit Care, 2020, 35(2): 67-76. doi: 10.4266/acc.2020.00024
[12] BHAGWAN VALJEE R, MACKRAJ I, MOODLEY R, et al. Investigation of exosomal tetraspanin profile in sepsis patients as a promising diagnostic biomarker[J]. Biomarkers, 2024, 29(2): 78-89. doi: 10.1080/1354750X.2024.2319296
[13] ZHU Y Y, ZHU J, TIAN X H, et al. Circulating endothelial progenitor cells from septic patients are associated with different infectious organisms[J]. Ann Palliat Med, 2021, 10(1): 549-559.
[14] REFAIE M M M, EL-HUSSIENY M, BAYOUMI A M A, et al. Sacubitril/valsartan alleviates sepsis-induced myocardial injury in rats via dual angiotensin receptor-neprilysin inhibition and modulation of inflammasome/caspase 1/IL1β pathway[J]. Eur J Pharmacol, 2024, 979: 176834.
[15] BALL D P, TAABAZUING C Y, GRISWOLD A R, et al. Caspase-1 interdomain linker cleavage is required for pyroptosis[J]. Life Sci Alliance, 2020, 3(3): e202000664.
[16] NASERI A, AKYUZ E, TURGUT K, et al. Sepsis-induced cardiomyopathy in animals: from experimental studies to echocardiography-based clinical research[J]. Can Vet J, 2023, 64(9): 871-877.
[17] CARBONE F, LIBERALE L, PREDA A, et al. Septic cardiomyopathy: from pathophysiology to the clinical setting[J]. Cells, 2022, 11(18): 2833.
[18] LAURA FRANCÉS J, PAGIATAKIS C, DI MAURO V, et al. Therapeutic potential of EVs: targeting cardiovascular diseases[J]. Biomedicines, 2023, 11(7): 1907.




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
