Clinical value of detection of B-type natriuretic peptide in acute exacerbation of chronic obstructive pulmonary disease combined with right heart failure
-
摘要:目的
探讨B型利钠肽(BNP)对急性加重期慢性阻塞性肺疾病(AECOPD)合并右心衰竭(RHF)的预测价值。
方法选取2022年1月—2024年1月在南通大学附属江阴医院、南京市胸科医院就诊的AECOPD患者为研究对象, 根据纳入和排除标准最终纳入122例患者。根据患者是否合并RHF, 将其分为观察组(AECOPD合并RHF, n=72)和对照组(AECOPD未合并RHF, n=50)。比较2组各项指标的差异,并通过Logistic回归分析和受试者工作特征(ROC)曲线评估BNP对AECOPD患者合并RHF的预测价值,并采用ROC曲线确定BNP的截断值。
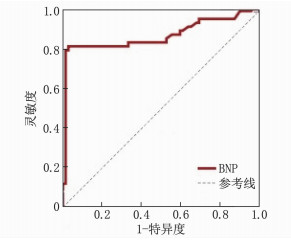
结果2组性别、体温、白蛋白、血糖、氯离子、肺动脉压(PAP)、BNP水平差异有统计学意义(P < 0.05)。Logistic回归分析结果显示, BNP是AECOPD合并RHF患者的独立预测因子(OR=1.03, 95%CI: 1.01~1.04, P < 0.05)。ROC曲线结果显示, BNP截断值为83.5 pg/mL时,灵敏度为0.820, 特异度为0.972, 约登指数为0.792。BNP的曲线下面积为0.875(95%CI: 0.800~0.949, P < 0.001)。当AECOPD患者BNP>83.5 pg/mL时, RHF发病率明显增高。
结论AECOPD合并RHF的患者血浆BNP水平高于未合并RHF者,且BNP对于判断AECOPD患者是否合并RHF具有重要的预测价值。
Abstract:ObjectiveTo investigate the predictive value of B-type natriuretic peptide (BNP) for acute exacerbation of chronic obstructive pulmonary disease (AECOPD) complicated by right heart failure (RHF).
MethodsThis study selected AECOPD patients admitted to Jiangyin Hospital Affiliated to Nantong University and Nanjing Chest Hospital from January 2022 to January 2024 as objects. According to the inclusion and exclusion criteria, 122 patients were ultimately enrolled. The patients were divided into observation group (AECOPD with RHF, n=72) and control group (AECOPD without RHF, n=50) based on whether they had RHF. Differences in various indicators between the two groups were compared, and the predictive value of BNP for AECOPD patients with RHF was assessed through Logistic regression analysis and receiver operating characteristic (ROC) curves. The cut-off value of BNP was determined using the ROC curve.
ResultsStatistically significant differences were observed between the two groups in terms of gender, body temperature, albumin, blood glucose, chloride ions, pulmonary artery pressure (PAP), and BNP levels(P < 0.05). Logistic regression analysis showed that BNP was an independent predictor for AECOPD patients with RHF (OR=1.03; 95%CI, 1.01 to 1.04; P < 0.05). The ROC curve results indicated that when the BNP cut-off value was 83.5 pg/mL, the sensitivity was 0.820, the specificity was 0.972, and the Youden index was 0.792. The area under the curve for BNP was 0.875 (95%CI, 0.800 to 0.949, P < 0.001). When the BNP level in AECOPD patients exceeded 83.5 pg/mL, the incidence of RHF significantly increased.
ConclusionPatients with AECOPD complicated by RHF have higher plasma BNP levels than those without RHF, and BNP has significant predictive value for determining whether AECOPD patients have RHF.
-
慢性阻塞性肺疾病(COPD)是急诊科和呼吸科常见的呼吸道感染性疾病, COPD合并右心衰竭(RHF)患者病情尤为严重, 发病率和病死率逐年上升。在40岁以上人群中, COPD的患病率高达8.2%[1], 心血管疾病导致的死亡人数占全球死亡人数的1/3[2]。据统计, COPD目前是全球导致死亡的主要原因之一[3-4]。因此, 评估COPD患者病情,及时甄别COPD合并RHF的病理生理状态,对诊疗过程具有重要意义。B型利钠肽(BNP)是用于评估心力衰竭的指标,目前关于BNP在COPD患者合并RHF中评估价值的研究较少,且缺乏前瞻性研究。本研究旨在评估BNP预测急性加重期COPD(AECOPD)患者合并RHF的价值,现报告如下。
1. 资料与方法
1.1 一般资料
选取2022年1月—2024年1月在南通大学附属江阴医院和南京市胸科医院就诊的122例AECOPD患者为研究对象。纳入标准: ①符合2020年版《慢性阻塞性肺疾病全球倡议》(GOLD)[5]中AECOPD诊断标准者; ②符合2022年美国心脏病学会《2022年ACC/AHA/HFSA心衰管理指南》[6]中RHF的诊断标准者; ③无其他导致心脏疾病病史者; ④年龄18~85岁者。排除标准: ①入院后经心脏多普勒超声提示左心功能异常者; ②入院后被证实存在其他病因(包括急性右心梗死、肺动脉栓塞、严重瓣膜病变等)引起RHF者; ③资料不全、自动出院或主动要求退出者。
1.2 方法
根据患者肺心病临床表现及BNP检测结果, 将患者分为观察组(n=72, AECOPD合并RHF)和对照组(n=50, AECOPD不合并RHF)。记录患者一般资料,并采集患者入院24 h内空腹血液标本,检测血常规、血生化指标及C反应蛋白(CRP)和BNP等指标。入院后,完善彩色多普勒心脏超声胸部检查,采用三尖瓣反流法测定肺动脉压(PAP), 并记录患者左心室射血分数(LVEF)。本研究遵循《赫尔辛基宣言》,并经江阴市人民医院伦理委员会[伦理审查批件号: 〔2024〕伦审研第(085)号]和南京市胸科医院伦理委员会批准(伦理审查批件号: 2022-KY104-01)。所有受试者充分了解诊疗目的及风险后,均自愿参与本研究,并签署知情同意书。
1.3 统计学方法
本研究采用SPSS 17.0软件进行统计学分析。符合正态分布的计量数据以(x±s)表示,并采用独立样本t检验; 非正态分布的数据以中位数(四分位数间距)表示,并采用秩和检验。计数资料比较采用χ2检验。采用Logistic回归模型对多变量进行分析,以确定预后指标的独立预测因素,并构建相应的回归方程。采用受试者工作特征(ROC)曲线及曲线下面积(AUC)评估独立预测因素的预测效能。所有统计检验均为双侧检验, P < 0.05为差异有统计学意义。
2. 结果
2.1 患者基线资料比较
本研究共纳入122例AECOPD患者,其中男106例,女16例,年龄(70.9±8.9)岁。2家医院患者年龄、性别、动脉血二氧化碳分压[pa(CO2)]、动脉血氧分压[pa(O2)]等基线资料比较,差异无统计学意义(P>0.05), 患者基线资料比较见表 1。2组患者性别、体温、白蛋白水平、血糖、氯离子(Cl-)、PAP、BNP水平比较, 差异有统计学意义(P < 0.05), 见表 2。
表 1 2家医院患者基线资料比较(x±s)[n(%)][M(P25, P75)]指标 江阴市人民医院(n=62) 南京胸科医院(n=60) P 年龄/岁 65.9±8.3 70.2±8.7 0.180 男性 55(88.7) 51(85.0) 0.544 吸烟 11(17.7) 9(15.0) 0.683 住院时间/d 9(6, 11) 8(5, 10) 0.198 体温/℃ 36.6(36.5, 37.5) 36.7(36.4, 36.9) 0.061 心率/(次/min) 90.3±14.0 90.1±16.5 0.848 呼吸/(次/min) 20(17, 21) 20(18, 22) 0.381 SBP/mmHg 125.9±18.6 130.9±21.3 0.462 DBP/mmHg 80.5±10.1 80.8±12.7 0.877 WBC/(×109/L) 7.4(4.9, 10.1) 7.5(5.6, 12.0) 0.272 血红蛋白/(g/L) 136.8±13.2 135.7±14.6 0.981 红细胞压积/% 38.7(36.8, 41.6) 39.4(36.3, 42.2) 0.905 RBC/(×1012/L) 4.4(4.0, 4.7) 4.4(3.9, 4.8) 0.705 血小板/(×109/L) 190.8±61.2 192.9±60.4 0.952 AST/(U/L) 19.3(14.8, 31.3) 16.8(12.4, 27.8) 0.206 ALT/(U/L) 16.6(8.6, 32.9) 11.6(7.2, 19.6) 0.355 白蛋白/(g/L) 36.3±3.4 36.6±3.6 0.549 前白蛋白/(g/L) 260.7±48.9 259.7±48.7 0.264 BUN/(mmol/L) 5.6(4.7, 6.8) 5.4(4.6, 6.9) 0.188 血肌酐/(μmol/L) 71.7(60.7, 85.4) 70.1(60.3, 85.6) 0.818 血糖/(mmol/L) 5.7±1.5 5.9±1.6 0.087 K+/(mmol/L) 3.9±0.6 3.8±0.8 0.887 Na+/(mmol/L) 135.8(133.9, 142.2) 136.7(134.6, 142.6) 0.435 Cl-/(mmol/L) 99.5±3.9 98.9±5.0 0.089 pH值 7.4±0.1 7.4±0.1 0.199 pa(CO2)/mmHg 44.3±13.1 48.7±14.4 0.105 pa(O2)/mmHg 95.7±33.5 96.8±39.6 0.391 SaO2/% 97.5(94.3, 98.7) 97.6(93.3, 98.9) 0.754 红细胞沉降率/(mm/h) 11.0(6.0, 19.0) 10.7(5.9, 19.9) 0.893 CRP/(mg/L) 15.7(3.4, 58.8) 24.8(5.4, 62.2) 0.402 血清铁蛋白/(ng/mL) 225.2±144.4 211.4±149.7 0.695 PAP/mmHg 39.2±11.0 40.5±16.3 0.089 BNP/(pg/mL) 137.2(11.3, 281.0) 192.8(68.4, 246.0) 0.223 LVEF/% 59(55, 63) 60(56, 66) 0.914 1 mmHg=0.133 kPa。SBP: 收缩压; DBP: 舒张压; WBC: 白细胞; RBC: 红细胞; pa(CO2): 动脉血二氧化碳分压; pa(O2): 动脉血氧分压; AST: 天门冬氨酸氨基转移酶; ALT: 丙氨酸氨基转移酶; BUN: 尿素氮; SaO2: 血氧饱和度; CRP: C反应蛋白; PAP: 肺动脉压力; BNP: B型利钠肽; LVEF: 左心室射血分数。 表 2 2组患者一般资料比较(x±s)[n(%)][M(P25, P75)]指标 观察组(n=72) 对照组(n=50) P 年龄/岁 69.9±8.9 72.2±8.7 0.176 男性 67(93.1) 39(78.0) 0.016 吸烟 13(18.1) 7(14.0) 0.553 住院时间/d 8(6, 9) 8(6, 11) 0.188 体温/℃ 36.7(36.5, 37.4) 36.5(36.4, 36.8) 0.031 心率/(次/min) 93.1±15.0 92.1±17.8 0.748 呼吸/(次/min) 20(18, 20) 20(19, 20) 0.271 SBP/mmHg 131.9±18.7 134.9±23.3 0.432 DBP/mmHg 80.5±10.1 80.8±12.7 0.877 WBC/(×109/L) 6.9(5.1, 8.4) 6.9(4.9, 10.4) 0.449 血红蛋白/(g/L) 133.9±14.2 133.7±16.6 0.921 红细胞压积/% 39.7(36.2, 42.6) 39.9(36.1, 44.2) 0.917 RBC/(×1012/L) 4.5(4.1, 4.7) 4.5(3.9, 4.8) 0.469 血小板/(×109/L) 190.8±63.2 191.9±66.4 0.931 AST/(U/L) 20.3(17.5, 26.7) 21.4(16.2, 23.9) 0.476 ALT/(U/L) 14.7(9.6, 18.8) 11.9(9.2, 19.6) 0.355 白蛋白/(g/L) 39.1±3.4 37.1±3.6 0.002 前白蛋白/(g/L) 268.7±49.9 255.7±50.7 0.164 BUN/(mmol/L) 5.4(4.6, 6.7) 5.1(4.0, 6.1) 0.181 血肌酐/(μmol/L) 74.7(67.7, 85.4) 74.1(58.3, 87.6) 0.398 血糖/(mmol/L) 5.8±1.6 5.2±1.3 < 0.050 K+/(mmol/L) 4.1±0.6 4.0±0.5 0.597 Na+/(mmol/L) 140.5(137.9, 142.1) 139.7(136.6, 141.8) 0.236 Cl-/(mmol/L) 100.5±3.9 97.9±5.9 0.009 pH值 [KG1]7.4±0.1 7.4±0.1 0.866 pa(CO2)/mmHg 44.3±13.1 48.7±14.4 0.086 pa(O2)/mmHg 95.7±33.5 96.8±39.6 0.872 SaO2/% 97.4(94.6, 98.8) 97.3(93.5, 98.4) 0.634 红细胞沉降率/(mm/h) 10.0(6.0, 20.0) 10.5(5.8, 19.5) 0.865 CRP/(mg/L) 17.7(9.5, 55.9) 17.7(11.8, 73.7) 0.569 血清铁蛋白/(ng/mL) 215.2±143.4 201.4±146.8 0.605 PAP/mmHg 48.5±15.3 37.2±10.0 < 0.001 BNP/(pg/mL) 155.1(92.9, 243.0) 40.0(21.3, 61.0) 0.001 LVEF/% 60(55, 64) 62(55, 65) 0.904 2.2 AECOPD患者发生RHF的影响因素分析
对有统计学差异的指标(性别、体温、白蛋白、血糖、Cl-、BNP、PAP值)进行二元Logistic回归分析, 结果显示,独立影响因素仅为BNP, OR值为1.03(95%CI: 1.01~1.04, P < 0.05)。去除非独立影响因素后,为预测AECOPD患者合并RHF建立Logistic回归方程: logit P=-2.64+0.003×BNP, AECOPD患者发生RHF的影响因素分析见表 3。
表 3 Logistic回归分析筛选COPD患者合并RHF的影响因素指标 B S. E Wald df P Exp(B) 95%CI 性别 -0.18 0.87 0.04 1 0.83 0.83 0.15~4.55 体温 -0.61 0.40 2.33 1 0.13 0.54 0.25~1.19 白蛋白 -0.05 0.08 0.30 1 0.58 0.96 0.81~1.12 血糖 -0.24 0.19 1.60 1 0.21 0.79 0.54~1.14 Cl- -0.06 0.07 0.70 1 0.44 0.94 0.81~1.09 PAP 0.03 0.03 0.94 1 0.33 1.03 0.97~1.08 BNP 0.02 0.01 15.56 1 0.01 1.02 1.01~1.04 2.3 各指标对预测能力的评价
对BNP这个独立预测因子进一步行ROC曲线分析,评估其预测AECOPD患者发生RHF的效能,结果提示, BNP的AUC为0.875(95%CI: 0.800~0.949, P < 0.001)。BNP截断值为83.5 pg/mL(灵敏度为0.820, 特异度为0.972, 约登指数为0.792)。当AECOPD患者BNP>83.5 pg/mL时, RHF的发病率增高,见图 1。
3. 讨论
COPD是一种全球流行的严重危害人类健康的常见病、多发病[7], AECOPD反复发作直接影响预后, 临床尚缺乏能反映预后的简便、有效检测指标[8-9]。COPD患者长期慢性缺氧、二氧化碳潴留引起肺循环阻力增加, PAP逐渐增高,随着病情进展发展为肺心病,常出现右心功能失代偿,即RHF, 能够预测病情进展尤其是关于右心功能方面的临床指标就更少[10-11]。COPD患者常伴肺动脉高压(PH)。目前, PH的诊断主要依赖于肺动脉压力测定, 其中右心导管下的PAP测定被视为“金标准”,但因其操作复杂且为有创检测,临床常规应用受限[12-13]。相比之下,超声心动图作为一种无创检查手段,具有简便易行、重复性好的优点,不仅能有效监测三尖瓣反流,还可间接评估肺动脉收缩压,从而评估右心功能。
正常情况下, BNP主要储存于右心房并由心室肌细胞分泌,具有利尿、扩血管等功能。当心室壁张力增高时, BNP会大量分泌。此外, BNP水平的变化能灵敏地反映心室功能,尤其是左心室的容量和压力负荷状态,对指导患者的治疗用药具有重要意义。本研究收集AECOPD患者入院24 h内的空腹血液标本。在AECOPD患者中, BNP水平存在不同程度升高。因此,动态监测血浆BNP水平在诊断、病情评估、预后判断及治疗指导方面均具有重要意义[14-16]。PAVASINI R等[17]通过Meta分析研究发现, COPD患者的N末端B型利钠肽前体水平与病死率之间存在关联。2021年, 中国学者的一项研究[18]也显示,BNP的测定在COPD患者肺心病诊断中发挥着重要作用。
本研究发现, BNP水平在AECOPD合并RHF组患者显著升高,经Logistic回归分析后确认BNP水平为预测独立因子,与国外研究结果类似。KHALID K等[19]在其综述文献中, 通过回顾性分析多篇文献指出,血浆BNP水平与住院期间不良事件(包括需无创或有创机械通气、入住重症监护病房及死亡)的发生具有相关性,表明在左心射血分数正常的AECOPD患者中,血浆BNP水平的升高可用于COPD合并右心功能不全的诊断、严重程度的判断及预后的评估。此外,心脏超声检查显示, PAP也存在明显升高,进一步说明BNP的变化与心室容量增加、压力负荷增大及心功能状态密切相关。另有研究[20-21]表明,血浆BNP水平能反映COPD患者肺动脉高压及病情严重程度。然而, Logistic回归分析并未发现肺动脉压升高是合并右心衰的独立危险因素。可能的原因为, AECOPD患者发展为肺心病时,肺动脉压已出现明显升高,当患者出现RHF后,肺动脉压可能保持稳定。因此,仅凭PAP无法准确判断是否存在RHF。
本研究纳入来自江苏省2个生活环境及人口密度不同城市的AECOPD患者人群作为研究对象。经统计验证, 2个院区患者的数据无显著差异。本研究结果显示, AECOPD合并RHF患者血浆中BNP浓度高于单纯AECOPD患者。采用是否合并RHF作为二分类变量进行ROC曲线分析, AUC为0.875(95%CI: 0.800~0.949), 表明BNP在预测AECOPD合并RHF方面具有较高的价值。本研究局限性在于纳入人群为同一海拔区域,未来研究可考虑纳入不同海拔地区人群,以探究BNP阈值是否存在差异,并探究BNP的临床意义。
综上所述, BNP对于评估AECOPD患者是否合并RHF具有良好的预测价值,具备快速、简便、高灵敏度及高特异度等优势。
-
表 1 2家医院患者基线资料比较(x±s)[n(%)][M(P25, P75)]
指标 江阴市人民医院(n=62) 南京胸科医院(n=60) P 年龄/岁 65.9±8.3 70.2±8.7 0.180 男性 55(88.7) 51(85.0) 0.544 吸烟 11(17.7) 9(15.0) 0.683 住院时间/d 9(6, 11) 8(5, 10) 0.198 体温/℃ 36.6(36.5, 37.5) 36.7(36.4, 36.9) 0.061 心率/(次/min) 90.3±14.0 90.1±16.5 0.848 呼吸/(次/min) 20(17, 21) 20(18, 22) 0.381 SBP/mmHg 125.9±18.6 130.9±21.3 0.462 DBP/mmHg 80.5±10.1 80.8±12.7 0.877 WBC/(×109/L) 7.4(4.9, 10.1) 7.5(5.6, 12.0) 0.272 血红蛋白/(g/L) 136.8±13.2 135.7±14.6 0.981 红细胞压积/% 38.7(36.8, 41.6) 39.4(36.3, 42.2) 0.905 RBC/(×1012/L) 4.4(4.0, 4.7) 4.4(3.9, 4.8) 0.705 血小板/(×109/L) 190.8±61.2 192.9±60.4 0.952 AST/(U/L) 19.3(14.8, 31.3) 16.8(12.4, 27.8) 0.206 ALT/(U/L) 16.6(8.6, 32.9) 11.6(7.2, 19.6) 0.355 白蛋白/(g/L) 36.3±3.4 36.6±3.6 0.549 前白蛋白/(g/L) 260.7±48.9 259.7±48.7 0.264 BUN/(mmol/L) 5.6(4.7, 6.8) 5.4(4.6, 6.9) 0.188 血肌酐/(μmol/L) 71.7(60.7, 85.4) 70.1(60.3, 85.6) 0.818 血糖/(mmol/L) 5.7±1.5 5.9±1.6 0.087 K+/(mmol/L) 3.9±0.6 3.8±0.8 0.887 Na+/(mmol/L) 135.8(133.9, 142.2) 136.7(134.6, 142.6) 0.435 Cl-/(mmol/L) 99.5±3.9 98.9±5.0 0.089 pH值 7.4±0.1 7.4±0.1 0.199 pa(CO2)/mmHg 44.3±13.1 48.7±14.4 0.105 pa(O2)/mmHg 95.7±33.5 96.8±39.6 0.391 SaO2/% 97.5(94.3, 98.7) 97.6(93.3, 98.9) 0.754 红细胞沉降率/(mm/h) 11.0(6.0, 19.0) 10.7(5.9, 19.9) 0.893 CRP/(mg/L) 15.7(3.4, 58.8) 24.8(5.4, 62.2) 0.402 血清铁蛋白/(ng/mL) 225.2±144.4 211.4±149.7 0.695 PAP/mmHg 39.2±11.0 40.5±16.3 0.089 BNP/(pg/mL) 137.2(11.3, 281.0) 192.8(68.4, 246.0) 0.223 LVEF/% 59(55, 63) 60(56, 66) 0.914 1 mmHg=0.133 kPa。SBP: 收缩压; DBP: 舒张压; WBC: 白细胞; RBC: 红细胞; pa(CO2): 动脉血二氧化碳分压; pa(O2): 动脉血氧分压; AST: 天门冬氨酸氨基转移酶; ALT: 丙氨酸氨基转移酶; BUN: 尿素氮; SaO2: 血氧饱和度; CRP: C反应蛋白; PAP: 肺动脉压力; BNP: B型利钠肽; LVEF: 左心室射血分数。 表 2 2组患者一般资料比较(x±s)[n(%)][M(P25, P75)]
指标 观察组(n=72) 对照组(n=50) P 年龄/岁 69.9±8.9 72.2±8.7 0.176 男性 67(93.1) 39(78.0) 0.016 吸烟 13(18.1) 7(14.0) 0.553 住院时间/d 8(6, 9) 8(6, 11) 0.188 体温/℃ 36.7(36.5, 37.4) 36.5(36.4, 36.8) 0.031 心率/(次/min) 93.1±15.0 92.1±17.8 0.748 呼吸/(次/min) 20(18, 20) 20(19, 20) 0.271 SBP/mmHg 131.9±18.7 134.9±23.3 0.432 DBP/mmHg 80.5±10.1 80.8±12.7 0.877 WBC/(×109/L) 6.9(5.1, 8.4) 6.9(4.9, 10.4) 0.449 血红蛋白/(g/L) 133.9±14.2 133.7±16.6 0.921 红细胞压积/% 39.7(36.2, 42.6) 39.9(36.1, 44.2) 0.917 RBC/(×1012/L) 4.5(4.1, 4.7) 4.5(3.9, 4.8) 0.469 血小板/(×109/L) 190.8±63.2 191.9±66.4 0.931 AST/(U/L) 20.3(17.5, 26.7) 21.4(16.2, 23.9) 0.476 ALT/(U/L) 14.7(9.6, 18.8) 11.9(9.2, 19.6) 0.355 白蛋白/(g/L) 39.1±3.4 37.1±3.6 0.002 前白蛋白/(g/L) 268.7±49.9 255.7±50.7 0.164 BUN/(mmol/L) 5.4(4.6, 6.7) 5.1(4.0, 6.1) 0.181 血肌酐/(μmol/L) 74.7(67.7, 85.4) 74.1(58.3, 87.6) 0.398 血糖/(mmol/L) 5.8±1.6 5.2±1.3 < 0.050 K+/(mmol/L) 4.1±0.6 4.0±0.5 0.597 Na+/(mmol/L) 140.5(137.9, 142.1) 139.7(136.6, 141.8) 0.236 Cl-/(mmol/L) 100.5±3.9 97.9±5.9 0.009 pH值 [KG1]7.4±0.1 7.4±0.1 0.866 pa(CO2)/mmHg 44.3±13.1 48.7±14.4 0.086 pa(O2)/mmHg 95.7±33.5 96.8±39.6 0.872 SaO2/% 97.4(94.6, 98.8) 97.3(93.5, 98.4) 0.634 红细胞沉降率/(mm/h) 10.0(6.0, 20.0) 10.5(5.8, 19.5) 0.865 CRP/(mg/L) 17.7(9.5, 55.9) 17.7(11.8, 73.7) 0.569 血清铁蛋白/(ng/mL) 215.2±143.4 201.4±146.8 0.605 PAP/mmHg 48.5±15.3 37.2±10.0 < 0.001 BNP/(pg/mL) 155.1(92.9, 243.0) 40.0(21.3, 61.0) 0.001 LVEF/% 60(55, 64) 62(55, 65) 0.904 表 3 Logistic回归分析筛选COPD患者合并RHF的影响因素
指标 B S. E Wald df P Exp(B) 95%CI 性别 -0.18 0.87 0.04 1 0.83 0.83 0.15~4.55 体温 -0.61 0.40 2.33 1 0.13 0.54 0.25~1.19 白蛋白 -0.05 0.08 0.30 1 0.58 0.96 0.81~1.12 血糖 -0.24 0.19 1.60 1 0.21 0.79 0.54~1.14 Cl- -0.06 0.07 0.70 1 0.44 0.94 0.81~1.09 PAP 0.03 0.03 0.94 1 0.33 1.03 0.97~1.08 BNP 0.02 0.01 15.56 1 0.01 1.02 1.01~1.04 -
[1] KAHNERT K, JÖRRES R A, BEHR J, et al. The diagnosis and treatment of COPD and its comorbidities[J]. Dtsch Arztebl Int, 2023, 120(25): 434-444.
[2] GOLDSBOROUGH E, OSUJI N, BLAHA M J. Assessment of cardiovascular disease risk A 2022 update[J]. Endocrinol Metab Clin N Am, 2022, 51(3): 483-509. doi: 10.1016/j.ecl.2022.02.005
[3] SAFIRI S, CARSON-CHAHHOUD K, NOORI M, et al. Burden of chronic obstructive pulmonary disease and its attributable risk factors in 204 countries and territories, 1990-2019: results from the Global Burden of Disease Study 2019[J]. BMJ, 2022, 378: e069679.
[4] MURRAY C J L. The global burden of disease study at 30 years[J]. Nat Med, 2022, 28: 2019-2026. doi: 10.1038/s41591-022-01990-1
[5] HALPIN D M G, CRINER G J, PAPI A, et al. Global initiative for the diagnosis, management, and prevention of chronic obstructive lung disease. the 2020 GOLD science committee report on COVID-19 and chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2021, 203(1): 24-36. doi: 10.1164/rccm.202009-3533SO
[6] HEIDENREICH P A, BOZKURT B, AGUILAR D, et al. 2022 AHA/ACC/HFSA guideline for the management of heart failure A report of the American college of cardiology/American heart association joint committee on clinical practice guidelines[J]. J Am Coll Cardiol, 2022, 79(17): e263-e421.
[7] CHRISTENSON S A, SMITH B M, BAFADHEL M, et al. Chronic obstructive pulmonary disease[J]. Lancet, 2022, 399(10342): 2227-2242. doi: 10.1016/S0140-6736(22)00470-6
[8] KESTEN S, REBUCK A S. Management of chronic obstructive pulmonary disease[J]. Drugs, 1989, 38(1): 160-174. doi: 10.2165/00003495-198938010-00007
[9] HOULT G, GILLESPIE D, WILKINSON T M A, et al. Biomarkers to guide the use of antibiotics for acute exacerbations of COPD (AECOPD): a systematic review and meta-analysis[J]. BMC Pulm Med, 2022, 22(1): 194.
[10] HURST J R, HAN M K, SINGH B, et al. Prognostic risk factors for moderate-to-severe exacerbations in patients with chronic obstructive pulmonary disease: a systematic literature review[J]. Respir Res, 2022, 23(1): 213.
[11] VOULGARIS A, ARCHONTOGEORGIS K, STEIROPOULOS P, et al. Cardiovascular disease in patients with chronic obstructive pulmonary disease, obstructive sleep apnoea syndrome and overlap syndrome[J]. Curr Vasc Pharmacol, 2021, 19(3): 285-300.
[12] KOVACS G, AVIAN A, BACHMAIER G, et al. Severe pulmonary hypertension in COPD impact on survival and diagnostic approach[J]. Chest, 2022, 162(1): 202-212.
[13] GREDIC M, BLANCO I, KOVACS G, et al. Pulmonary hypertension in chronic obstructive pulmonary disease[J]. Br J Pharmacol, 2021, 178(1): 132-151.
[14] PELLICORI P, CLELAND J G F, CLARK A L. Chronic obstructive pulmonary disease and heart failure: a breathless conspiracy[J]. Heart Fail Clin, 2020, 16(1): 33-44.
[15] TIAN F, SONG W, WANG L, et al. NT-pro BNP in AECOPD-PH: old biomarker, new insights-based on a large retrospective case-controlled study[J]. Respir Res, 2021, 22(1): 321.
[16] 孙静茹, 汪平, 罗兵, 等. 血清降钙素原、脑钠肽、N末端脑钠肽前体水平对慢性阻塞性肺疾病急性加重期患者合并心力衰竭的诊断价值研究[J]. 实用心脑肺血管病杂志, 2024, 32(6): 68-71. [17] PAVASINI R, TAVAZZI G, BISCAGLIA S, et al. Amino terminal pro brain natriuretic peptide predicts all-cause mortality in patients with chronic obstructive pulmonary disease: Systematic review and meta-analysis[J]. Chron Respir Dis, 2017, 14(2): 117-126.
[18] GUO H J, JIANG F, CHEN C, et al. Plasma brain natriuretic peptide, platelet parameters, and cardiopulmonary function in chronic obstructive pulmonary disease[J]. World J Clin Cases, 2021, 9(36): 11165-11172.
[19] KHALID K, PADDA J, KOMISSAROV A, et al. The coexistence of chronic obstructive pulmonary disease and heart failure[J]. Cureus, 2021, 13(8): e17387.
[20] ARUGASLAN E, KALAYCI S, TUFEKCIOGLU O. Naples prognostic score and clinical outcomes in pulmonary arterial hypertension patients[J]. Sisli Etfal Hastan Tip Bul, 2023, 57(3): 374-379.
[21] HENDRIKS P M, VAN DE GROEP L D, VEEN K M, et al. Prognostic value of brain natriuretic peptides in patients with pulmonary arterial hypertension: a systematic review and meta-analysis[J]. Am Heart J, 2022, 250: 34-44.




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
