Correlations of serum phosphoglycerate mutase family member 5 and YT521-B homology N6-methyladenosine RNA binding protein 2 levels with ventricular remodeling and prognosis in patients with heart failure with preserved ejection fraction
-
摘要:目的
探讨血清磷酸甘油酸变位酶家族成员5(PGAM5)、YT521-B同源N6-甲基腺苷RNA结合蛋白2(YTHDF2)水平与射血分数保留的心力衰竭(HFpEF)患者心室重构和预后的相关性。
方法选取HFpEF患者175例(HFpEF组)为研究对象, 选取同期健康体检志愿者90例为对照组。HFpEF患者根据预后情况分为不良预后组(61例)和良好预后组(114例)。采用酶联免疫吸附法检测血清PGAM5、YTHDF2水平。采用经胸超声心动图检查测量心室重构指标[左心室后壁厚度(LVPWT)、左心室舒张末期内径(LVEDD)、舒张末期室间隔厚度(IVST)和左心室心肌质量指数(LVMI)]。通过Pearson相关性分析法分析血清PGAM5、YTHDF2水平与心室重构指标的相关性。血清PGAM5、YTHDF2水平与HFpEF患者预后的关系及预测效能分别采用多因素非条件Logistic回归分析和受试者工作特征曲线分析。
结果HFpEF组的LVPWT、LVEDD、IVST、LVMI和YTHDF2水平高于对照组, PGAM5水平低于对照组,差异有统计学意义(P < 0.05)。HFpEF患者血清PGAM5与LVPWT、LVEDD、IVST、LVMI呈负相关, YTHDF2与LVPWT、LVEDD、IVST、LVMI呈正相关(P < 0.05)。175例HFpEF患者的不良预后发生率为34.86%(61/175)。不良预后组和良好预后组的年龄、纽约心脏病学会(NYHA)心功能分级、N末端前体B型钠尿肽(NT-proBNP)、LVPWT、LVEDD、IVST、LVMI、PGAM5和YTHDF2比较,差异有统计学意义(P < 0.05); PGAM5高水平和YTHDF2高水平分别为HFpEF患者不良预后的独立保护因素和独立危险因素(P < 0.05)。血清PGAM5、YTHDF2水平联合预测HFpEF患者不良预后的曲线下面积为0.884, 大于血清PGAM5、YTHDF2水平单独预测的0.790、0.791(Z=3.722、3.373, P < 0.001)。
结论HFpEF患者的血清PGAM5水平降低, YTHDF2水平升高,其与心室重构加重和预后不良密切相关。血清PGAM5、YTHDF2水平联合预测HFpEF患者预后的效能较高。
-
关键词:
- 磷酸甘油酸变位酶家族成员5 /
- YT521-B同源N6-甲基腺苷RNA结合蛋白2 /
- 射血分数保留的心力衰竭 /
- 心室重构 /
- 左心室后壁厚度 /
- 左心室舒张末期内径
Abstract:ObjectiveTo investigate the correlation between serum levels of phosphoglycerate mutase family member 5 (PGAM5) and YT521-B homology N6-methyladenosine RNA binding protein 2 (YTHDF2) with ventricular remodeling and prognosis in patients with heart failure with preserved ejection fraction (HFpEF).
MethodsA total of 175 HFpEF patients (HFpEF group) were selected as subjects, and 90 healthy volunteers undergoing physical examinations were chosen as the control group. The HFpEF patients were divided into adverse prognosis group (n=61) and favorable prognosis group (n=114) based on their prognosis status. Serum PGAM5 and YTHDF2 levels were measured using enzyme-linked immunosorbent assay. Ventricular remodeling indicators[left ventricular posterior wall thickness (LVPWT), left ventricular end-diastolic diameter (LVEDD), interventricular septal thickness at end-diastole (IVST) and left ventricular mass index (LVMI)] were assessed by transthoracic echocardiography. Pearson correlationanalysis was used to analyze the relationship between serum PGAM5 and YTHDF2 levels and ventricular remodeling indicators. The relationships of serum PGAM5 and YTHDF2 levels with the prognosis of HFpEF patients, as well as predictive efficacy, were evaluated using multivariate unconditional logistic regression analysis and receiver operating characteristic curve analysis, respectively.
ResultsLevels of LVPWT, LVEDD, IVST, LVMI and YTHDF2 in the HFpEF group were significantly higher than those in the control group, while PGAM5 levels were significantly lower (P < 0.05). Serum PGAM5 levels in HFpEF patients showed negative correlations with LVPWT, LVEDD, IVST and LVMI, whereas YTHDF2 levels showed positive correlation (P < 0.05). The incidence of adverse prognosis among 175 HFpEF patients was 34.86% (61/175). Significant differences were observed in age, New York Heart Association (NYHA) heart function classification, N-terminal pro-B-type natriuretic peptide (NT-proBNP), LVPWT, LVEDD, IVST, LVMI, PGAM5 and YTHDF2 between the adverse prognosis group and favorable prognosis group. High levels of PGAM5 and YTHDF2 were independent protective and risk factors for adverse prognosis in HFpEF patients (P < 0.05). The area under the curve for predicting adverse prognosis in HFpEF patients using combined serum PGAM5 and YTHDF2 levels was 0.884, which was greater than the values obtained from individual predictions of 0.790 and 0.791 (Z=3.722, 3.373; P < 0.001).
ConclusionDecreased serum PGAM5 levels and increased YTHDF2 levels are associated with worsening ventricular remodeling and poor prognosis in HFpEF patients. Combined measurement of serum PGAM5 and YTHDF2 levels shows high predictive efficacy for the prognosis of HFpEF patients.
-
心力衰竭(简称心衰)是心血管疾病的严重表现或心血管疾病患者心室舒张和/或收缩功能障碍的终末阶段。射血分数保留的心力衰竭(HFpEF)约占所有心衰病例的43.8%, 其出院后30 d和1、3年病死率与左心室射血分数(LVEF)降低的心衰患者相当 [1]。因此, 对HFpEF患者的病情进展进行及时预测至关重要。在HFpEF的发生与发展过程中,心室重构起着关键作用,并与线粒体功能障碍及N6-甲基腺苷(m6A)修饰密切相关[2]。磷酸甘油酸变位酶家族成员5(PGAM5)是一种线粒体磷酸酶, 能通过调节线粒体动力学来维持线粒体功能[3]。研究[4]报道, 心衰患者血清PGAM5 mRNA表达降低。YT521-B同源N6-甲基腺苷RNA结合蛋白2(YTHDF2)是一种m6A修饰阅读蛋白,能通过调控mRNA参与多种病理生理过程[5]。研究[6]报道, YTHDF2是HFpEF患者的差异表达m6A修饰阅读蛋白之一。目前, 关于血清PGAM5、YTHDF2水平对HFpEF患者的临床意义尚不清楚。故本研究探讨血清PGAM5、YTHDF2水平与HFpEF患者心室重构和预后的相关性,以期为改善患者预后提供参考。
1. 对象与方法
1.1 研究对象
选取2021年1月—2023年6月收治的HFpEF患者175例(HFpEF组),患者或家属自愿签署知情同意书。纳入标准: (1) 临床资料完整者。(2) 符合HFpEF诊断标准[7]者。①有心衰症状和(或)体征; ② LVEF≥50%; ③ B型利钠肽(BNP)>35 ng/L和(或)N末端前体B型钠尿肽(NT-proBNP)>125 ng/L, 超声心动图提示左心室肥厚和/或左心房扩大或心脏舒张功能异常; ④排除由慢性阻塞性肺疾病、贫血等非心脏疾病引起。(3) 年龄≥18岁者。排除标准: ①拒绝随访或院内死亡者; ②妊娠及哺乳期妇女; ③自身免疫性疾病患者; ④先天性心脏病者; ⑤精神病患者; ⑥合并肝、肾、肺等其他器官严重功能损害者; ⑦血液系统疾病者; ⑧恶性肿瘤患者。另选取同期健康体检志愿者90例(对照组)。本研究经医院伦理委员会批准(审批号: 2020XAKY28-03)。
1.2 方法
1.2.1 PGAM5、YTHDF2水平检测
采集HFpEF患者入院次日和志愿者体检时3 mL静脉血,离心保留血清。采用科鹿(武汉)生物科技有限责任公司提供的PGAM5酶联免疫吸附法试剂(货号: ELK7742)和上海百生跃生物科技有限公司提供的YTHDF2酶联免疫吸附法试剂(货号: BR5587252)检测PGAM5、YTHDF2水平。
1.2.2 心室重构指标测量
HFpEF患者入院后24 h内及志愿者体检时,采用西门子ACUSON Sequoia超声诊断系统进行经胸超声心动图检查。依据《中国成年人超声心动图检查测量指南》[8], 测定左心室后壁厚度(LVPWT)、左心室舒张末期内径(LVEDD)、舒张末期室间隔厚度(IVST)和左心室心肌质量指数(LVMI)。
1.2.3 资料收集
收集HFpEF患者临床资料,包括性别、年龄、病程、纽约心脏病学会(NYHA)心功能分级、合并疾病、吸烟史、饮酒史、血压、LVEF、NT-proBNP和用药情况(胰岛素、钠-葡萄糖共转运蛋白2抑制剂、二甲双胍、肾素-血管紧张素系统抑制剂、β受体阻滞剂、醛固酮受体拮抗剂、袢利尿剂和他汀类药物)。
1.3 预后分组
HFpEF患者按照指南[7]治疗出院后,通过门诊或电话进行为期1年的随访。根据是否出现不稳定型心绞痛、急性心肌梗死等心血管事件、再次心衰加重住院以及心源性死亡情况分为不良预后组(61例)和良好预后组(114例)[9]。不稳定型心绞痛诊断标准: 缺血性胸痛, 心肌肌钙蛋白阴性,心电图显示一过性ST段压低或T波低平、倒置,少见ST段抬高。急性心肌梗死诊断标准: 持续缺血性胸痛,心肌肌钙蛋白或肌酸激酶同工酶水平升高超过第99百分位正常参考值上限,冠状动脉造影异常,超声心动图显示节段性室壁活动异常,心电图显示ST段弓背向上抬高或ST段压低或T波低平、倒置[10]。再次心衰加重住院: 心衰患者病情稳定一段时间后再次出现心衰症状和/或体质量增加,需要住院治疗[7]。心源性死亡: 各种心脏原因导致的死亡。
1.4 统计学分析
采用SPSS 28.0软件分析数据。偏态资料以[M(P25, P75)]表示, 2组间比较采用Wilcoxon符号秩和检验; 正态分布的计量资料以(x±s)表示, 2组间比较采用Student's t检验; 计数资料以[n(%)]表示, 比较采用χ2检验。血清PGAM5、YTHDF2水平与心室重构指标的相关性探讨采用Pearson相关性分析; 血清PGAM5、YTHDF2水平与HFpEF患者预后的关系及预测能效分别采用多因素非条件Logistic回归分析和受试者工作特征(ROC)曲线分析; 检验水准α=0.05。P < 0.05为差异有统计学意义。
2. 结果
2.1 HFpEF组和对照组一般资料、心室重构指标和血清PGAM5、YTHDF2水平
HFpEF组的LVPWT、LVEDD、IVST、LVMI和YTHDF2水平高于对照组, PGAM5水平低于对照组, 差异有统计学意义(P < 0.05)。见表 1。
表 1 2组一般资料、心室重构指标和血清PGAM5、YTHDF2水平比较(x±s)[n(%)]指标 分类 HFpEF组(n=175) 对照组(n=90) χ2/t P 性别 男 91(52.00) 50(55.56) 0.302 0.583 女 84(48.00) 40(44.44) 年龄/岁 68.23±8.39 67.22±7.25 0.971 0.333 病程/年 [KG1]5.89±1.94 — — — LVPWT/mm 13.23±1.29 9.03±1.12 26.169 < 0.001 LVEDD/mm 50.28±4.47 41.06±5.10 15.150 < 0.001 IVST/mm 13.27±1.61 9.12±1.12 24.475 < 0.001 LVMI/(g/m2) 106.92±13.76 80.30±7.57 20.297 < 0.001 PGAM5/(pg/mL) 56.97±6.44 82.72±10.89 -20.664 < 0.001 YTHDF2/(pg/mL) 46.84±5.02 30.44±4.30 26.386 < 0.001 LVPWT: 左心室后壁厚度; LVEDD: 左心室舒张末期内径; IVST: 舒张末期室间隔厚度; LVMI: 左心室心肌质量指数;
PGAM5: 磷酸甘油酸变位酶家族成员5; YTHDF2: YT521-B同源N6-甲基腺苷RNA结合蛋白2。2.2 血清PGAM5、YTHDF2水平与心室重构指标的相关性
Pearson相关性分析显示, HFpEF患者血清PGAM5与LVPWT、LVEDD、IVST、LVMI呈负相关(P < 0.05), YTHDF2与LVPWT、LVEDD、IVST、LVMI呈正相关(P < 0.05)。见表 2。
表 2 血清PGAM5、YTHDF2水平与心室重构指标的相关性心室重构指标 PGAM5 YTHDF2 r P r P LVPWT -0.697 < 0.001 0.690 < 0.001 LVEDD -0.684 < 0.001 0.674 < 0.001 IVST -0.667 < 0.001 0.684 < 0.001 LVMI -0.711 < 0.001 0.705 < 0.001 2.3 不同预后HFpEF患者临床资料和血清PGAM5、YTHDF2水平比较
175例HFpEF患者的不良预后发生率为34.86%(61/175)。不良预后组和良好预后组的年龄、NYHA心功能分级、NT-proBNP、LVPWT、LVEDD、IVST、LVMI、PGAM5和YTHDF2比较, 差异有统计学意义(P < 0.05); 2组性别、病程、合并疾病等资料比较,差异无统计学意义(P>0.05)。见表 3。
表 3 不同预后HFpEF患者临床资料和血清PGAM5、YTHDF2水平比较(x±s)[n(%)]资料 分类 不良预后组(n=61) 良好预后组(n=114) χ2/t P 性别 男 33(54.10) 58(50.88) 0.165 0.684 女 28(45.90) 56(49.12) 年龄/岁 70.38±8.90 67.09±7.91 2.509 0.013 病程/年 6.03±1.89 5.82±1.97 0.705 0.482 NYHA心功能分级 ≥Ⅲ级 41(67.21) 33(28.95) 23.842 < 0.001 < Ⅲ级 20(32.79) 81(71.05) 合并疾病 糖尿病 23(37.70) 28(24.56) 3.324 0.068 高血压 48(78.69) 84(73.68) 0.537 0.464 冠心病 30(49.18) 53(46.49) 0.115 0.734 心房颤动 29(47.54) 63(55.26) 0.950 0.330 高脂血症 20(32.79) 28(24.56) 1.351 0.245 吸烟史 是 15(24.59) 23(20.18) 0.456 0.500 否 46(75.41) 91(79.82) 饮酒史 是 12(19.67) 19(16.67) 0.002 0.967 否 49(80.33) 95(83.33) 收缩压/mmHg 142.31±18.80 138.15±15.91 1.547 0.124 舒张压/mmHg 85.56±15.92 82.39±14.31 1.339 0.182 LVEF/% 55.46±[KG1*3/4]4.48 55.54±[KG1*3/4]4.05 -0.123 0.902 NT-proBNP/(pg/mL) 3 338.60±1 151.72 2 447.06±1 003.06 5.317 < 0.001 LVPWT/mm 13.84±[KG1*3/4]1.12 12.90±[KG1*3/4]1.26 4.883 < 0.001 LVEDD/mm 52.36±[KG1*3/4]3.94 49.17±[KG1*3/4]4.36 4.762 < 0.001 IVST/mm 14.05±[KG1*3/4]1.46 12.85±[KG1*3/4]1.54 4.972 < 0.001 LVMI/(g/m2) 1 114.12±13.41 103.06±12.38 5.473 < 0.001 用药情况 胰岛素 10(16.39) 13(11.40) 0.867 0.352 钠-葡萄糖共转运蛋白2抑制剂 9(14.75) 9(7.89) 2.026 0.155 二甲双胍 5(8.20) 5(4.39) 0.481 0.488 肾素-血管紧张素系统抑制剂 30(49.18) 40(35.09) 3.288 0.070 β受体阻滞剂 33(54.10) 58(50.88) 0.165 0.684 醛固酮受体拮抗剂 8(13.11) 19(16.67) 0.384 0.535 袢利尿剂 36(59.02) 70(61.40) 0.095 0.758 他汀类药物 20(32.79) 28(24.56) 1.351 0.245 PGAM5/(pg/mL) 52.59±5.85 59.31±5.45 -7.570 < 0.001 YTHDF2/(pg/mL) 50.16±4.11 45.06±4.55 7.303 < 0.001 1 mmHg=0.133 kPa。NYHA: 纽约心脏病学会; LVEF: 左心室射血分数; NT-proBNP: N末端前体B型钠尿肽;
LVPWT: 左心室后壁厚度; LVEDD: 左心室舒张末期内径; IVST: 舒张末期室间隔厚度; LVMI: 左心室心肌质量指数;
PGAM5: 磷酸甘油酸变位酶家族成员5; YTHDF2: YT521-B同源N6-甲基腺苷RNA结合蛋白2。2.4 血清PGAM5、YTHDF2水平与HFpEF患者预后的多因素非条件Logistic回归分析
以HFpEF患者预后(不良=1, 良好=0)为因变量, PGAM5、YTHDF2为自变量(原值录入),年龄(原值录入)、NYHA心功能分级(≥Ⅲ级=1, < Ⅲ级=0)、NT-proBNP(原值录入)为协变量,进行多因素非条件Logistic回归分析(心室重构指标与PGAM5、YTHDF2存在强共线性,故不纳入)。调整混杂因素后, PGAM5高水平和YTHDF2高水平分别为HFpEF患者不良预后的独立保护因素和独立危险因素(P < 0.05), 见表 4。
表 4 多因素非条件Logistic回归分析变量 β SE Wald χ2 P OR 95%CI 高龄 0.048 0.033 2.133 0.144 1.049 0.984~1.120 NYHA心功能分级≥Ⅲ级 2.123 0.554 14.676 < 0.001 8.360 2.821~24.774 NT-proBNP高水平 0.001 < 0.001 13.521 < 0.001 1.001 1.000~1.001 PGAM5高水平 -0.261 0.057 21.195 < 0.001 0.770 0.689~0.861 YTHDF2高水平 0.302 0.064 22.416 < 0.001 1.352 1.194~1.533 2.5 血清PGAM5、YTHDF2水平对HFpEF患者不良预后的预测效能
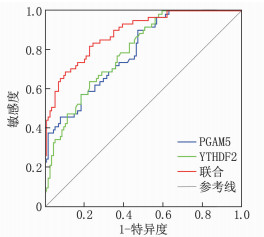
通过Logistic回归拟合血清PGAM5、YTHDF2水平联合预测HFpEF患者不良预后的概率[Logit(P)=-0.986-0.240×PGAM5+0.291×YTHDF2]。ROC曲线显示, 血清PGAM5、YTHDF2水平联合预测HFpEF患者不良预后的曲线下面积为0.884, 大于血清PGAM5、YTHDF2水平单独预测的0.790、0.791(Z=3.722、3.373, P < 0.001)。见表 5、图 1。
表 5 血清PGAM5、YTHDF2水平对HFpEF患者不良预后的预测效能指标 曲线下面积 95%CI P Cut-off 敏感度/% 特异度/% 约登指数 PGAM5 0.790 0.722~0.848 < 0.001 57.12 pg/mL 90.16 52.63 0.428 YTHDF2 0.791 0.723~0.848 < 0.001 48.40 pg/mL 63.93 77.19 0.411 二者联合 0.884 0.827~0.928 < 0.001 0.31 81.97 77.19 0.592 3. 讨论
HFpEF是一种以左心室舒张功能受损为特征的心衰。近年来心衰的诊断和治疗取得较大进展,但患者预后仍较差[11-12]。目前,临床主要依靠NT-proBNP或BNP评估HFpEF患者预后,但其受到年龄、肾功能、肥胖、性别等因素影响,新型标志物如乳糖凝集素3等虽与心衰患者预后相关,但对不同心衰类型患者预后的预测效能较差[13]。因此, 需寻找新的生物标志物具有重要意义。
心室重构是HFpEF发生与发展的关键机制,多种风险因素可引发心室重构,使心脏在舒张期无法有效充盈,造成心排血量不足,从而促进HFpEF的发生与发展[1]。本研究中, HFpEF患者的心室重构指标(LVPWT、LVEDD、IVST、LVMI)较健康志愿者显著升高,与既往研究[8]结果一致, 表明HFpEF患者存在明显的心室重构。线粒体功能障碍在心室重构中起着至关重要的作用[14]。PGAM5是一种位于线粒体外膜的丝氨酸/苏氨酸磷酸酶,能通过去磷酸化作用和激活多种底物,维持线粒体功能[3]。PGAM5降低通过破坏Kelch样ECH关联蛋白1/核转录因子红系2相关因子2(Keap1/Nrf2)抗氧化反应信号通路, 加重大鼠心肌损伤[15]。激活PGAM5/动力蛋白相关蛋白1信号通路能使线粒体裂变正常,并减少心肌细胞凋亡和改善心脏功能[16]。研究[4]显示, 心衰患者血清和大鼠心脏中的PGAM5 mRNA水平较低,且影响炎症反应和氧化应激。本研究中, HFpEF患者的血清PGAM5水平显著降低,与心室重构指标呈负相关, PGAM5水平升高与不良预后风险降低相关。可能机制为PGAM5升高能促进Keap1泛素化,激活Keap1/Nrf2信号通路,抑制心肌细胞的炎症反应、氧化应激及铁死亡,从而缓解心室重构,降低不良预后风险[4]。PGAM5还可以与多种底物结合保护线粒体功能,减少心肌细胞损伤,改善心室重构[17]。
m6A甲基化修饰是哺乳动物最广泛的RNA修饰方式, 参与调节炎症反应、细胞增殖、细胞迁移、氧化应激及细胞凋亡等病理、生理过程,在心衰的发生与发展中具有重要作用[18]。YTHDF2是广泛表达的m6A RNA结合蛋白, 能够识别m6A修饰的mRNA, 加速其降解而影响多种mRNA的降解过程[5]。在血管紧张素Ⅱ诱导的大鼠心肌损伤模型中, 沉默YTHDF2可以缓解心肌细胞肥大和凋亡[19]; 在糖尿病心肌病小鼠中, YTHDF2通过上调叉头框蛋白O3(FOXO3)激活河马信号通路,促进心肌细胞凋亡[20]。上述研究表明, YTHDF2与心肌损伤密切相关。研究[6]发现, YTHDF2在HFpEF患者外周血单核细胞和小鼠心脏中表达上调; 研究[21]表明, 血清YTHDF2表达上调与心衰患者对沙库巴曲缬沙坦钠耐药性相关。本研究中, HFpEF患者的血清YTHDF2水平升高,与心室重构指标呈正相关,并与不良预后风险增加相关。分析机制可能是, YTHDF2升高能增强过氧化物酶体增殖物激活受体α、肉碱棕榈酰转移酶1A、溶质载体家族7成员11表达,促进心脏肥大和心肌细胞铁死亡,加重心室结构和功能改变,从而加剧心室重构并增加不良预后风险[22-23]。本研究ROC曲线显示,在对HFpEF患者不良预后的预测中,血清PGAM5、YTHDF2水平联合预测的曲线下面积大于单独预测,说明血清PGAM5、YTHDF2水平联合能更好地预测HFpEF患者预后。但本研究仅分析了血清PGAM5、YTHDF2水平对HFpEF患者心室重构和预后的影响,其具体作用机制还需进一步实验发现。
综上所述,血清PGAM5水平降低、YTHDF2水平升高与HFpEF患者心室重构加重和预后不良相关,二者联合应用对HFpEF患者的预后具有较高的预测效能。
-
表 1 2组一般资料、心室重构指标和血清PGAM5、YTHDF2水平比较(x±s)[n(%)]
指标 分类 HFpEF组(n=175) 对照组(n=90) χ2/t P 性别 男 91(52.00) 50(55.56) 0.302 0.583 女 84(48.00) 40(44.44) 年龄/岁 68.23±8.39 67.22±7.25 0.971 0.333 病程/年 [KG1]5.89±1.94 — — — LVPWT/mm 13.23±1.29 9.03±1.12 26.169 < 0.001 LVEDD/mm 50.28±4.47 41.06±5.10 15.150 < 0.001 IVST/mm 13.27±1.61 9.12±1.12 24.475 < 0.001 LVMI/(g/m2) 106.92±13.76 80.30±7.57 20.297 < 0.001 PGAM5/(pg/mL) 56.97±6.44 82.72±10.89 -20.664 < 0.001 YTHDF2/(pg/mL) 46.84±5.02 30.44±4.30 26.386 < 0.001 LVPWT: 左心室后壁厚度; LVEDD: 左心室舒张末期内径; IVST: 舒张末期室间隔厚度; LVMI: 左心室心肌质量指数;
PGAM5: 磷酸甘油酸变位酶家族成员5; YTHDF2: YT521-B同源N6-甲基腺苷RNA结合蛋白2。表 2 血清PGAM5、YTHDF2水平与心室重构指标的相关性
心室重构指标 PGAM5 YTHDF2 r P r P LVPWT -0.697 < 0.001 0.690 < 0.001 LVEDD -0.684 < 0.001 0.674 < 0.001 IVST -0.667 < 0.001 0.684 < 0.001 LVMI -0.711 < 0.001 0.705 < 0.001 表 3 不同预后HFpEF患者临床资料和血清PGAM5、YTHDF2水平比较(x±s)[n(%)]
资料 分类 不良预后组(n=61) 良好预后组(n=114) χ2/t P 性别 男 33(54.10) 58(50.88) 0.165 0.684 女 28(45.90) 56(49.12) 年龄/岁 70.38±8.90 67.09±7.91 2.509 0.013 病程/年 6.03±1.89 5.82±1.97 0.705 0.482 NYHA心功能分级 ≥Ⅲ级 41(67.21) 33(28.95) 23.842 < 0.001 < Ⅲ级 20(32.79) 81(71.05) 合并疾病 糖尿病 23(37.70) 28(24.56) 3.324 0.068 高血压 48(78.69) 84(73.68) 0.537 0.464 冠心病 30(49.18) 53(46.49) 0.115 0.734 心房颤动 29(47.54) 63(55.26) 0.950 0.330 高脂血症 20(32.79) 28(24.56) 1.351 0.245 吸烟史 是 15(24.59) 23(20.18) 0.456 0.500 否 46(75.41) 91(79.82) 饮酒史 是 12(19.67) 19(16.67) 0.002 0.967 否 49(80.33) 95(83.33) 收缩压/mmHg 142.31±18.80 138.15±15.91 1.547 0.124 舒张压/mmHg 85.56±15.92 82.39±14.31 1.339 0.182 LVEF/% 55.46±[KG1*3/4]4.48 55.54±[KG1*3/4]4.05 -0.123 0.902 NT-proBNP/(pg/mL) 3 338.60±1 151.72 2 447.06±1 003.06 5.317 < 0.001 LVPWT/mm 13.84±[KG1*3/4]1.12 12.90±[KG1*3/4]1.26 4.883 < 0.001 LVEDD/mm 52.36±[KG1*3/4]3.94 49.17±[KG1*3/4]4.36 4.762 < 0.001 IVST/mm 14.05±[KG1*3/4]1.46 12.85±[KG1*3/4]1.54 4.972 < 0.001 LVMI/(g/m2) 1 114.12±13.41 103.06±12.38 5.473 < 0.001 用药情况 胰岛素 10(16.39) 13(11.40) 0.867 0.352 钠-葡萄糖共转运蛋白2抑制剂 9(14.75) 9(7.89) 2.026 0.155 二甲双胍 5(8.20) 5(4.39) 0.481 0.488 肾素-血管紧张素系统抑制剂 30(49.18) 40(35.09) 3.288 0.070 β受体阻滞剂 33(54.10) 58(50.88) 0.165 0.684 醛固酮受体拮抗剂 8(13.11) 19(16.67) 0.384 0.535 袢利尿剂 36(59.02) 70(61.40) 0.095 0.758 他汀类药物 20(32.79) 28(24.56) 1.351 0.245 PGAM5/(pg/mL) 52.59±5.85 59.31±5.45 -7.570 < 0.001 YTHDF2/(pg/mL) 50.16±4.11 45.06±4.55 7.303 < 0.001 1 mmHg=0.133 kPa。NYHA: 纽约心脏病学会; LVEF: 左心室射血分数; NT-proBNP: N末端前体B型钠尿肽;
LVPWT: 左心室后壁厚度; LVEDD: 左心室舒张末期内径; IVST: 舒张末期室间隔厚度; LVMI: 左心室心肌质量指数;
PGAM5: 磷酸甘油酸变位酶家族成员5; YTHDF2: YT521-B同源N6-甲基腺苷RNA结合蛋白2。表 4 多因素非条件Logistic回归分析
变量 β SE Wald χ2 P OR 95%CI 高龄 0.048 0.033 2.133 0.144 1.049 0.984~1.120 NYHA心功能分级≥Ⅲ级 2.123 0.554 14.676 < 0.001 8.360 2.821~24.774 NT-proBNP高水平 0.001 < 0.001 13.521 < 0.001 1.001 1.000~1.001 PGAM5高水平 -0.261 0.057 21.195 < 0.001 0.770 0.689~0.861 YTHDF2高水平 0.302 0.064 22.416 < 0.001 1.352 1.194~1.533 表 5 血清PGAM5、YTHDF2水平对HFpEF患者不良预后的预测效能
指标 曲线下面积 95%CI P Cut-off 敏感度/% 特异度/% 约登指数 PGAM5 0.790 0.722~0.848 < 0.001 57.12 pg/mL 90.16 52.63 0.428 YTHDF2 0.791 0.723~0.848 < 0.001 48.40 pg/mL 63.93 77.19 0.411 二者联合 0.884 0.827~0.928 < 0.001 0.31 81.97 77.19 0.592 -
[1] 射血分数保留的心力衰竭诊断与治疗中国专家共识制定工作组. 射血分数保留的心力衰竭诊断与治疗中国专家共识2023[J]. 中国循环杂志, 2023, 38(4): 375-393. [2] BENAK D, KOLAR F, HLAVACKOVA M. Epitranscriptomic regulations in the heart[J]. Physiol Res, 2024, 73(Suppl 1): S185-S198.
[3] 程高敏, 肖炜明. 磷酸甘油酸变位酶5的功能及其在疾病中的作用的研究进展[J]. 国际医药卫生导报, 2020, 26(18): 2830-2833. [4] LI S F, WEN P, ZHANG D Y, et al. PGAM5 expression levels in heart failure and protection ROS-induced oxidative stress and ferroptosis by Keap1/Nrf2[J]. Clin Exp Hypertens, 2023, 45(1): 2162537.
[5] CHEN L, GAO Y, XU S M, et al. N6-methyladenosine reader YTHDF family in biological processes: Structures, roles, and mechanisms[J]. Front Immunol, 2023, 14: 1162607.
[6] ZHANG B J, XU Y M, CUI X T, et al. Alteration of m6A RNA methylation in heart failure with preserved ejection fraction[J]. Front Cardiovasc Med, 2021, 8: 647806.
[7] 中华医学会心血管病学分会, 中华心血管病杂志编辑委员会. 中国心力衰竭诊断和治疗指南2014[J]. 中国实用乡村医生杂志, 2015, 22(2): 6-12. [8] 中华医学会超声医学分会超声心动图学组. 中国成年人超声心动图检查测量指南[J]. 中华超声影像学杂志, 2016, 25(8): 645-666. [9] 吴秀娟, 林松, 马珂, 等. 心肺运动试验联合NT-proBNP在射血分数保留心力衰竭患者不良预后中的预测价值[J]. 中国循证心血管医学杂志, 2024, 16(2): 167-172. [10] 中国医师协会急诊医师分会, 国家卫健委能力建设与继续教育中心急诊学专家委员会, 中国医疗保健国际交流促进会急诊急救分会. 急性冠脉综合征急诊快速诊治指南(2019)[J]. 中华急诊医学杂志, 2019, 28(4): 421-428. doi: 10.3760/cma.j.issn.1671-0282.2019.04.003 [11] MADDOX T M, JANUZZI J L Jr, ALLEN L A, et al. 2024 ACC expert consensus decision pathway for treatment of heart failure with reduced ejection fraction: a report of the American college of cardiology solution set oversight committee[J]. J Am Coll Cardiol, 2024, 83(15): 1444-1488. doi: 10.1016/j.jacc.2023.12.024
[12] 苗艳丽, 李红净, 周海静, 等. 射血分数保留的心力衰竭患者血清Myostatin、DLL1与心室重构指标和预后的关系研究[J]. 国际检验医学杂志, 2024, 45(7): 841-846. [13] 中国医师协会心力衰竭专业委员会, 国家心血管病专家委员会心力衰竭专业委员会, 中华心力衰竭和心肌病杂志编辑委员会, 等. 心力衰竭生物标志物临床应用中国专家共识[J]. 中华心力衰竭和心肌病杂志: 中英文, 2022, 6(3): 175-192. [14] GALLO G, RUBATTU S, VOLPE M. Mitochondrial dysfunction in heart failure: from pathophysiological mechanisms to therapeutic opportunities[J]. Int J Mol Sci, 2024, 25(5): 2667.
[15] NORDGREN K K S, WALLACE K B. Disruption of the Keap1/Nrf2-antioxidant response system after chronic doxorubicin exposure in vivo[J]. Cardiovasc Toxicol, 2020, 20(6): 557-570.
[16] FAN Z G, XU Y, CHEN X, et al. Appropriate dose of dapagliflozin improves cardiac outcomes by normalizing mitochondrial fission and reducing cardiomyocyte apoptosis after acute myocardial infarction[J]. Drug Des Devel Ther, 2022, 16: 2017-2030.
[17] WANG Y L, REN T T, LI C Z, et al. Mechanisms involved in the regulation of mitochondrial quality control by PGAM5 in heart failure[J]. Cell Stress Chaperones, 2024, 29(3): 510-518.
[18] ZHANG Y S, LIU Z Y, LIU Z Y, et al. m6A epitranscriptomic modification of inflammation in cardiovascular disease[J]. Int Immunopharmacol, 2024, 134: 112222.
[19] 江克兵, 徐璐晴, 沈涤非. 沉默YTH结构域家族蛋白2改善血管紧张素Ⅱ诱导的大鼠原代心肌细胞肥大与凋亡[J]. 中华老年心脑血管病杂志, 2024, 26(2): 202-206. [20] SHAO Y C, LI M M, YU Q, et al. CircRNA CDR1as promotes cardiomyocyte apoptosis through activating hippo signaling pathway in diabetic cardiomyopathy[J]. Eur J Pharmacol, 2022, 922: 174915.
[21] SU J, HU Y C, CHENG J, et al. Comprehensive analysis of the RNA transcriptome expression profiles and construction of the CeRNA network in heart failure patients with sacubitril/valsartan therapeutic heterogeneity after acute myocardial infarction[J]. Eur J Pharmacol, 2023, 944: 175547.
[22] YANG Y Q, MBIKYO M B, ZHANG J Z, et al. The lncRNA MIAT regulates CPT-1a mediated cardiac hypertrophy through m6A RNA methylation reading protein Ythdf2[J]. Cell Death Discov, 2022, 8(1): 167.
[23] TANG Z Y, HUANG X, MEI H Y, et al. Silencing of METTL3 suppressed ferroptosis of myocardial cells by m6A modification of SLC7A11 in a YTHDF2 manner[J]. J Bioenerg Biomembr, 2024, 56(2): 149-157.




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号