Expression levels of serum heat shock protein 70, osteopontin and matrix metalloproteinase-9 in patients with valvular heart disease and their correlations with cardiac function
-
摘要:目的
探讨瓣膜性心脏病患者血清热休克蛋白70(HSP70)、骨桥蛋白(OPN)、基质金属蛋白酶-9(MMP-9)表达水平及其与心功能的相关性。
方法选取瓣膜性心脏病患者168例作为研究组,另选取同期体检的健康者100例作为健康组。检测并比较2组血清HSP70、OPN、MMP-9的表达水平。将168例患者根据心功能分级分为Ⅱ级组(n=68)、Ⅲ级组(n=57)和Ⅳ级组(n=43),比较不同心功能分级的瓣膜性心脏病患者的血清HSP70、OPN、MMP-9表达水平。分析血清HSP70、OPN、MMP-9表达水平与左心室射血分数(LVEF)的相关性。筛选瓣膜性心脏病患者心功能分级的影响因素。采用受试者工作特征(ROC)曲线分析血清HSP70、OPN、MMP-9对瓣膜性心脏病患者心功能分级的诊断效能。
结果研究组血清HSP70、OPN、MMP-9表达水平高于健康组,差异有统计学意义(P < 0.05)。多瓣膜病变患者血清HSP70、OPN、MMP-9表达水平高于单瓣膜病变患者,差异有统计学意义(P < 0.05)。Ⅲ级组、Ⅳ级组患者的血清HSP70、OPN、MMP-9表达水平高于Ⅱ级组,差异有统计学意义(P < 0.05); Ⅳ级组血清HSP70、OPN、MMP-9表达水平高于Ⅲ级组,差异有统计学意义(P < 0.05)。年龄、合并糖尿病、疾病分类、LVEF、HSP70、OPN、MMP-9是瓣膜性心脏病患者心功能分级的影响因素(P < 0.05)。血清HSP70、OPN、MMP-9与瓣膜性心脏病患者心功能指标LVEF呈显著负相关(r=-0.611、-0.584、-0.624, P < 0.001)。血清HSP70、OPN、MMP-9联合诊断瓣膜性心脏病患者心功能分级的效能优于其单独诊断(P < 0.05)。
结论瓣膜性心脏病患者的血清HSP70、OPN和MMP-9水平呈高表达,并随着心功能分级的增加而进一步升高。
Abstract:ObjectiveTo investigate the expression levels of heat shock protein 70 (HSP70), osteopontin (OPN) and matrix metalloproteinase-9 (MMP-9) in patients with valvular heart disease and their correlations with cardiac function.
MethodsA total of 168 patients with valvular heart disease were selected as study group, while 100 healthy individuals who underwent physical examination during the same period served as healthy control group. Serum levels of HSP70, OPN and MMP-9 were measured and compared between the two groups. The 168 patients were further divided into grade Ⅱ group (n=68), grade Ⅲ group (n=57) and grade Ⅳ group (n=43) based on the classification of cardiac function in patients with valvular heart disease. Serum levels of HSP70, OPN and MMP-9 were compared among different cardiac function grades. The correlations of serum levels of HSP70, OPN and MMP-9 with left ventricular ejection fraction (LVEF) were analyzed. Factors influencing cardiac function grading in patients with valvular heart disease were screened. Receiver operating characteristic (ROC) curve analysis was used to evaluate the diagnostic efficacy of serum HSP70, OPN and MMP-9 for cardiac function grading in patients with valvular heart disease.
ResultsSerum levels of HSP70, OPN and MMP-9 in the study group were significantly higher than those in the healthy control group (P < 0.05). Patients with multiple valve lesions had significantly higher serum levels of HSP70, OPN and MMP-9 compared to those with single valve lesions (P < 0.05). Serum levels of HSP70, OPN and MMP-9 in grade Ⅲ group and grade Ⅳ group were significantly higher than those in the grade Ⅱ group (P < 0.05); serum levels of HSP70, OPN and MMP-9 in the grade Ⅳ group were significantly higher than those in the grade Ⅲ group (P < 0.05). Age, co-morbid diabetes, disease classification, LVEF, HSP70, OPN and MMP-9 were identified as factors influencing cardiac function grading in patients with valvular heart disease (P < 0.05). Serum levels of HSP70, OPN and MMP-9 showed significant negative correlations with LVEF in patients with valvular heart disease (r=-0.611, -0.584, -0.624, P < 0.001). Combined diagnosis using serum HSP70, OPN and MMP-9 demonstrated superior diagnostic performance for cardiac function grading in patients with valvular heart disease compared to individual markers (P < 0.05).
ConclusionSerum levels of HSP70, OPN and MMP-9 are elevated in patients with valvular heart disease and increase with the progression of cardiac function grading.
-
心脏包括主动脉瓣、二尖瓣、三尖瓣和肺动脉瓣,这4个瓣膜可防止血液在心脏中回流,保证血液循环的压力梯度。瓣膜性心脏病是一种累及单个或多个瓣膜的常见心脏疾病,患者常伴有心绞痛、心慌气短、呼吸困难等症状,可引起心力衰竭[1]。瓣膜性心脏病发病率呈升高趋势,其已逐渐成为心血管疾病死亡的主要病因[2]。随着瓣膜性心脏病的病情进展,患者的心功能逐渐衰退,严重威胁其生命安全。因此,明确心功能损伤的机制对于挽救患者生命至关重要[3]。热休克蛋白(HSP)是一组在应激源刺激下所产生的蛋白质,其中HSP70是最丰富的热休克蛋白。HSP70被认为是内源性应激蛋白,可避免心肌缺血再灌注损伤[4]。骨桥蛋白(OPN)属于多功能分泌型糖蛋白化磷蛋白,与机体炎症反应、组织钙化、血管重塑有关。OPN在瓣膜性心脏病中,通过促进心脏瓣膜钙化和加重炎症反应,诱导心室重构,从而加重心肌损伤,诱导病情进展[5]。基质金属蛋白酶-9(MMP-9)属于锌离子依赖性明胶酶,其主要通过降解血管基底膜的成分Ⅳ型胶原,诱导冠状动脉粥样斑块钙化、主动脉狭窄[6]。基于此,本研究探讨血清HSP70、OPN、MMP-9与瓣膜性心脏病患者心功能的相关性,以期为临床瓣膜性心脏病心功能减退机制的研究提供参考。
1. 资料与方法
1.1 一般资料
选取2022年1月—2024年1月于内蒙古医科大学附属医院就诊的168例瓣膜性心脏病患者作为研究组。其中,男89例,女79例; 年龄45~68岁,平均(54.65±5.87)岁; 疾病分类: 单瓣膜病变115例,多瓣膜病变53例; 美国纽约心脏病学会(NYHA)分级: Ⅱ级68例, Ⅲ级57例, Ⅳ级43例。纳入标准: ①符合欧洲心脏病学会(ESC)和欧洲心胸外科协会(EACTS)瓣膜性心脏疾病管理工作组[7]制定的瓣膜性心脏病及各分型的诊断标准者; ②经超声心动图证实为瓣膜性心脏病,超声心动图显示心脏瓣膜存在中重度狭窄或中重度反流者。排除标准: ①先天心功能不全者; ②既往心脏瓣膜病手术史者; ③肝、肾等重要脏器功能不全者; ④近1个月,接受过瓣膜性心脏病治疗者; ⑤伴有恶性肿瘤者; ⑥患有精神疾病、沟通障碍者; ⑦参与其他类型研究者。另选取同期体检的健康志愿者100例作为健康组。健康组男56例,女44例; 年龄45~70岁,平均(53.98±5.93)岁; 既往无心脏疾病史,体检结果正常。2组研究对象均知情本研究,并签署知情同意书。本研究已通过医院伦理委员会审批(批准号: 20210077)。
1.2 方法
1.2.1 血清HSP70、OPN、MMP-9表达水平检测
抽取研究组入院次日及健康组体检当日6 mL空腹静脉血, 3 500 r/min离心15 min, 离心半径为10 cm, 获得上清液,置于-80 ℃冰箱内待测。使用酶联免疫吸附试验(ELISA)法检测血清HSP70、OPN、MMP-9表达水平。检测步骤: 取ELISA试剂盒,设置标准品孔、待测样本孔,试剂盒复温。每孔100 μL标准品、血清样本、生物素标记的抗体工作液、酶结合物溶解。孵育1 h后,加100 μL显色剂,避光显色20 min, 而后加100 μL终止液,在450 nm波长处测定光密度(OD)值,绘制标准曲线,获得血清HSP70、OPN、MMP-9表达水平。
1.2.2 心功能指标检测及心功能分级分组
使用飞利浦Philips EPIQ7C彩色多普勒超声诊断仪检测研究对象左心室射血分数(LVEF)水平。根据NYHA分级标准将168例瓣膜性心脏病患者分为Ⅱ级组(n=68)、Ⅲ级组(n=57)和Ⅳ级组(n=43)。统计3组性别、年龄、吸烟史、饮酒史、合并基础疾病、心脏病家族史、疾病分类及实验室指标[空腹血糖(FBG)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、白细胞(WBC)、血小板(PLT)、血小板与淋巴细胞比值(PLR)和中性粒细胞与淋巴细胞比值(NLR)]和LVEF等资料。
1.3 观察指标
① 比较健康组、研究组的血清HSP70、OPN、MMP-9表达水平差异。分析不同分类的瓣膜性心脏病患者血清HSP70、OPN、MMP-9表达水平差异; ②比较不同心功能分级患者血清HSP70、OPN、MMP-9表达水平差异。采用Pearson相关性分析探讨血清HSP70、OPN、MMP-9与心功能指标LVEF的相关性; ③筛选瓣膜性心脏病患者心功能分级的影响因素。④分析HSP70、OPN、MMP-9诊断瓣膜性心脏病患者心功能分级的价值。
1.4 统计学分析
采用SPSS 25.0软件分析数据。计量资料采用(x±s)描述, 2组间比较采用独立样本t检验,多组间比较采用方差齐性检验,多组间两两比较采用LSD-t事后分析方法检验; 计数资料比较采用[n(%)]描述, 2组间比较采用χ2检验。采用Pearson相关性分析法分析血清HSP70、OPN、MMP-9与心功能指标LVEF的相关性。采用多因素Logistic回归分析筛选瓣膜性心脏病患者心功能分级的影响因素。采用受试者工作特征(ROC)曲线预测HSP70、OPN、MMP-9诊断瓣膜性心脏病患者心功能分级的价值。P < 0.05为差异具有统计学意义。
2. 结果
2.1 研究对象血清HSP70、OPN、MMP-9表达水平比较
研究组血清HSP70、OPN、MMP-9表达水平高于健康组,差异有统计学意义(P < 0.05)。多瓣膜病变患者血清HSP70、OPN、MMP-9表达水平高于单瓣膜病变患者,差异有统计学意义(P < 0.05)。见表 1、表 2。
表 1 2组研究对象血清HSP70、OPN、MMP-9表达水平比较(x±s)μg/L 组别 n HSP70 OPN MMP-9 健康组 100 10.02±1.10 41.23±3.74 115.34±15.76 研究组 168 21.98±1.76* 65.45±6.19* 723.56±87.90* HSP70: 热休克蛋白70; OPN: 骨桥蛋白;
MMP-9: 基质金属蛋白酶-9。与健康组比较, * P < 0.05。表 2 不同瓣膜性心脏病疾病分类患者血清HSP70、OPN、MMP-9表达水平比较(x±s)μg/L 疾病分类 n HSP70 OPN MMP-9 单瓣膜病变 115 17.56±1.34 52.42±5.12 695.46±100.84 多瓣膜病变 53 24.65±2.87* 70.98±7.88* 795.32±102.32* 与单瓣膜病变比较, * P < 0.05。 2.2 不同心功能分级瓣膜性心脏病患者血清HSP70、OPN、MMP-9表达水平
Ⅲ级组、Ⅳ级组患者血清HSP70、OPN、MMP-9表达水平高于Ⅱ级组,差异有统计学意义(P < 0.05); Ⅳ级组血清HSP70、OPN、MMP-9表达水平高于Ⅲ级组,差异有统计学意义(P < 0.05)。见表 3。
表 3 不同心功能分级瓣膜性心脏病患者血清HSP70、OPN、MMP-9表达水平比较(x±s)μg/L 组别 n HSP70 OPN MMP-9 Ⅱ级组 68 15.46±1.12 49.80±5.46 611.21±65.75 Ⅲ级组 57 22.31±2.76* 69.95±7.82* 729.09±75.45* Ⅳ级组 43 29.98±3.42*# 86.56±11.23*# 856.64±102.13*# 与Ⅱ级组比较, * P < 0.05; 与Ⅲ级组比较, #P < 0.05; 2.3 不同心功能分级瓣膜性心脏病患者临床资料分析
不同心功能分级患者年龄、合并糖尿病占比、疾病分类和LVEF比较,差异有统计学意义(P < 0.05)。见表 4。
表 4 不同心功能分级瓣膜性心脏病患者临床资料分析(x±s)[n(%)]资料 分类 Ⅱ级组(n=68) Ⅲ级组(n=57) Ⅳ级组(n=43) 性别 男 34(50.00) 32(56.14) 23(53.49) 女 34(50.00) 25(43.86) 20(46.51) 年龄 ≥60岁 23(33.82) 35(61.40)* 37(86.05)*# < 60岁 45(66.18) 22(38.60)* 6(13.95)*# 吸烟史 是 15(22.06) 10(17.54) 8(18.60) 否 53(77.94) 47(82.46) 35(81.40) 饮酒史 是 13(19.12) 12(21.05) 9(20.93) 否 55(80.88) 45(78.95) 34(79.07) 合并基础疾病 高血压 12(17.65) 13(22.81) 11(25.58) 糖尿病 12(17.65) 19(33.33)* 23(53.49)*# 高脂血症 7(10.29) 5(8.77) 4(9.30) 心脏病家族史 有 6(8.82) 4(7.02) 1(2.33) 无 62(91.18) 53(92.98) 42(97.67) 疾病分类 单瓣膜病变 32(47.06) 43(75.44)* 40(93.02)*# 多瓣膜病变 36(52.94) 14(24.56)* 3(6.98)*# 实验室指标 FBG/(mmol/L) 6.48±0.45 6.62±0.40 6.56±0.42 TC/(mmol/L) 4.53±0.29 4.61±0.30 4.39±0.37 TG/(mmol/L) 1.54±0.21 1.52±0.20 1.56±0.22 HDL-C/(mmol/L) 1.21±0.12 1.19±0.13 1.23±0.14 LDL-C/(mmol/L) 3.04±0.23 3.06±0.22 3.12±0.21 WBC/(×109/L) 7.11±0.38 7.12±0.29 7.15±0.32 PLT/(×109/L) 192.12±20.23 193.42±21.31 192.87±20.43 PLR 88.12±9.43 88.43±9.54 88.25±8.79 NLR 2.13±0.15 2.18±0.14 2.21±0.15 LVEF/% 61.68±8.98 50.35±5.67* 41.87±4.29*# FBG: 空腹血糖; TC: 总胆固醇; TG: 甘油三酯; HDL-C: 高密度脂蛋白胆固醇; LDL-C: 低密度脂蛋白胆固醇; WBC: 白细胞; PLT: 血小板; PLR: 血小板与淋巴细胞比值; NLR: 中性粒细胞与淋巴细胞比值; LVEF: 左心室射血分数。
与Ⅱ级组比较, * P < 0.05; 与Ⅲ级组比较, #P < 0.05。2.4 瓣膜性心脏病患者心功能分级的影响因素分析
将不同心功能分级患者差异有统计学意义的指标作为自变量,以心功能分级作为因变量(Ⅳ级=2, Ⅲ级=1, Ⅱ级=0), 进行多因素Logistic回归分析。结果显示,年龄、合并糖尿病、疾病分类、LVEF、HSP70、OPN、MMP-9是患者心功能分级的影响因素(P < 0.05)。见表 5。
表 5 影响瓣膜性心脏病患者心功能分级的多因素Logistic回归分析因素 赋值 β S. E. Wald OR 95%CI P 年龄 ≥60岁=1, < 60岁=0 0.715 0.273 10.028 2.146 1.315~4.453 < 0.001 合并糖尿病 是=1, 否=0 0.767 0.298 6.575 1.054 0.897~1.879 0.003 疾病分类 多瓣膜病变=1, 单瓣膜病变=0 0.612 0.334 11.122 2.998 2.001~5.564 < 0.001 LVEF 原值录入 0.683 0.312 9.809 1.879 1.043~3.342 < 0.001 HSP70 原值录入 0.728 0.298 14.533 3.342 2.235~8.876 < 0.001 OPN 原值录入 0.493 0.334 15.021 4.419 3.241~9.809 < 0.001 MMP-9 原值录入 0.546 0.276 10.892 2.376 1.436~4.498 < 0.001 2.5 血清HSP70、OPN、MMP-9与瓣膜性心脏病患者心功能指标LVEF的相关性
Pearson相关性分析显示,血清HSP70、OPN、MMP-9与瓣膜性心脏病患者心功能指标LVEF呈显著负相关(r=-0.611、-0.584、-0.624, P < 0.001)。
2.6 血清HSP70、OPN、MMP-9对瓣膜性心脏病心功能分级的诊断价值
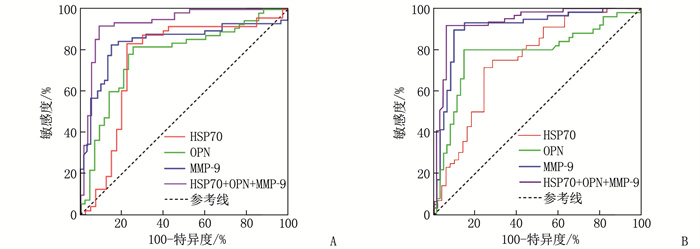
ROC曲线分析发现,血清HSP70、OPN、MMP-9联合诊断瓣膜性心脏病患者心功能分级的效能优于其单独诊断(P < 0.05)。见表 6、表 7和图 1。
表 6 血清HSP70、OPN、MMP-9诊断瓣膜性心脏病心功能分级Ⅲ级的效能指标 心功能分级Ⅲ级 AUC 95%CI 灵敏度/% 特异度/% 截断值 P HSP70 0.812 0.754~0.897 80.42 78.76 20.19 μg/L < 0.001 OPN 0.818 0.723~0.899 82.30 79.84 62.31 μg/L < 0.001 MMP-9 0.839 0.786~0.923 85.52 82.11 702.32 μg/L < 0.001 HSP70+OPN+MMP-9 0.931 0.881~0.981 90.99 85.64 — < 0.001 表 7 血清HSP70、OPN、MMP-9诊断瓣膜性心脏病心功能分级Ⅳ级的效能指标 心功能分级Ⅳ级 AUC 95%CI 灵敏度/% 特异度/% 截断值 P HSP70 0.845 0.746~0.887 86.56 83.42 25.64 μg/L < 0.001 OPN 0.824 0.786~0.889 84.30 80.21 80.43 μg/L < 0.001 MMP-9 0.912 0.823~0.965 89.97 84.34 811.12 μg/L < 0.001 HSP70+OPN+MMP-9 0.945 0.846~0.987 92.31 87.87 — < 0.001 3. 讨论
由于瓣膜狭窄或关闭不全,瓣膜性心脏病患者常发生心律失常和心源性猝死等不良事件。常规心脏超声能有效评估心功能,但无法明确具体的发病机制[8]。
HSP70具有稳定细胞内变性蛋白质、保护心肌细胞及恢复心功能的作用[9-10]。目前已被证实的HSP70生物学特性主要包括: ①分子伴侣作用; ②抗氧化及炎性损伤作用; ③协同免疫作用; ④抗细胞凋亡作用。一项报道[11]调查了七氟烷对在体外循环(CPB)下接受双瓣膜置换术(DVRS)的风湿性心脏病患者的心脏保护作用及其潜在机制,其结果显示,七氟烷可能通过上调HSP70的抗炎作用降低心脏损伤的生物标志物水平。因此,高表达的HSP70对心肌细胞具有保护作用。研究[12-13]发现,HSP70可能通过以下途径保护心肌细胞: ①与因缺血而损伤的蛋白结合后,修复并稳定其结构稳定性,阻止进一步的蛋白质损伤,从而保护心肌细胞; ②作用于缺血心肌中钙离子通道内环境,减轻心肌钙离子超载,提高心肌收缩力以保护心肌细胞; ③稳定线粒体以保障细胞能量代谢,抑制缺血再灌注损伤。本研究发现,随着瓣膜性心脏病患者心功能分级的增加,血清HSP70表达水平逐渐升高,提示在患者心肌损伤过程中伴有HSP70的保护作用,其具体机制可能涉及上述3条途径。
OPN广泛分布于骨细胞、血管内皮细胞、平滑细胞及多种肿瘤细胞中。在心血管系统中, OPN主要来源于内皮细胞、巨噬细胞,致炎因子、骨激素、细胞因子、肾素-血管紧张素系统均可影响其功能[14]。目前,已知OPN在血管与主动脉瓣钙化、新生内膜形成、血管炎症反应、心室重建纤维化过程等起重要作用[15]。有关OPN参与心肌损伤机制的研究[16]发现, OPN激活下游趋化因子,加剧心肌细胞纤维化,同时增加心肌细胞免疫性损伤,导致心室壁运动降低和心功能改变。研究[17-18]表明,OPN可诱导肿瘤坏死因子表达,加剧炎症反应,影响心肌细胞变性和纤维化。本研究发现,瓣膜性心脏病患者血清OPN表达水平高于健康人,尤其是在心功能分级Ⅳ级的患者中表达最高。上述提示,OPN可能参与瓣膜性心脏病心功能损伤,其可能通过激活下游趋化因子、增加心肌细胞免疫性损伤和加剧炎症反应来加重心功能损伤。
MMP家族作为常见的锌依赖性蛋白水解酶家族,已被证实其一方面可促进动脉壁粥样斑块不稳定和破裂,另一方面可重塑心脏基质,进而导致急性冠状动脉综合征、心力衰竭等疾病的发生[19]。MMP-9作为MMP家族成员,主要分布于心内膜、内膜下层、间质组织和心肌细胞中。当炎症反应发生后, MMP-9过度激活并大量释放,降解细胞外基质打乱心肌细胞正常分布,导致心肌细胞间隙被其他异常结构的结缔组织、纤维组织填充,诱发心室重构,从而导致心功能进一步恶化[20]。研究[21]显示, MMP-9在风湿性心脏瓣膜病患者血清中升高,且参与心室重构。本研究发现,瓣膜性心脏病患者血清中MMP-9呈高表达,与上述报道结果一致。进一步分析显示,随着瓣膜性心脏病患者心功能分级的增加, MMP-9表达水平逐渐升高,提示高表达的MMP-9可能参与了瓣膜性心脏病患者心功能进行性损伤的过程。分析原因为:在某些刺激因素的作用下, MMP-9释放量增加,导致心肌基质降解,进而引起心室重构并影响心功能。本研究经相关性分析发现,瓣膜性心脏病患者血清HSP70、OPN、MMP-9水平与心功能指标LVEF显著相关,且其是患者心功能分级的独立影响因素。HSP70保护心肌能力的减弱以及OPN、MMP-9促进心肌损伤,共同导致了瓣膜性心脏病患者心功能的恶化。此外,本研究发现,血清HSP70、OPN、MMP-9联合诊断瓣膜性心脏病患者心功能分级的效能优于其单独诊断。临床可通过早期监测患者血清HSP70、OPN、MMP-9表达水平来诊断心功能分级,以助于临床治疗方案的制订。
综上所述,瓣膜性心脏病患者的血清HSP70、OPN、MMP-9表达水平升高,并且随着心功能分级的增加而进一步上升。这些指标是瓣膜性心脏病患者心功能分级的影响因素,其或可作为辅助诊断心功能分级的参考依据。
-
表 1 2组研究对象血清HSP70、OPN、MMP-9表达水平比较(x±s)
μg/L 组别 n HSP70 OPN MMP-9 健康组 100 10.02±1.10 41.23±3.74 115.34±15.76 研究组 168 21.98±1.76* 65.45±6.19* 723.56±87.90* HSP70: 热休克蛋白70; OPN: 骨桥蛋白;
MMP-9: 基质金属蛋白酶-9。与健康组比较, * P < 0.05。表 2 不同瓣膜性心脏病疾病分类患者血清HSP70、OPN、MMP-9表达水平比较(x±s)
μg/L 疾病分类 n HSP70 OPN MMP-9 单瓣膜病变 115 17.56±1.34 52.42±5.12 695.46±100.84 多瓣膜病变 53 24.65±2.87* 70.98±7.88* 795.32±102.32* 与单瓣膜病变比较, * P < 0.05。 表 3 不同心功能分级瓣膜性心脏病患者血清HSP70、OPN、MMP-9表达水平比较(x±s)
μg/L 组别 n HSP70 OPN MMP-9 Ⅱ级组 68 15.46±1.12 49.80±5.46 611.21±65.75 Ⅲ级组 57 22.31±2.76* 69.95±7.82* 729.09±75.45* Ⅳ级组 43 29.98±3.42*# 86.56±11.23*# 856.64±102.13*# 与Ⅱ级组比较, * P < 0.05; 与Ⅲ级组比较, #P < 0.05; 表 4 不同心功能分级瓣膜性心脏病患者临床资料分析(x±s)[n(%)]
资料 分类 Ⅱ级组(n=68) Ⅲ级组(n=57) Ⅳ级组(n=43) 性别 男 34(50.00) 32(56.14) 23(53.49) 女 34(50.00) 25(43.86) 20(46.51) 年龄 ≥60岁 23(33.82) 35(61.40)* 37(86.05)*# < 60岁 45(66.18) 22(38.60)* 6(13.95)*# 吸烟史 是 15(22.06) 10(17.54) 8(18.60) 否 53(77.94) 47(82.46) 35(81.40) 饮酒史 是 13(19.12) 12(21.05) 9(20.93) 否 55(80.88) 45(78.95) 34(79.07) 合并基础疾病 高血压 12(17.65) 13(22.81) 11(25.58) 糖尿病 12(17.65) 19(33.33)* 23(53.49)*# 高脂血症 7(10.29) 5(8.77) 4(9.30) 心脏病家族史 有 6(8.82) 4(7.02) 1(2.33) 无 62(91.18) 53(92.98) 42(97.67) 疾病分类 单瓣膜病变 32(47.06) 43(75.44)* 40(93.02)*# 多瓣膜病变 36(52.94) 14(24.56)* 3(6.98)*# 实验室指标 FBG/(mmol/L) 6.48±0.45 6.62±0.40 6.56±0.42 TC/(mmol/L) 4.53±0.29 4.61±0.30 4.39±0.37 TG/(mmol/L) 1.54±0.21 1.52±0.20 1.56±0.22 HDL-C/(mmol/L) 1.21±0.12 1.19±0.13 1.23±0.14 LDL-C/(mmol/L) 3.04±0.23 3.06±0.22 3.12±0.21 WBC/(×109/L) 7.11±0.38 7.12±0.29 7.15±0.32 PLT/(×109/L) 192.12±20.23 193.42±21.31 192.87±20.43 PLR 88.12±9.43 88.43±9.54 88.25±8.79 NLR 2.13±0.15 2.18±0.14 2.21±0.15 LVEF/% 61.68±8.98 50.35±5.67* 41.87±4.29*# FBG: 空腹血糖; TC: 总胆固醇; TG: 甘油三酯; HDL-C: 高密度脂蛋白胆固醇; LDL-C: 低密度脂蛋白胆固醇; WBC: 白细胞; PLT: 血小板; PLR: 血小板与淋巴细胞比值; NLR: 中性粒细胞与淋巴细胞比值; LVEF: 左心室射血分数。
与Ⅱ级组比较, * P < 0.05; 与Ⅲ级组比较, #P < 0.05。表 5 影响瓣膜性心脏病患者心功能分级的多因素Logistic回归分析
因素 赋值 β S. E. Wald OR 95%CI P 年龄 ≥60岁=1, < 60岁=0 0.715 0.273 10.028 2.146 1.315~4.453 < 0.001 合并糖尿病 是=1, 否=0 0.767 0.298 6.575 1.054 0.897~1.879 0.003 疾病分类 多瓣膜病变=1, 单瓣膜病变=0 0.612 0.334 11.122 2.998 2.001~5.564 < 0.001 LVEF 原值录入 0.683 0.312 9.809 1.879 1.043~3.342 < 0.001 HSP70 原值录入 0.728 0.298 14.533 3.342 2.235~8.876 < 0.001 OPN 原值录入 0.493 0.334 15.021 4.419 3.241~9.809 < 0.001 MMP-9 原值录入 0.546 0.276 10.892 2.376 1.436~4.498 < 0.001 表 6 血清HSP70、OPN、MMP-9诊断瓣膜性心脏病心功能分级Ⅲ级的效能
指标 心功能分级Ⅲ级 AUC 95%CI 灵敏度/% 特异度/% 截断值 P HSP70 0.812 0.754~0.897 80.42 78.76 20.19 μg/L < 0.001 OPN 0.818 0.723~0.899 82.30 79.84 62.31 μg/L < 0.001 MMP-9 0.839 0.786~0.923 85.52 82.11 702.32 μg/L < 0.001 HSP70+OPN+MMP-9 0.931 0.881~0.981 90.99 85.64 — < 0.001 表 7 血清HSP70、OPN、MMP-9诊断瓣膜性心脏病心功能分级Ⅳ级的效能
指标 心功能分级Ⅳ级 AUC 95%CI 灵敏度/% 特异度/% 截断值 P HSP70 0.845 0.746~0.887 86.56 83.42 25.64 μg/L < 0.001 OPN 0.824 0.786~0.889 84.30 80.21 80.43 μg/L < 0.001 MMP-9 0.912 0.823~0.965 89.97 84.34 811.12 μg/L < 0.001 HSP70+OPN+MMP-9 0.945 0.846~0.987 92.31 87.87 — < 0.001 -
[1] AJMONE MARSAN N, DELGADO V, SHAH D J, et al. Valvular heart disease: shifting the focus to the myocardium[J]. Eur Heart J, 2023, 44(1): 28-40. doi: 10.1093/eurheartj/ehac504
[2] ELEID M F, NKOMO V T, PISLARU S V, et al. Valvular heart disease: new concepts in pathophysiology and therapeutic approaches[J]. Annu Rev Med, 2023, 74: 155-170.
[3] NIZNIK S, RAPOPORT M J, AVNERY O, et al. Heart valve disease in primary antiphospholipid syndrome[J]. Rheumatology (Oxford), 2024, 63(5): 1397-1402.
[4] ZHANG H C, SHAO S P, ZENG Y, et al. Reversible phase separation of HSF1 is required for an acute transcriptional response during heat shock[J]. Nat Cell Biol, 2022, 24(3): 340-352. doi: 10.1038/s41556-022-00846-7
[5] KUPRYTĒ M, LESAUSKAITĒ V, SIRATAVIGIŪTĒ V, et al. Expression of osteopontin and gremlin 1 proteins in cardiomyocytes in ischemic heart failure[J]. Int J Mol Sci, 2024, 25(15): 8240.
[6] WANG Y G, WANG D, WU C, et al. MMP 9-instructed assembly of bFGF nanofibers in ischemic myocardium to promote heart repair[J]. Theranostics, 2022, 12(17): 7237-7249. doi: 10.7150/thno.77345
[7] VAHANIAN A, BEYERSDORF F, PRAZ F, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease: Developed by the Task Force for the management of valvular heart disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS)[J]. Rev Esp Cardiol (Engl Ed), 2022, 75(6): 524.
[8] KISLING A, GALLAGHER R. Valvular heart disease[J]. Prim Care Clin Off Pract, 2024, 51(1): 95-109.
[9] TAN Y, GAO B, GU D M, et al. Efficacy of adenovirus-mediated, miR-199a nanoparticles on expression of HSP27, HSP70, and soluble glycoprotein in rats with heart failure[J]. Altern Ther Health Med, 2023, 29(3): 146-152.
[10] THOMPSON A D, WAGNER M J, RODRIGUEZ J, et al. An unbiased screen identified the Hsp70-BAG3 complex as a regulator of myosin-binding protein C3[J]. JACC Basic Transl Sci, 2023, 8(9): 1198-1211.
[11] SHAN Y, XIE K, ZHOU Q F, et al. Sevoflurane alleviates myocardial ischemia/reperfusion injury via actitation of heat shock protein-70 in patients undergoing double valve replacement surgery[J]. Am J Transl Res, 2022, 14(8): 5529-5540.
[12] LIU T Y, JUAN Z D, XIA B, et al. HSP70 protects H9C2 cells from hypoxia and reoxygenation injury through STIM1/IP3R[J]. Cell Stress Chaperones, 2022, 27(5): 535-544.
[13] LIN K H, ALI A, KUO C H, et al. Carboxyl terminus of HSP70-interacting protein attenuates advanced glycation end products-induced cardiac injuries by promoting NFκB proteasomal degradation[J]. J Cell Physiol, 2022, 237(3): 1888-1901.
[14] 王俊华, 崔勤涛, 韩培立, 等. 退行性心脏瓣膜病患者血清LP(a)、OPN、IRF-4表达及其临床意义[J]. 分子诊断与治疗杂志, 2020, 12(4): 483-486, 506. [15] 张航, 许华山, 刘超. Lp(a)、OPN、NLR与冠心病患者并发狭窄性瓣膜病相关性[J]. 分子诊断与治疗杂志, 2021, 13(9): 1427-1430. [16] SHIRAKAWA K, SANO M. Osteopontin in cardiovascular diseases[J]. Biomolecules, 2021, 11(7): 1047.
[17] MASENGA S K, ROMANELLI A, KOOIJ K W. Plasma osteopontin in persons with HIV and the risk for cardiovascular disease[J]. AIDS, 2023, 37(2): 355-357.
[18] CHEONG K I, LEU H B, WU C C, et al. The clinical significance of osteopontin on the cardiovascular outcomes in patients with stable coronary artery disease[J]. J Formos Med Assoc, 2023, 122(4): 328-337.
[19] GUIZANI I, ZIDI W, ZAYANI Y, et al. Matrix metalloproteinase 3 and 9 as genetic biomarkers for the occurrence of cardiovascular complications in coronary artery disease: a prospective cohort study[J]. Mol Biol Rep, 2022, 49(10): 9171-9179.
[20] NATH D, SHIVASEKAR M, VINODHINI V M. Smoking induces the circulating levels of matrix metalloproteinase-9 and its association with cardiovascular risk in young smokers[J]. Medeni Med J, 2022, 37(4): 306-312.
[21] 朱开蒙, 宋兵, 梁富祥, 等. 血浆内酯素、基质金属蛋白酶-9水平与风湿性心脏瓣膜病患者心肌重构的关系[J]. 中国循证心血管医学杂志, 2019, 11(7): 811-813, 817.




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
