Actions and mechanism of argon-helium cryotherapy in inflammatory response in rats with lower extremity atherosclerotic occlusive disease
-
摘要:目的
探讨氩氦冷冻调控酪氨酸蛋白激酶2/信号传导和转录激活因子3(JAK2/STAT3)通路,进而抑制下肢动脉硬化闭塞症(ASO)大鼠炎症反应的作用机制。
方法将40只大鼠随机分为sham组、下肢ASO组、Ar-He Cryo组和Ar-He Cryo+p-JAK组,每组10只。检测各组下肢动脉平均血流速度、血脂指标、炎症水平。采用苏木精-伊红(HE)染色检测动脉血管组织病理学变化。采用蛋白质印迹检测动脉血管组织中JAK2、p-JAK2、STAT3、p-STAT3、细胞因子信号转导抑制蛋白3(SOCS3)蛋白的表达水平。
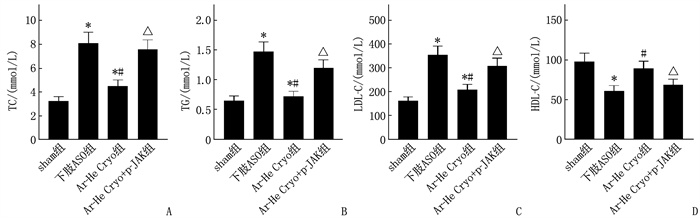
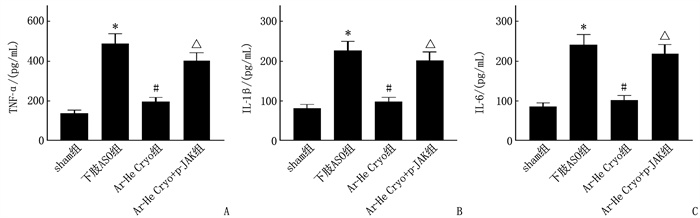
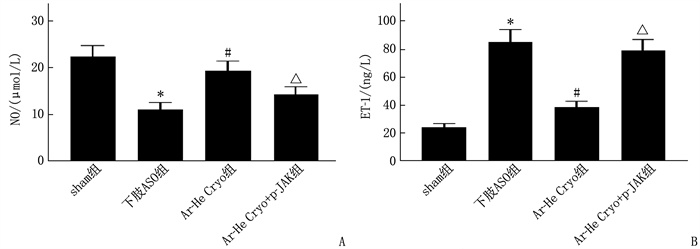
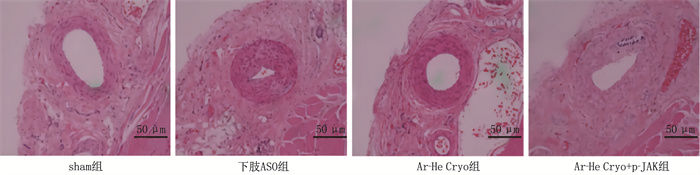
结果下肢ASO组大鼠下肢动脉平均血流速度低于sham组,差异有统计学意义(P < 0.05)。Ar-He Cryo组大鼠下肢动脉平均血流速度高于AOS组,差异有统计学意义(P < 0.05)。Ar-He Cryo+p-JAK组大鼠下肢动脉平均血流速度低于Ar-He Cryo组,差异有统计学意义(P < 0.05)。下肢ASO组大鼠血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)水平以及肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)水平和内皮素-1(ET-1)含量高于sham组,血清高密度脂蛋白胆固醇(HDL-C)水平、一氧化氮(NO)含量低于sham组,差异有统计学意义(P < 0.05)。Ar-He Cryo组血清TC、TG、LDL-C水平以及TNF-α、IL-1β、IL-6水平和ET-1含量低于下肢ASO组,血清HDL-C水平、NO含量高于下肢ASO组,差异有统计学意义(P < 0.05)。Ar-He Cryo+p-JAK组血清TC、TG、LDL-C水平以及血清TNF-α、IL-1β、IL-6水平和ET-1含量高于Ar-He Cryo组, HDL-C水平和NO含量低于Ar-He Cryo组,差异有统计学意义(P < 0.05)。下肢ASO组大鼠下肢静脉血管较sham组明显狭窄; 与下肢ASO组相比, Ar-He Cryo组大鼠下肢静脉血管狭窄程度明显减轻; Ar-He Cryo+p-JAK组大鼠下肢静脉血管狭窄程度与下肢ASO组相似,较Ar-He Cryo组明显狭窄。下肢ASO组动脉血管组织中p-JAK2/JAK2、p-STAT3/STAT3高于sham组, SOCS3蛋白表达低于sham组,差异有统计学意义(P < 0.05)。Ar-He Cryo组动脉血管组织中p-JAK2/JAK2、p-STAT3/STAT3低于下肢ASO组, SOCS3蛋白表达高于下肢ASO组,差异有统计学意义(P < 0.05)。Ar-He Cryo+p-JAK组动脉血管组织中p-JAK2/JAK2、p-STAT3/STAT3高于Ar-He Cryo组, SOCS3蛋白表达低于Ar-He Cryo组,差异有统计学意义(P < 0.05)。
结论氩氦冷冻可减少下肢ASO大鼠动脉血管中脂质沉积,抑制炎症反应,其作用机制可能与抑制JAK2/STAT3信号通路激活有关。
Abstract:ObjectiveTo investigate the mechanism of argon-helium cryotherapy in regulating the tyrosine-protein kinase 2/signal transducer and activator of transcription 3 (JAK2/STAT3) pathway, thereby inhibiting the inflammatory response in rats with atherosclerotic occlusive disease (ASO) of the lower extremities.
MethodsForty rats were randomly divided into sham group, lower extremity ASO group, Ar-He Cryo group and Ar-He Cryo+p-JAK group, with 10 rats in each group. The average blood flow velocity of the lower extremity artery, lipid profile and inflammation levels were measured in each group. Hematoxylin-eosin (HE) staining was used to examine histopathological changes in arterial vessel tissues. Western blotting was performed to detect the expression levels of JAK2, p-JAK2, STAT3, p-STAT3 and suppressor of cytokine signaling 3 (SOCS3) proteins in arterial vessel tissues.
ResultsThe average blood flow velocity of the lower extremity artery in the lower extremity ASO group was significantly lower than that in the sham group (P < 0.05). The average blood flow velocity in the Ar-He Cryo group was significantly higher than that in the ASO group (P < 0.05). The average blood flow velocity in the Ar-He Cryo+p-JAK group was significantly lower than that in the Ar-He Cryo group (P < 0.05). Serum total cholesterol (TC), triglyceride (TG), low-density lipoprotein cholesterol (LDL-C) levels, tumor necrosis factor-alpha (TNF-α), interleukin-1β (IL-1β), interleukin-6 (IL-6) levels and endothelin-1 (ET-1) content in the lower extremity ASO group were significantly higher than those in the sham group, while serum high-density lipoprotein cholesterol (HDL-C) levels and nitric oxide (NO) content were significantly lower than those in the sham group (P < 0.05). In the Ar-He Cryo group, serum TC, TG, LDL-C levels as well as TNF-α, IL-1β, IL-6 levels and ET-1 content were significantly lower than those in the lower extremity ASO group, while serum HDL-C levels and NO content were significantly higher (P < 0.05). In the Ar-He Cryo+p-JAK group, serum TC, TG, LDL-C levels as well as TNF-α, IL-1β, IL-6 levels and ET-1 content were significantly higher than those in the Ar-He Cryo group, while HDL-C levels and NO content were significantly lower (P < 0.05). Compared with the sham group, the lower extremity venous vessels in the lower extremity ASO group showed significant stenosis; compared with the lower extremity ASO group, the degree of stenosis in the lower extremity venous vessels was significantly reduced in the Ar-He Cryo group; the degree of stenosis in the lower extremity venous vessels in the Ar-He Cryo+p-JAK group was similar to that in the lower extremity ASO group and significantly more severe than that in the Ar-He Cryo group. The ratios of p-JAK2/JAK2 and p-STAT3/STAT3 in arterial vessel tissues of the lower extremity ASO group were significantly higher than those in the sham group, and SOCS3 protein expression was significantly lower than that in the sham group (P < 0.05). In the Ar-He Cryo group, p-JAK2/JAK2 and p-STAT3/STAT3 in arterial vessel tissues were significantly lower than those in the lower extremity ASO group, and SOCS3 protein expression was significantly higher than that in the lower extremity ASO group (P < 0.05). In the Ar-He Cryo+p-JAK group, p-JAK2/JAK2 and p-STAT3/STAT3 in arterial vessel tissues were significantly higher than those in the Ar-He Cryo group, and SOCS3 protein expression was significantly lower than that in the Ar-He Cryo group (P < 0.05).
ConclusionArgon-helium cryotherapy can reduce lipid deposition in the arteries of rats with lower extremity ASO, inhibit inflammatory responses, and its mechanism may be related to the inhibition of activation of JAK2/STAT3 signaling pathway.
-
下肢动脉硬化闭塞症(ASO)是一种慢性动脉闭塞性疾病,以下肢动脉粥样硬化为主要病理改变,可导致动脉逐渐狭窄、闭塞,从而引起间歇性跛行、侧肢疼痛,严重者甚至可发生溃疡、坏死等[1]。ASO发病率为3%~10%, 75岁以上患者ASO发病率达15%~20%, 严重威胁患者健康[2]。ASO的发病机制复杂,多数学者认为其与脂质代谢紊乱及炎症反应相关。这些因素可加速动脉硬化的进程,并加剧管腔狭窄,是ASO的重要病理特征。因此,探究有效的抗炎和降脂方法可能是治疗ASO的关键[3]。酪氨酸蛋白激酶2/信号传导和转录激活因子3(JAK2/STAT3)是典型的炎性通路之一,可参与抗炎反应及免疫调节等病理过程,并在ASO的发生与发展中发挥重要作用[4]。研究[5]发现,激活JAK2/STST3信号通路可促进主动脉内皮细胞中炎症因子的释放,对动脉斑块的形成发挥促进作用。氩氦冷冻治疗技术是一种低温冷冻技术,目前可应用于全身实体肿瘤的治疗。研究[6]发现,氦气冷冻可将氦气精准穿刺到肿瘤组织中,氩气在刀尖迅速冷冻至-170~-140 ℃。氦气在刀尖极速膨胀,加热处于超低温状态的病变组织,通过冷热逆转疗法摧毁肿瘤组织,但其对ASO的作用尚未明确。因此,本研究探讨氩氦冷冻是否能够通过调控JAK2/STAT3信号通路来抑制下肢ASO大鼠的炎症反应,现报告如下。
1. 材料与方法
1.1 实验动物
雄性SD大鼠均购自中国农业科学院兰州兽医研究所,共计40只,动物许可证号: SYXK(甘)2020-0010。大鼠均为SPF级,体质量220~240 g, 统一饲养于本院屏障动物房内,温度20~24 ℃, 相对湿度50%~60 %, 光照12 h与黑暗12 h循环交替,自由饮水,固定饮食,让大鼠在新环境适应7 d。本研究已通过医院伦理委员会审批(批件号: 20230009)。
1.2 试剂
酶联免疫吸附试验(ELISA)试剂盒(北京索莱宝科技有限公司); JAK2、p-JAK2、STAT3、p-STAT3抗体、细胞因子信号转导抑制蛋白3(SOCS3)抗体(武汉基因美生物公司); JAK2/STAT3信号通路激活剂p-JAK2多肽(深圳欣博盛生物科技有限公司); 羊抗兔二抗、兔源GAPDH一抗(美国Abcam公司); 二喹啉甲酸(BCA)蛋白定量检测试剂盒、苏木素-伊红(HE)染色试剂盒(生工生物工程股份有限公司)。
1.3 分组和模型制备
按照随机数字表法将40只大鼠分为sham组、下肢ASO组、Ar-He Cryo组和Ar-He Cryo+p-JAK组,每组10只。参照参考文献[7]制备大鼠下肢ASO模型: 除sham组外,其余各组大鼠均喂养高脂饮食, 1周后给予大鼠2%戊巴比妥钠麻醉,将左后肢皮肤消毒,并于腹股沟中线向右后肢内侧,用手术刀纵行切开,将隐动脉钝性(股动脉至膝部腘动脉分叉处)分离,并将其近端和远端夹闭,在隐动脉的血管中缓慢注入0.25 mL蒸馏水,当观察到血管充盈时最佳。5 min后将动脉夹取下并止血,逐层缝合皮肤,继续高脂饮食饲养1周。sham组大鼠仅分离隐动脉不结扎,并用普通饲料喂养1周。当肢体出现缺血性改变、坏死时,视为建模成功。1周后使用3%戊巴比妥钠,腹腔注射麻醉各组大鼠, Ar-He Cryo组在隐动脉处刺入2 mm的氩氦冷冻探针,启动氩气冷冻3 min, 当冰球完全将隐动脉覆盖时,可见其表面有冰霜覆盖,此时中央温度可达-140 ℃, 后将氦气启动,复温隐动脉至10 ℃(30 d), 此过程为1个冷冻循环,该组共干预2个冷冻循环; 干预结束后将氩氦冷冻探针拔除并注意保暖,术后正常喂养; Ar-He Cryo+p-JAK组在Ar-He Cryo的基础上,经腹部皮下一次性注射4 mg/kg的AG490; sham组、下肢ASO组不给予任何干预。
1.4 检测下肢动脉平均血流速度
各组干预结束1周后,麻醉大鼠,使用激光散斑血流成像系统检测大鼠右后下肢动脉血流情况。
1.5 血清指标检测
大鼠麻醉后,取眼眶血,离心收集血清,按照试剂盒说明书检测血清中甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)及高密度脂蛋白胆固醇(HDL-C)水平。使用ELISA试剂盒并按照说明书,检测血清中炎症因子肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)水平以及血清中一氧化氮(NO)、内皮素-1(ET-1)水平。
1.6 HE染色
采用脱颈法处死各组大鼠,取出手术侧下肢动脉血管。将部分血管组织固定于4%多聚甲醛溶液中,其余组织冻存于-80 ℃冰箱中。24 h后用石蜡包埋,用切片机将组织切割成厚度为5 μm的薄片,将组织片附着在载玻片上。脱蜡处理以去除石蜡,并进行水化步骤;采用HE染色法对切片进行染色,于显微镜下观察。
1.7 蛋白质印迹检测动脉血管组织中JAK2、p-JAK2、STAT3、p-STAT3、SOCS3蛋白表达
取动脉血管组织并加入100 μL预先配置好的裂解液混合物,于组织匀浆器中混匀,在4 ℃环境下,离心机以15 000 r/min速度离心,离心15 min, 收集上清液于EP管中,采用BCA法测定总蛋白浓度。在沸水中煮沸组织使其变形,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白并转移到聚偏氟乙烯(PVDF)膜上,加入5%脱脂牛奶封闭1 h; 加入TBST溶液清洗后,按照1∶ 500比例加入一抗,在4 ℃环境中过夜孵育; 随后,按照1∶ 1 000比例加入HRP标记的二抗抗体,常规孵育2 h。然后,在样本中滴加ECL发光液,并进行显影。最后,使用相机拍摄图像,并利用Image Lab软件分析蛋白条带灰度值。
1.8 统计学分析
采用GraphPad Priam 8.0软件分析数据。符合正态分布的计量资料以(x±s)表示,组间比较采用单因素方差分析,两两比较使用LSD-t检验。P < 0.05为差异有统计学意义。
2. 结果
2.1 各组大鼠下肢动脉平均血流速度比较
与sham组[(254.68±30.45) mm/s]比较,下肢ASO组大鼠下肢动脉平均血流速度[(37.46±4.08) mm/s]降低,差异有统计学意义(P < 0.05); 与AOS组比较, Ar-He Cryo组大鼠下肢动脉平均血流速度[(205.19±21.62) mm/s]增加,差异有统计学意义(P < 0.05); Ar-He Cryo+p-JAK组大鼠下肢动脉平均血流速度[(62.51±7.46) mm/s] 低于Ar-He Cryo组,差异有统计学意义(P < 0.05)。
2.2 各组大鼠血清血脂指标比较
下肢ASO组大鼠血清TC、TG、LDL-C水平均高于sham组, HDL-C水平低于sham组,差异有统计学意义(P < 0.05); Ar-He Cryo组血清TC、TG、LDL-C水平均低于下肢ASO组, HDL-C水平高于下肢ASO组,差异有统计学意义(P < 0.05); Ar-He Cryo+p-JAK组血清TC、TG、LDL-C水平高于Ar-He Cryo组, HDL-C水平低于Ar-He Cryo组,差异有统计学意义(P < 0.05)。见图 1。
2.3 各组大鼠血清炎症因子水平比较
下肢ASO组血清TNF-α、IL-1β、IL-6水平高于sham组,差异有统计学意义(P < 0.05); Ar-He Cryo组血清TNF-α、IL-1β、IL-6水平低于下肢ASO组,差异有统计学意义(P < 0.05); Ar-He Cryo+p-JAK组血清TNF-α、IL-1β、IL-6水平高于Ar-He Cryo组,差异有统计学意义(P < 0.05)。见图 2。
2.4 各组大鼠血清NO、ET-1水平比较
下肢ASO组血清NO含量低于sham组,ET-1含量高于sham组,差异有统计学意义(P < 0.05); Ar-He Cryo组血清NO含量高于下肢ASO组, ET-1含量低于下肢ASO组,差异有统计学意义(P < 0.05); Ar-He Cryo+p-JAK组血清NO含量低于Ar-He Cryo组, ET-1含量高于Ar-He Cryo组,差异有统计学意义(P < 0.05)。见图 3。
2.5 各组大鼠下肢动脉血管病理学变化比较
sham组大鼠下肢静脉血管未见明显病理学变化; 下肢ASO组大鼠下肢静脉血管较sham组明显狭窄; 与下肢ASO组相比, Ar-He Cryo组大鼠下肢静脉血管狭窄程度明显减轻; Ar-He Cryo+p-JAK组大鼠下肢静脉血管狭窄程度与下肢ASO组相似,较Ar-He Cryo组明显狭窄。见图 4。
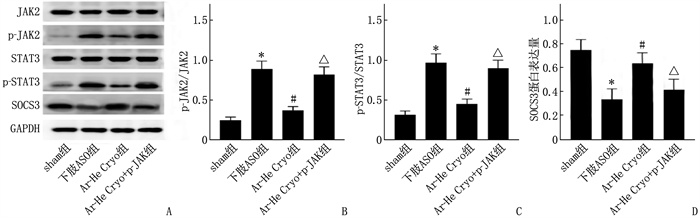
2.6 各组大鼠动脉血管组织中JAK2、p-JAK2、STAT3、p-STAT3、SOCS3蛋白表达比较
下肢ASO组动脉血管组织中p-JAK2/JAK2、p-STAT3/STAT3高于sham组, SOCS3蛋白表达低于sham组,差异有统计学意义(P < 0.05); Ar-He Cryo组动脉血管组织中p-JAK2/JAK2、p-STAT3/STAT3低于下肢ASO组, SOCS3蛋白表达高于下肢ASO组,差异有统计学意义(P < 0.05); Ar-He Cryo+p-JAK组动脉血管组织中p-JAK2/JAK2、p-STAT3/STAT3高于Ar-He Cryo组, SOCS3蛋白表达低于Ar-He Cryo组,差异有统计学意义(P < 0.05)。见图 5。
3. 讨论
近年来,随着社会的快速发展,人们的饮食结构发生变化, ASO的发病率逐年上升,严重威胁着公众的生活质量和健康[8]。目前,动脉硬化闭塞症的临床治疗主要包括外科手术和抗血管内膜增生药物,但这些方法疗效有限且费用较高。因此,探索更为有效的治疗方法具有重要意义[9]。本研究结果显示,下肢ASO组大鼠下肢动脉平均血流速度显著降低,血清TC、TG、LDL-C水平显著增高, HDL-C水平显著降低,提示下肢ASO大鼠模型制备成功。
近年来,由于疗效显著、创伤小以及能激发机体免疫反应等特点,氩氦靶向治疗技术已被广泛应用于实体肿瘤的治疗,并取得了显著效果。研究[10]发现,氩氦刀冷冻消融治疗前列腺癌疗效确切,能够缓解尿路症状并改善患者生活质量。研究[11]证实,氩氦刀冷冻消融技术在治疗骨转移瘤方面,具有创伤小、疗效显著及并发症少的特点。因此,本研究采用氩氦冷冻技术干预下肢ASO大鼠,该技术是通过将氩氦气体注入大鼠血管中,使其达到极低温度,从而破坏血管内膜和平滑肌细胞,促进血管壁塌陷和血栓形成,最终达到恢复动脉通畅的目的。本研究结果显示, Ar-He Cryo组大鼠下肢动脉平均血流速度和HDL-C水平显著增加,血清TC、TG、LDL-C水平显著降低。研究[12]表明,氧化型低密度脂蛋白(ox-LDL)在动脉内膜下沉积,通过与巨噬细胞和血管平滑肌细胞表面受体结合,导致细胞内脂质堆积,随后释放大量炎性因子如IL-6、TNF-α等,促使平滑肌细胞异常增殖和迁移,最终加剧ASO的症状。此外,巨噬细胞内ox-LDL的大量堆积,可通过释放大量ET-1加速疾病进程[13]。本研究结果显示, Ar-He Cryo组大鼠血清TNF-α、IL-1β、IL-6水平及ET-1含量显著降低,提示氩氦冷冻可通过减少动脉血管中脂质沉积和炎症反应以减缓ASO进展。
JAK2/STAT3信号通路可调节炎症和免疫等多种病理学变化,在ASO进程中发挥重要作用[14]。研究[15]发现, JAK2是激活STAT3的主要上游因子,可特异性调控STAT3, 当STAT3被JAK2激活时,可通过促平滑肌细胞增殖导致ASO的发生。研究[16]发现,抑制IL-6/JAK2/STAT3信号通路的激活,可有效改善动脉粥样硬化大鼠病理变化。研究[17]证实,抑制血管平滑肌细胞中JAK2/STAT3通路激活,可通过抑制平滑肌细胞异常增殖,改善ASO症状。SOCS3可通过促进JAK2的降解并抑制STAT3的表达,从而阻断JAK2/STAT3信号通路的激活[18]。本研究结果显示, Ar-He Cryo组动脉血管组织中p-JAK2/JAK2、p-STAT3/STAT3显著低于下肢ASO组,SOCS3蛋白表达显著高于下肢ASO组。上述提示,氩氦冷冻可能通过抑制JAK2/STAT3信号通路激活,减少动脉血管中脂质沉积,抑制炎症反应,进而减缓ASO的发展进程。
综上所述,氩氦冷冻可减少下肢ASO大鼠动脉血管中的脂质沉积,并抑制炎症反应,其作用机制可能与抑制JAK2/STAT3信号通路激活有关。
-
-
[1] YUAN Y Y, CAO W D, ZHANG X H, et al. Application of E-coach chronic disease management model in rehabilitation management of patients with arteriosclerosis obliterans[J]. J Health Popul Nutr, 2023, 42(1): 115.
[2] XU T, ZHENG C W, WU Y K, et al. miR-34a ameliorates arterial blood flow in rats with lower limb arteriosclerosis obliterans via Sirt1 signaling pathway[J]. Cell Mol Biol (Noisy-le-grand), 2024, 70(3): 248-253. doi: 10.14715/cmb/2024.70.3.37
[3] TIAN S Y. Systemic immune-inflammation index predicts restenosis after interventions for lower extremity arteriosclerosis obliterans[J]. Heart Surg Forum, 2023, 26(3): E225-E233. doi: 10.1532/hsf.5303
[4] SHAN Y, WANG L, SUN J Y, et al. Exercise preconditioning attenuates cerebral ischemia-induced neuronal apoptosis, Th17/Treg imbalance, and inflammation in rats by inhibiting the JAK2/STAT3 pathway[J]. Brain Behav, 2023, 13(6): e3030. doi: 10.1002/brb3.3030
[5] ZHU D, JIA C L, CAI T K, et al. Ruan Jian Qing Mai recipe inhibits the inflammatory response in acute lower limb ischemic mice through the JAK2/STAT3 pathway[J]. Evid Based Complement Alternat Med, 2022, 2022: 2481022.
[6] 李思玉, 彭进勇, 李艳艳. CT引导下氩氦刀冷冻消融术治疗犬骨肉瘤病例报告[J]. 吉林畜牧兽医, 2023, 44(8): 161-162. [7] YANG S Z, HUANG G S, LIANG X S, et al. Curcumol reduces lower limb arteriosclerosis in rats by inhibiting human arterial smooth muscle cell activity[J]. Clin Exp Pharmacol Physiol, 2024, 51(6): e13867.
[8] ZHAO H, ZHUO T L, HAO X X, et al. Effect of diabetes on the prognosis, serum inflammatory factors, and quality of life of patients with lower extremity arteriosclerosis obliterans after vascular intervention: a retrospective comparative cohort study[J]. Ann Palliat Med, 2022, 11(8): 2720-2729.
[9] CHEN J Q, ZHANG X H, WU W J, et al. Effect of hydration therapy and nursing intervention on preventing contrast-induced nephropathy after interventional treatment of lower extremity arteriosclerosis obliterans[J]. Technol Health Care, 2024, 32(3): 1361-1369. doi: 10.3233/THC-230256
[10] 尧义, 郭善明. 氩氦刀冷冻消融术治疗局限性前列腺癌的疗效分析[J]. 国际泌尿系统杂志, 2024, 44(1): 24-27. [11] 李小青, 吴德南, 谢燕平, 等. CT引导下氩氦刀冷冻治疗骨转移瘤的临床疗效[J]. 中国现代医生, 2022, 60(14): 69-73. [12] YE M, QIAN X, GUO X J, et al. Neutrophil-lymphocyte ratio and platelet-lymphocyte ratio predict severity and prognosis of lower limb arteriosclerosis obliterans[J]. Ann Vasc Surg, 2020, 64: 221-227. doi: 10.1016/j.avsg.2019.09.005
[13] LIAN W S, NIE H P, YUAN Y F, et al. Clinical significance of endothelin-1 and C reaction protein in restenosis after the intervention of lower extremity arteriosclerosis obliterans[J]. J Invest Surg, 2021, 34(7): 765-770.
[14] 陈杨, 喻霞, 赵紫玄, 等. 高良姜素通过抑制JAK2-STAT3磷酸化减轻小鼠内皮炎症改善动脉粥样硬化[J]. 中南药学, 2023, 21(6): 1472-1479. [15] 廖强. 五脏温阳化瘀汤对动脉粥样硬化大鼠JAK2/STAT3信号转导及IL-6/STAT3信号通路影响[J]. 四川中医, 2019, 37(10): 40-43. [16] 阮春黄, 梁硕, 孟毅, 等. 活血清热解毒方通过JAK/STAT信号传导通路调控动脉粥样硬化的分子机制探讨[J]. 中国中医急症, 2023, 32(10): 1728-1732. [17] 王继雪, 杨稀瑞, 吕勃川, 等. 四妙勇安汤通过JAK/STAT信号通路治疗下肢动脉硬化闭塞症的机制研究[J]. 海南医学院学报, 2021, 27(5): 373-381. [18] YUAN F F, PENG W, YANG Y Y, et al. Endothelial progenitor cell-derived exosomes promote anti-inflammatory macrophages via SOCS3/JAK2/STAT3 axis and improve the outcome of spinal cord injury[J]. J Neuroinflammation, 2023, 20(1): 156.




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号