Influencing factors and construction of a prediction model for poor prognosis in patients with acute myocardial infarction complicated by heart failure
-
摘要:目的
探讨急性心肌梗死(AMI)合并心力衰竭(HF)患者预后不良的影响因素,构建列线图预测模型并验证其性能。
方法选取252例AMI合并HF患者作为训练集,根据1年随访结果分为预后不良组60例和预后良好组192例; 另选取与训练集例数比例约为1∶3的86例AMI合并HF患者作为验证集。采用Cox回归模型分析预后不良的影响因素,基于筛选结果构建列线图模型,并对模型进行内部验证和外部验证[采用Hosmer-Lemeshoe检验评估拟合优度,绘制校正曲线评估校准度,绘制受试者工作特征(ROC)曲线分析区分度,通过决策曲线分析(DCA)评估临床实用性]。
结果训练集与验证集患者的临床资料比较,差异无统计学意义(P>0.05)。预后不良组的血肌酐、心肌肌钙蛋白T(cTnT)水平及年龄≥60岁者占比、发病至入院时间≥4 h者占比、心功能分级Ⅲ~Ⅳ级者占比高于预后良好组,左心室射血分数(LVEF)低于预后良好组,差异有统计学意义(P < 0.05)。多因素Cox回归分析结果显示,发病至入院时间、心功能分级、血肌酐、cTnT、LVEF是AMI合并HF患者预后不良的独立影响因素(P < 0.05), 据此构建列线图模型。内部验证结果显示,该模型拟合优度良好(χ2=13.966, P=0.083), 校准度优良, 区分度良好[曲线下面积(AUC)为0.831]; 外部验证结果显示,该模型拟合优度良好(χ2=6.465, P=0.136), 校准度优良,区分度良好(AUC为0.884)。DCA结果显示,列线图模型在高风险阈值范围为0.02~0.98时具有良好的临床净获益。
结论AMI合并HF患者预后不良的影响因素包括发病至入院时间、心功能分级、血肌酐、cTnT、LVEF,据此构建的列线图预测模型对患者预后不良具有较高的预测价值。
Abstract:ObjectiveTo explore the influencing factors for poor prognosis in patients with acute myocardial infarction (AMI) complicated by heart failure (HF), construct a nomogram prediction model, and validate its performance.
MethodsA total of 252 patients with AMI complicated by HF were selected as training set and divided into poor prognosis group (60 patients) and good prognosis group (192 patients) based on 1-year follow-up results. Additionally, 86 patients with AMI complicated by HF, with a ratio approximately 1∶3 to the training set, were selected as validation set. Cox regression models were used to analyze the influencing factors for poor prognosis. A nomogram model was constructed based on the screening results and underwent internal and external validation[Hosmer-Lemeshow test was used to assess goodness of fit, calibration curves were plotted to evaluate calibration, receiver operating characteristic (ROC) curves were drawn to analyze discriminative ability, and decision curve analysis (DCA) was conducted to assess clinical utility].
ResultsThere were no statistically significant differences in clinical data between the training set and validation set (P>0.05). The poor prognosis group had higher levels of serum creatinine and cardiac troponin T (cTnT), higher proportions of patients aged ≥60 years, with time from onset to admission ≥4 hours, with heart function grades Ⅲ to Ⅳ, and a lower left ventricular ejection fraction (LVEF) compared with the good prognosis group (P < 0.05). Multivariate Cox regression analysis showed that time from onset to admission, heart function grade, serum creatinine, cTnT, and LVEF were independent influencing factors for poor prognosis in patients with AMI complicated by HF (P < 0.05). Based on these results, a nomogram model was constructed. Internal validation results showed that the model had good goodness of fit (χ2=13.966, P=0.083), excellent calibration, and good discriminative ability[area under the curve (AUC) was 0.831]. External validation results also showed that the model had good goodness of fit (χ2=6.465, P=0.136), excellent calibration, and good discriminative ability (AUC was 0.884). DCA results indicated that the nomogram model had good clinical net benefit within a high-risk threshold range of 0.02 to 0.98.
ConclusionInfluencing factors for poor prognosis in patients with AMI complicated by HF include time from onset to admission, heart function grade, serum creatinine, cTnT, and LVEF.The constructed nomogram model has high predictive value for poor prognosis in these patients.
-
急性心肌梗死(AMI)是冠心病的一种严重类型, 也是心力衰竭(HF)进展的主要诱因。研究[1-2]表明,约25%的ST段抬高型AMI幸存患者病情会进展为HF。合并HF可显著增加AMI患者的不良预后风险,导致生存率显著下降[3]。因此, 临床需进一步重视AMI合并HF患者不良预后的预测与防范,并探索可筛选高危患者的危险因素或预测模型。既往研究[4-5]已构建多种风险评分系统用于预测AMI患者的预后,并在临床中广泛应用。然而,这些评分系统主要适用于近期预后(如院内病死率)评估,在远期生存预测方面存在局限性[6]。本研究基于AMI合并HF患者预后不良的影响因素构建列线图预测模型, 旨在为优化临床防治策略提供参考依据。
1. 对象与方法
1.1 研究对象
前瞻性选取2021年1月—2023年6月海南医科大学附属第一医院收治的252例AMI合并HF患者作为训练集,根据1年随访结果分为预后不良组60例和预后良好组192例。另选取与训练集例数比例约为1∶3的86例AMI合并HF患者作为验证集,验证集中20例患者发生预后不良。纳入标准: ①符合AMI[7]和HF[8]的诊断标准, 首次发病,并经影像学、实验室和临床检查确诊者; ②完成1年随访者; ③发病12 h内入院治疗者; ④对研究知情同意并签署知情同意书者。排除标准: ①合并心肌炎者; ②存在冠脉造影检查禁忌证者; ③依从性低,无法完成相关检查者; ④合并自身免疫性疾病者; ⑤合并恶性肿瘤者。本研究经医院伦理委员会审查批准(批号: 20200128)。
1.2 方法
1.2.1 资料收集
收集患者的年龄、性别、合并症(糖尿病、高血压、外周血管疾病、肺炎)、血运重建情况、病变血管数量、疾病类型、吸烟史、饮酒史、受教育程度、发病至入院时间、心功能分级、四肢功能状态、体质量指数(BMI)、左心室射血分数(LVEF)和低密度脂蛋白胆固醇(LDL-C)、心肌肌钙蛋白T(cTnT)、高密度脂蛋白胆固醇(HDL-C)、甘油三酯(TG)、总胆固醇(TC)、血肌酐、白细胞、C反应蛋白(CRP)、肌酸激酶同工酶(CK-MB)水平等资料。
1.2.2 预后随访
患者治疗后接受为期1年的随访,每3个月随访1次,随访方式包括电话、门诊复查、微信。预后不良定义为治疗后1年内出现心绞痛、心律失常、心源性猝死、心源性休克、AMI或HF再入院。
1.3 统计学分析
本研究数据采用IBM SPSS 25.0软件进行统计学分析。计量资料以(x±s)表示,组间比较采用t检验; 计数资料以[n(%)]表示,组间比较采用χ2检验。采用Cox回归模型分析影响因素; 通过内部验证和外部验证评估列线图性能: 采用Hosmer-Lemeshoe检验评估拟合优度,绘制校正曲线验证校准度,绘制受试者工作特征(ROC)曲线分析区分度,并通过决策曲线分析(DCA)评估临床实用性。P < 0.05表示差异有统计学意义。
2. 结果
2.1 训练集和验证集临床资料比较
训练集患者的年龄、性别、受教育程度、合并症、血运重建情况、病变血管数量、疾病类型、吸烟史、饮酒史、发病至入院时间、心功能分级、四肢功能状态、BMI和LDL-C、HDL-C、TG、TC、血肌酐、白细胞、CRP、CK-MB、cTnT、LVEF水平与验证集患者比较,差异均无统计学意义(P>0.05), 见表 1。
表 1 训练集和验证集患者的临床资料比较(x±s)[n(%)]指标 分类 训练集(n=252) 验证集(n=86) t/χ2 P 年龄 < 60岁 107(42.46) 33(38.37) 0.442 0.506 ≥60岁 145(57.54) 53(61.63) 性别 男 138(54.76) 50(58.14) 0.296 0.586 女 114(45.24) 36(41.86) 受教育程度 中专及以下 160(63.49) 51(59.30) 0.480 0.488 大专及以上 92(36.51) 35(40.70) 合并症 高血压 96(38.10) 34(39.53) 0.056 0.813 糖尿病 49(19.44) 19(22.09) 0.280 0.597 外周血管疾病 19(7.54) 8(9.30) 0.271 0.603 肺炎 74(29.37) 24(27.91) 0.066 0.797 血运重建 57(22.62) 17(19.77) 0.305 0.581 病变血管数量 单支 110(43.65) 46(53.49) 2.497 0.114 多支 142(56.35) 40(46.51) 疾病类型 STEMI 191(75.79) 72(83.72) 2.334 0.127 NSTEMI 61(24.21) 14(16.28) 吸烟史 118(46.83) 44(51.16) 0.483 0.487 饮酒史 37(14.68) 12(13.95) 0.027 0.868 发病至入院时间 < 4 h 140(55.56) 45(52.33) 0.270 0.603 ≥4 h 112(44.44) 41(47.67) 心功能分级 Ⅱ级 151(59.92) 52(60.47) 0.008 0.929 Ⅲ~Ⅳ级 101(40.08) 34(39.53) 四肢功能状态 自如 194(76.98) 68(79.07) 0.160 0.689 乏力 58(23.02) 18(20.93) BMI/(kg/m2) 23.53±3.07 22.91±2.76 1.658 0.098 实验室指标 LDL-C/(mmol/L) 1.99±0.32 1.92±0.30 1.779 0.076 HDL-C/(mmol/L) 1.20±0.25 1.22±0.23 0.653 0.514 TG/(mmol/L) 1.09±0.27 1.06±0.25 0.906 0.365 TC/(mmol/L) 4.86±1.33 4.92±1.35 0.360 0.719 血肌酐/(μmol/L) 93.73±19.16 95.14±20.62 0.578 0.564 白细胞/(×109/L) 12.37±3.45 12.50±3.61 0.298 0.766 CRP/(mg/L) 10.95±2.69 10.81±2.70 0.416 0.677 心功能指标 CK-MB/(ng/mL) 77.54±16.21 77.39±18.02 0.072 0.943 cTnT/(μg/L) 1.06±0.29 1.03±0.22 0.877 0.381 LVEF/% 57.50±5.41 57.99±5.68 0.716 0.474 BMI: 体质量指数; LDL-C: 低密度脂蛋白胆固醇; HDL-C: 高密度脂蛋白胆固醇; TG: 甘油三酯; TC: 总胆固醇;
CRP: C反应蛋白; CK-MB: 肌酸激酶同工酶; cTnT: 心肌肌钙蛋白T; LVEF: 左心室射血分数。2.2 训练集AMI合并HF患者预后不良的单因素分析
预后良好组AMI合并HF患者的性别、受教育程度、合并症、血运重建情况、病变血管数量、疾病类型、吸烟史、饮酒史、四肢功能状态、BMI和LDL-C、HDL-C、TG、TC、白细胞、CRP、CK-MB水平与预后不良组比较,差异均无统计学意义(P>0.05); 预后不良组的血肌酐、cTnT水平及年龄≥60岁者占比、发病至入院时间≥4 h者占比、心功能分级Ⅲ~Ⅳ级者占比高于预后良好组, LVEF低于预后良好组,差异有统计学意义(P < 0.05), 见表 2。
表 2 训练集AMI合并HF患者预后不良的单因素分析(x±s)[n(%)]指标 分类 预后良好组(n=192) 预后不良组(n=60) t/χ2 P 年龄 < 60岁 98(51.04) 9(15.00) 24.306 < 0.001 ≥60岁 94(48.96) 51(85.00) 性别 男 102(53.12) 36(60.00) 0.872 0.350 女 90(46.88) 24(40.00) 受教育程度 中专及以下 121(63.02) 39(65.00) 0.077 0.781 大专及以上 71(36.98) 21(35.00) 合并症 高血压 71(36.98) 25(41.67) 0.426 0.514 糖尿病 35(18.23) 14(23.33) 0.760 0.383 外周血管疾病 12(6.25) 7(11.67) 1.924 0.165 肺炎 56(29.17) 18(30.00) 0.015 0.902 血运重建 48(25.00) 9(15.00) 2.612 0.106 病变血管数量 单支 86(44.79) 24(40.00) 0.427 0.514 多支 106(55.21) 36(60.00) 疾病类型 STEMI 142(73.96) 49(81.67) 1.481 0.224 NSTEMI 50(26.04) 11(18.33) 吸烟史 90(46.88) 28(46.67) 0.001 0.977 饮酒史 25(13.02) 12(20.00) 1.778 0.182 发病至入院时间 < 4 h 127(66.15) 13(21.67) 36.629 < 0.001 ≥4 h 65(33.85) 47(78.33) 心功能分级 Ⅱ级 133(69.27) 18(30.00) 29.536 < 0.001 Ⅲ~Ⅳ级 59(30.73) 42(70.00) 四肢功能状态 自如 151(78.65) 43(71.67) 1.257 0.262 乏力 41(21.35) 17(28.33) BMI/(kg/m2) 23.45±3.02 23.79±3.10 0.756 0.450 实验室指标 LDL-C/(mmol/L) 1.98±0.36 2.01±0.32 0.578 0.564 HDL-C/(mmol/L) 1.20±0.26 1.18±0.24 0.529 0.597 TG/(mmol/L) 1.08±0.28 1.11±0.27 0.730 0.466 TC/(mmol/L) 4.85±1.32 4.90±1.37 0.254 0.800 血肌酐/(μmol/L) 88.24±18.35 111.29±22.98 7.975 < 0.001 白细胞/(×109/L) 12.16±3.78 13.04±3.25 1.625 0.105 CRP/(mg/L) 10.92±2.67 11.04±2.75 0.302 0.763 心功能指标 CK-MB/(ng/mL) 76.48±15.10 80.94±16.30 1.959 0.051 cTnT/(μg/L) 0.98±0.22 1.32±0.38 8.624 < 0.001 LVEF/% 59.10±5.75 52.39±5.26 8.047 < 0.001 2.3 AMI合并HF患者预后不良的多因素Cox回归分析
将AMI合并HF患者预后不良(是=1, 否=0)作为因变量, 将单因素分析中差异有统计学意义的指标[年龄(< 60岁=0, ≥60岁=1)、发病至入院时间(< 4 h=0, ≥4 h=1)、心功能分级(Ⅱ级=0, Ⅲ~Ⅳ级=1)、血肌酐(连续变量)、cTnT(连续变量)、LVEF(连续变量)]作为自变量,行多因素Cox回归分析。分析结果显示,发病至入院时间、心功能分级、血肌酐、cTnT、LVEF是AMI合并HF患者预后不良的独立影响因素(P < 0.05), 见表 3。
表 3 AMI合并HF患者预后不良的多因素Cox回归分析结果因素 β SE Wald χ2 HR 95%CI P 年龄 0.522 0.635 0.676 1.686 0.485~5.857 0.411 发病至入院时间 2.666 0.621 18.453 14.375 4.260~48.506 < 0.001 心功能分级 1.662 0.582 8.147 5.269 1.683~16.495 0.004 血肌酐 0.048 0.013 13.233 1.050 1.023~1.077 < 0.001 cTnT 6.618 1.405 22.195 8.283 7.685~42.263 < 0.001 LVEF -0.242 0.059 16.861 0.785 0.699~0.881 < 0.001 常量 -2.822 3.385 0.695 5.059 — 0.004 2.4 AMI合并HF患者预后不良的列线图预测模型构建及内部验证
基于多因素Cox回归分析筛选出的5个独立变量(血肌酐、cTnT、LVEF、发病至入院时间、心功能分级),构建AMI合并HF患者预后不良的列线图预测模型。该模型的总分范围为104~134分,对应AMI合并HF患者预后不良的发生概率为0.1~0.9, 见图 1。
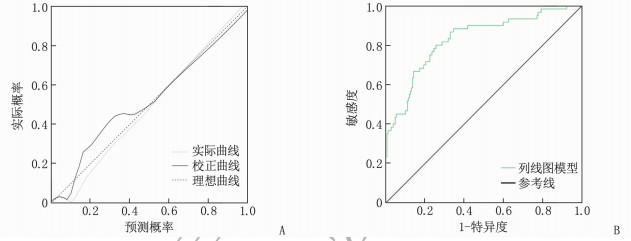
对列线图模型进行内部验证: Hosmer-Lemeshoe检验显示,模型拟合优度良好(χ2=13.966, P=0.083); 校正曲线分析结果显示, 预测概率与实际概率高度一致,表明该模型校准度优良,见图 2A; ROC曲线分析结果显示,该模型预测AMI合并HF患者预后不良的曲线下面积(AUC)为0.831(95%CI: 0.769~0.894), 敏感度为82.36%, 特异度为73.86%, 表明模型区分度良好,见图 2B。
2.5 AMI合并HF患者预后不良列线图预测模型的外部验证
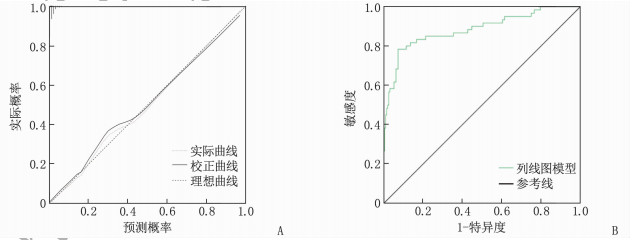
对列线图模型进行外部验证: Hosmer-Lemeshoe检验显示,模型拟合优度良好(χ2=6.465, P=0.136); 校正曲线分析结果显示,预测概率与实际概率基本一致,表明模型校准度优良,见图 3A; ROC曲线分析结果显示,该模型预测AMI合并HF患者预后不良的AUC为0.884(95%CI: 0.828~0.940), 敏感度为79.62%, 特异度为91.45%, 表明模型区分度良好,见图 3B。
2.6 列线图模型的临床实用性评估
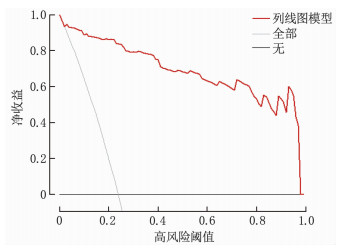
DCA结果显示, AMI合并HF患者预后不良列线图预测模型在高风险阈值范围为0.02~0.98时具有良好的临床净获益,见图 4。
3. 讨论
近年来,全球人口老龄化加剧, AMI已成为致残和致死的主要原因之一[9-10]。AMI后心肌细胞大量丧失可引发不良心室重塑, 涉及心室形态、生理功能及细胞分子机制的异常改变,进而导致HF的发生,显著增加患者的死亡风险[11]。因此, AMI合并HF患者亟需精准的预后风险分层方法、个体化治疗方案及随访策略。
列线图模型在医疗决策中具有重要价值,可使患者显著获益[12-14]。本研究构建的列线图模型显示: ①血肌酐每升高10 μmol/L, 影响权重增加2.78分。血肌酐是肌肉代谢产物, 主要经肾小球排泄并随尿液排出,极少经肾小管重吸收,故其测定值可反映患者肾功能状况[15]。既往研究[16-17]显示, 血肌酐水平与AMI患者术后预后不良相关,肾功能异常者预后不良发生率显著增高。② cTnT每升高0.2 μg/L, 影响权重增加8.46分。cTnT是心肌细胞结构蛋白,存在于肌原纤维中,参与心肌收缩调节。AMI及HF患者心肌缺血严重,心肌细胞受损, cTnT从肌原纤维中降解并释放入血,导致其水平持续升高[18]。因此,血清cTnT水平越高, AMI合并HF患者心肌缺血越严重,预后不良风险越高。③ LVEF每降低5%, 影响权重增加8.24分; 心功能分级Ⅲ~Ⅳ级时,影响权重增加11.95分。LVEF是评价左心室功能的重要指标,患者心功能分级越高,则LVEF越低[19]。研究[20]表明, 心功能较差者的心功能分级越高,预后不良风险越高。④发病至入院时间≥4 h, 影响权重增加17.51分。既往研究[21]表明,冠状动脉闭塞时间越长,心肌坏死率越高。因此, AMI合并HF患者应尽早入院接受治疗,以把握最佳治疗时机,改善预后。临床上,医护人员需对发病至入院时间≥4 h的患者保持高度警惕。此外,医院可根据实际情况建立急诊绿色通道,急救医生接到急救电话后应指导患者家属实施早期急救措施,避免随意挪动患者,确保其充分休息。若患者病情复杂,应及时联系专家会诊以明确诊断,选择合适的介入治疗或静脉溶栓方案,并做好手术准备。
高性能的列线图模型需具备良好的区分度,并具有一定的校准能力。当列线图模型的AUC>0.75时,表明该模型具有良好的区分度,可有效区分预后不良的高风险与低风险患者。本研究构建的列线图模型具有较高的AUC值(内部验证为0.831, 外部验证为0.884), 表明区分度良好。此外,内部验证和外部验证的校准曲线显示,预测结果与实际情况高度一致,进一步证实了预测结果的可靠性。DCA结果显示,在高风险阈值范围为0.02~0.98时,该模型可提供正收益,从而辅助临床决策。值得注意的是,本研究存在以下局限性: 首先,受样本限制,本研究未区分ST段抬高型与非ST段抬高型AMI患者,也未对HF进行分型; 其次,部分重要指标(如N端脑钠肽前体、超声心动图参数等)因数据缺失较多而未纳入模型,可能对研究结果产生一定影响; 再次,样本的代表性受到一定限制; 最后,缺乏其他机构的大样本数据进行外部验证,因此该模型的外推性尚需进一步评估。
综上所述,本研究基于独立影响因素(血肌酐、cTnT、LVEF、发病至入院时间、心功能分级)构建的列线图预测模型,能够有效预测AMI合并HF患者的预后不良情况,进而识别高危患者。验证结果显示,该模型具有较高的预测准确性,可为改善此类患者的长期生存质量提供重要参考。
-
表 1 训练集和验证集患者的临床资料比较(x±s)[n(%)]
指标 分类 训练集(n=252) 验证集(n=86) t/χ2 P 年龄 < 60岁 107(42.46) 33(38.37) 0.442 0.506 ≥60岁 145(57.54) 53(61.63) 性别 男 138(54.76) 50(58.14) 0.296 0.586 女 114(45.24) 36(41.86) 受教育程度 中专及以下 160(63.49) 51(59.30) 0.480 0.488 大专及以上 92(36.51) 35(40.70) 合并症 高血压 96(38.10) 34(39.53) 0.056 0.813 糖尿病 49(19.44) 19(22.09) 0.280 0.597 外周血管疾病 19(7.54) 8(9.30) 0.271 0.603 肺炎 74(29.37) 24(27.91) 0.066 0.797 血运重建 57(22.62) 17(19.77) 0.305 0.581 病变血管数量 单支 110(43.65) 46(53.49) 2.497 0.114 多支 142(56.35) 40(46.51) 疾病类型 STEMI 191(75.79) 72(83.72) 2.334 0.127 NSTEMI 61(24.21) 14(16.28) 吸烟史 118(46.83) 44(51.16) 0.483 0.487 饮酒史 37(14.68) 12(13.95) 0.027 0.868 发病至入院时间 < 4 h 140(55.56) 45(52.33) 0.270 0.603 ≥4 h 112(44.44) 41(47.67) 心功能分级 Ⅱ级 151(59.92) 52(60.47) 0.008 0.929 Ⅲ~Ⅳ级 101(40.08) 34(39.53) 四肢功能状态 自如 194(76.98) 68(79.07) 0.160 0.689 乏力 58(23.02) 18(20.93) BMI/(kg/m2) 23.53±3.07 22.91±2.76 1.658 0.098 实验室指标 LDL-C/(mmol/L) 1.99±0.32 1.92±0.30 1.779 0.076 HDL-C/(mmol/L) 1.20±0.25 1.22±0.23 0.653 0.514 TG/(mmol/L) 1.09±0.27 1.06±0.25 0.906 0.365 TC/(mmol/L) 4.86±1.33 4.92±1.35 0.360 0.719 血肌酐/(μmol/L) 93.73±19.16 95.14±20.62 0.578 0.564 白细胞/(×109/L) 12.37±3.45 12.50±3.61 0.298 0.766 CRP/(mg/L) 10.95±2.69 10.81±2.70 0.416 0.677 心功能指标 CK-MB/(ng/mL) 77.54±16.21 77.39±18.02 0.072 0.943 cTnT/(μg/L) 1.06±0.29 1.03±0.22 0.877 0.381 LVEF/% 57.50±5.41 57.99±5.68 0.716 0.474 BMI: 体质量指数; LDL-C: 低密度脂蛋白胆固醇; HDL-C: 高密度脂蛋白胆固醇; TG: 甘油三酯; TC: 总胆固醇;
CRP: C反应蛋白; CK-MB: 肌酸激酶同工酶; cTnT: 心肌肌钙蛋白T; LVEF: 左心室射血分数。表 2 训练集AMI合并HF患者预后不良的单因素分析(x±s)[n(%)]
指标 分类 预后良好组(n=192) 预后不良组(n=60) t/χ2 P 年龄 < 60岁 98(51.04) 9(15.00) 24.306 < 0.001 ≥60岁 94(48.96) 51(85.00) 性别 男 102(53.12) 36(60.00) 0.872 0.350 女 90(46.88) 24(40.00) 受教育程度 中专及以下 121(63.02) 39(65.00) 0.077 0.781 大专及以上 71(36.98) 21(35.00) 合并症 高血压 71(36.98) 25(41.67) 0.426 0.514 糖尿病 35(18.23) 14(23.33) 0.760 0.383 外周血管疾病 12(6.25) 7(11.67) 1.924 0.165 肺炎 56(29.17) 18(30.00) 0.015 0.902 血运重建 48(25.00) 9(15.00) 2.612 0.106 病变血管数量 单支 86(44.79) 24(40.00) 0.427 0.514 多支 106(55.21) 36(60.00) 疾病类型 STEMI 142(73.96) 49(81.67) 1.481 0.224 NSTEMI 50(26.04) 11(18.33) 吸烟史 90(46.88) 28(46.67) 0.001 0.977 饮酒史 25(13.02) 12(20.00) 1.778 0.182 发病至入院时间 < 4 h 127(66.15) 13(21.67) 36.629 < 0.001 ≥4 h 65(33.85) 47(78.33) 心功能分级 Ⅱ级 133(69.27) 18(30.00) 29.536 < 0.001 Ⅲ~Ⅳ级 59(30.73) 42(70.00) 四肢功能状态 自如 151(78.65) 43(71.67) 1.257 0.262 乏力 41(21.35) 17(28.33) BMI/(kg/m2) 23.45±3.02 23.79±3.10 0.756 0.450 实验室指标 LDL-C/(mmol/L) 1.98±0.36 2.01±0.32 0.578 0.564 HDL-C/(mmol/L) 1.20±0.26 1.18±0.24 0.529 0.597 TG/(mmol/L) 1.08±0.28 1.11±0.27 0.730 0.466 TC/(mmol/L) 4.85±1.32 4.90±1.37 0.254 0.800 血肌酐/(μmol/L) 88.24±18.35 111.29±22.98 7.975 < 0.001 白细胞/(×109/L) 12.16±3.78 13.04±3.25 1.625 0.105 CRP/(mg/L) 10.92±2.67 11.04±2.75 0.302 0.763 心功能指标 CK-MB/(ng/mL) 76.48±15.10 80.94±16.30 1.959 0.051 cTnT/(μg/L) 0.98±0.22 1.32±0.38 8.624 < 0.001 LVEF/% 59.10±5.75 52.39±5.26 8.047 < 0.001 表 3 AMI合并HF患者预后不良的多因素Cox回归分析结果
因素 β SE Wald χ2 HR 95%CI P 年龄 0.522 0.635 0.676 1.686 0.485~5.857 0.411 发病至入院时间 2.666 0.621 18.453 14.375 4.260~48.506 < 0.001 心功能分级 1.662 0.582 8.147 5.269 1.683~16.495 0.004 血肌酐 0.048 0.013 13.233 1.050 1.023~1.077 < 0.001 cTnT 6.618 1.405 22.195 8.283 7.685~42.263 < 0.001 LVEF -0.242 0.059 16.861 0.785 0.699~0.881 < 0.001 常量 -2.822 3.385 0.695 5.059 — 0.004 -
[1] THRANE P G, KRISTENSEN S D, OLESEN K K W, et al. 16-year follow-up of the Danish acute myocardial infarction 2(DANAMI-2) trial: primary percutaneous coronary intervention vs. fibrinolysis in ST-segment elevation myocardial infarction[J]. Eur Heart J, 2020, 41(7): 847-854. doi: 10.1093/eurheartj/ehz595
[2] CHEN Q X, SU L N, LIU C F, et al. PRKAR1A and SDCBP serve as potential predictors of heart failure following acute myocardial infarction[J]. Front Immunol, 2022, 13: 878876. doi: 10.3389/fimmu.2022.878876
[3] NÄGELE M P, FLAMMER A J. Heart failure after right ventricular myocardial infarction[J]. Curr Heart Fail Rep, 2022, 19(6): 375-385. doi: 10.1007/s11897-022-00577-8
[4] LIN X L, SUN H X, LI F Q, et al. Admission high-sensitivity C-reactive protein levels improve the Grace risk score prediction on in-hospital outcomes in acute myocardial infarction patients[J]. Clin Cardiol, 2022, 45(3): 282-290. doi: 10.1002/clc.23749
[5] TANG Y Y, CHEN Q, ZHA L H, et al. Development and validation of nomogram to predict long-term prognosis of critically ill patients with acute myocardial infarction[J]. Int J Gen Med, 2021, 14: 4247-4257. doi: 10.2147/IJGM.S310740
[6] SIA C H, ZHENG H L, KO J, et al. Comparison of the modified Singapore myocardial infarction registry risk score with GRACE 2. 0 in predicting 1-year acute myocardial infarction outcomes[J]. Sci Rep, 2022, 12(1): 14270. doi: 10.1038/s41598-022-16523-6
[7] ARNETT D K, BLUMENTHAL R S, ALBERT M A, et al. 2019 ACC/AHA guideline on the primary prevention of cardiovascular disease: a report of the American college of cardiology/American heart association task force on clinical practice guidelines[J]. Circulation, 2019, 140(11): e596-e646.
[8] MCDONAGH T A, METRA M, ADAMO M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure[J]. Eur Heart J, 2021, 42(36): 3599-3726. doi: 10.1093/eurheartj/ehab368
[9] LINDAHL B, MILLS N L. A new clinical classification of acute myocardial infarction[J]. Nat Med, 2023, 29(9): 2200-2205. doi: 10.1038/s41591-023-02513-2
[10] 仇盛蕾, 尚菊菊, 周琦, 等. 364例急性心肌梗死患者预后影响因素回顾性分析[J]. 中华中医药杂志, 2023, 38(6): 2965-2968. [11] DEL BUONO M G, MORONI F, MONTONE R A, et al. Ischemic cardiomyopathy and heart failure after acute myocardial infarction[J]. Curr Cardiol Rep, 2022, 24(10): 1505-1515. doi: 10.1007/s11886-022-01766-6
[12] ZHANG S C, ZHU Z, LUO M Q, et al. The optimal definition and prediction nomogram for left ventricular remodelling after acute myocardial infarction[J]. ESC Heart Fail, 2023, 10(5): 2955-2965. doi: 10.1002/ehf2.14479
[13] CHEN S Y, PAN X L, MO J H, et al. Establishment and validation of a prediction nomogram for heart failure risk in patients with acute myocardial infarction during hospitalization[J]. BMC Cardiovasc Disord, 2023, 23(1): 619. doi: 10.1186/s12872-023-03665-2
[14] WANG L, YANG L T, LI T, et al. Development and validation of nomogram for the prediction of malignant ventricular arrhythmia including circulating inflammatory cells in patients with acute ST-segment elevation myocardial infarction[J]. J Inflamm Res, 2023, 16: 3185-3196. doi: 10.2147/JIR.S420305
[15] CHEN X, JIN H, WANG D, et al. Serum creatinine levels, traditional cardiovascular risk factors and 10-year cardiovascular risk in Chinese patients with hypertension[J]. Front Endocrinol (Lausanne), 2023, 14: 1140093. doi: 10.3389/fendo.2023.1140093
[16] KHOURY S, FRYDMAN S, ABU-KATASH H, et al. Impact of care bundles on the occurrence and outcomes of acute kidney injury among patients withST-segment elevation myocardial infarction[J]. J Nephrol, 2023, 36(9): 2491-2497. doi: 10.1007/s40620-023-01652-6
[17] TAN J, ZHANG Y H, SI J, et al. Incidence, predictors and prognosis of acute kidney injury in acute ST-segment elevation myocardial infarction patients undergoing emergent coronary angiography/primary percutaneous coronary intervention[J]. J Geriatr Cardiol, 2023, 20(2): 139-149. doi: 10.26599/1671-5411.2023.02.004
[18] KATRUKHA I A, RIABKOVA N S, KOGAN A E, et al. Fragmentation of human cardiac troponin T after acute myocardial infarction[J]. Clin Chim Acta, 2023, 542: 117281. doi: 10.1016/j.cca.2023.117281
[19] 王莹莹, 蔡丽丽. Logistic回归预测模型构建分析急性心肌梗死患者住院期间不良事件发生影响因素[J]. 中国急救复苏与灾害医学杂志, 2023, 18(5): 573-577. [20] TANG N, CHEN X J, LI K M, et al. Myocardial perfusion in ST-segment elevation myocardial infarction patients after percutaneous coronary intervention: influencing factors and intervention strategies[J]. Cureus, 2023, 15(8): e42841.
[21] MILASINOVIC D, MLADENOVIC D, ZAHARIJEV S, et al. Prognostic impact of non-culprit chronic total occlusion over time in patients with ST-elevation myocardial infarction treated with primary percutaneous coronary intervention[J]. Eur Heart J Acute Cardiovasc Care, 2021, 10(9): 990-998. doi: 10.1093/ehjacc/zuab041




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号