Delayed thrombosis complicated by infective endocarditis after transcatheter aortic valve replacement: a case report
-
摘要:
经导管主动脉瓣置换术(TAVR)是治疗重度主动脉瓣狭窄的一种成熟的治疗方法, 其中急性感染性心内膜炎(AIE)是术后少见且严重的并发症之一。目前,此类心内膜炎(IE)的治疗尚无明确推荐指南。本研究报道1例TAVR术后迟发血栓形成,继而并发AIE的病例, 最终行外科手术治疗后好转。
Abstract:Transcatheter aortic valve replacement (TAVR) has emerged as a well-established treatment for severe aortic stenosis. Acute infective endocarditis (AIE) represents a rare severe complication following this procedure. Currently, there are no definitive guideline recommendations for management of such infective endocarditis (IE). This study presented a case of delayed thrombosis after TAVR, which subsequently developed into AIE. The patient eventually underwent surgical treatment and showed significant improvement.
-
经导管主动脉瓣置换术(TAVR)是治疗重度主动脉瓣狭窄的方法,急性感染性心内膜炎(AIE)为其少见严重并发症。本研究报道1例TAVR术后迟发血栓并发AIE案例,经外科手术后好转出院。
1. 临床资料
患者女,75岁,因“发热伴恶心呕吐20 h”入院。患者既往有高血压及乳腺肿瘤手术史,2023年7月12日因重度主动脉瓣狭窄在外院接受TAVR治疗,术后规律行华法林抗凝治疗,复查凝血功能示国际标准化比值(INR)维持2~3。2024年1月19日外院复查超声心动图(TTE)显示人工瓣膜支架前方与自体主动脉瓣根部间可见等回声团块(10 mm×10 mm), 考虑血栓可能,患者无明显不适,继续抗凝治疗。2024年7月31日复查TTE, 仍提示该部位等回声团块(6 mm×8 mm)。
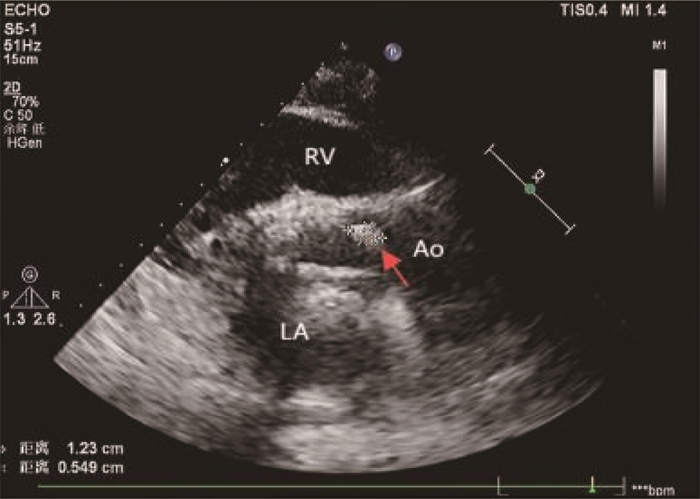
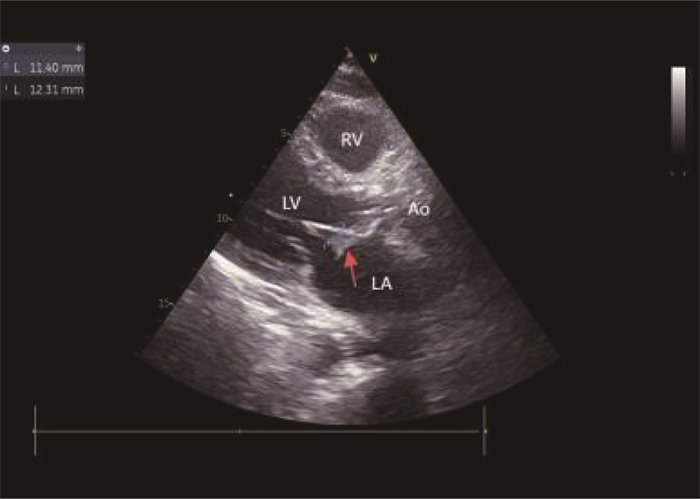
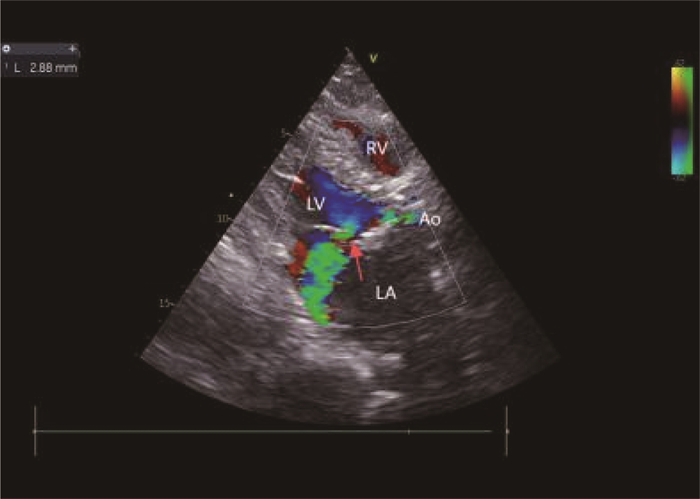
2024年8月6日患者突发畏寒、高热(体温40 ℃), 伴恶心、呕吐,无腹痛、腹泻、咳嗽、咳痰、头晕、头痛,退热治疗效果不佳后入院。查体: 体温38 ℃, 脉搏78次/min, 呼吸频率20次/min, 收缩压84 mmHg(1 mmHg=0.133 kPa), 舒张压41 mmHg。患者神志清楚,精神欠佳,双肺呼吸音粗,未闻及明显干湿性啰音; 心律齐,各瓣膜区未闻及病理性杂音; 腹软,无压痛、反跳痛,肠鸣音4次/min, 无双下肢水肿。血常规: 白细胞7.27×109/L、中性粒细胞92.7%、淋巴细胞百分比5.0%、血小板48×109/L。肝功能: 谷丙转氨酶28.1 U/L、谷草转氨酶67 U/L。肾功能: 尿酸292 μmol/L、尿素13.67 μmol/L、肌酐162 μmol/L。予以哌拉西林钠他唑巴坦钠经验性抗感染治疗,体温仍持续波动在39 ℃左右, 3 d后血培养提示金黄色葡萄球菌感染。TTE显示(见图 1): 左房内径38 mm、左室舒张末径47 mm、左室射血分数62%, 生物瓣局部强回声团块(12 mm×5 mm), 二尖瓣、三尖瓣轻度反流,诊断AIE。根据药敏试验结果及肝肾功能调整抗生素为万古霉素500 mg(每12 h 1次),治疗5 d后血象稍有下降,但仍高热不退。8月10日患者出现气喘,考虑心力衰竭,予扩血管、利尿等治疗,万古霉素联用头孢西丁1 g(每12 h 1次),治疗3 d, 体温降至38.5 ℃, 但呼吸困难加重。8月16日复查TTE: 二尖瓣前叶左房面赘生物形成(约12 mm×11 mm, 见图 2), 前叶穿孔可能(见图 3)伴二尖瓣重度反流,三尖瓣中-重度反流,主动脉瓣轻度反流。
请心脏外科会诊后转科进一步诊治,于8月20日行主动脉瓣生物瓣置换+二尖瓣生物瓣置换+三尖瓣成形+感染病灶清除+室间隔缺损修补+左心耳封堵+冠状动脉搭桥+心脏临时起搏器植入术。术中心内探查示二尖瓣前叶赘生物伴中度关闭不全, TAVR瓣膜在位但伴赘生物及瓣周脓肿,室间隔膜部右冠瓣下方穿孔(0.5 cm), 三尖瓣环扩大并伴中-重度关闭不全,二尖瓣前隔交界处脓肿形成并与室间隔穿孔相通,术中取出TAVR瓣膜(见图 4)。术后病理: 灶区黏液样变性,灶区玻璃样变性。术后出现三度房室传导阻滞,予以对症治疗。术后予头孢唑林1 g每8 h 1次+邦达4.5 g每8 h 1次联用9 d, 后改用邦达4.5 g每8 h 1次+达托霉素0.5 g(1次/d) 治疗3 d, 后单用达托霉素0.5 g(1次/d)治疗16 d, 并给予其他对症支持治疗,感染控制后植入永久起搏器。出院后继续抗凝治疗,术后3个月随访,患者无发热、胸闷或气促,复查TTE显示: 左房内径32 mm、左室舒张末径42 mm、左室射血分数55%, 生物瓣功能良好,未见赘生物或血栓形成。
2. 讨论
患者为老年女性,既往有高血压及乳腺恶性肿瘤手术史, TAVR术后长期行华法林抗凝治疗,且INR达标,术后6个月复查TTE提示生物瓣架局部出现强回声团块,考虑为血栓,继续抗凝治疗。6个月后复查发现血栓体积有所缩小,患者在此期间未出现任何不适症状。此次患者突发畏寒、发热,经过10 d的抗感染治疗后出现严重并发症,最终行外科手术治疗并得到好转。
回顾性分析本病例,可为TAVR术后并发症的治疗提供启示。⑴血栓形成原因: ① TAVR术中,退化的原生瓣膜被保留在原位作为锚定结构,可能成为血栓形成的诱因[1]。②植入的TAVR瓣叶与自体主动脉瓣瓣叶之间形成了新的解剖结构—新窦,可能导致血液瘀滞,从而增加血栓形成的风险[2]。⑵血栓的治疗: TAVR术后使用华法林抗凝治疗具有临床意义。在服用维生素K拮抗剂的患者中,若发生TAVR血栓,在不添加抗血小板治疗的情况下,目标INR需提升至2.5~3.5, 以有效减少血栓形成[3]。对于耐药或临床不稳定的患者,超低或低剂量的溶栓药物输注可能有效且安全[4]。若患者无法耐受药物治疗,应考虑重新介入TAVR或外科手术[5]。血栓消退后,若患者没有高出血风险特征,建议长期使用维生素K拮抗剂或新型口服抗凝药[5]。
该患者在术后长期服用华法林抗凝治疗期间形成了血栓,继续抗凝治疗6个月后血栓有所缩小,表明此类患者需要加强抗凝治疗。患者还并发了心内膜炎(IE),这可能与血栓继发感染有关。IE是TAVR术后罕见且严重的并发症。TAVR术后IE被视为人工瓣膜心内膜炎(PVE)的一种亚型,但由于其特定的患者群体(通常为合并症较多的老年患者)以及微生物学特征, IE相关并发症的发生率较高,且手术难度大,因此大多数TAVR-IE患者预后不良[6]。
目前,关于TAVR术后感染的治疗缺乏明确的指南。普通IE的治疗原则为足量、长程抗生素治疗,并在适当时机选择手术治疗。静脉抗生素治疗应基于微生物学特征和药敏试验结果,并且治疗时间应超过原发性IE患者(通常至少6周)。该患者接受抗生素治疗后未见显著效果,病情进一步加重,并出现了瓣周脓肿、二尖瓣赘生物、室间隔穿孔及急性心力衰竭等严重并发症。对于PVE患者,欧洲心脏协会指南推荐存在心力衰竭、严重假体功能障碍、脓肿或由葡萄球菌或非发酵革兰氏阴性菌引起的PVE时,应考虑紧急或择期手术治疗[7]。
TAVR-IE患者的手术治疗具有较高的挑战性。TAVR瓣膜支架框架内皮细胞生长,且膨胀装置的大型支架框架与升主动脉粘连,导致取出TAVR瓣膜的难度增加。此外,该患者还合并了二尖瓣赘生物、室间隔穿孔、三尖瓣关闭不全以及冠心病等,手术复杂且难度较大。由于涉及多个瓣膜手术以及冠状动脉旁路移植,手术时间延长,进一步增加了预后风险。如果合并主动脉根受累,还需进行主动脉根重建,进一步增加了手术难度。老年患者,尤其是对于合并基础疾病多、并发IE的患者,手术风险大,预后差。研究[8]表明,除了手术本身的挑战外,术后出现急性肾衰竭、呼吸衰竭、房颤、肺炎等并发症,或需要植入永久性起搏器的完全性心脏传导阻滞,都会对患者预后产生负面影响。
本例患者成功取出TAVR瓣膜及瓣架,并植入人工生物主动脉瓣,实现主动脉瓣置换,同时还成功完成了二尖瓣生物瓣置换、三尖瓣成形、室间隔修补以及冠状动脉搭桥术。术后,患者出现三度房室传导阻滞,待感染控制后行起搏器植入[9]。经过术后积极抗感染治疗,患者的感染和心力衰竭得到控制,病情显著好转,最终挽救生命。尽管如此,目前对于这类人群的手术并未有明确的治疗建议,且适应证通常根据经验个性化处理,因此未来仍需进一步研究以确定最佳的治疗时机和手术适应证。本病例为指导此类患者的治疗提供了有益的临床经验。
-
[1] TRIMAILLE A, HMADEH S, MATSUSHITA K, et al. Aortic stenosis and the haemostatic system[J]. Cardiovasc Res, 2023, 119(6): 1310-1323. doi: 10.1093/cvr/cvac192
[2] MIDHA P A, RAGHAV V, SHARMA R, et al. The fluid mechanics of transcatheter heart valve leaflet thrombosis in the neosinus[J]. Circulation, 2017, 136(17): 1598-1609. doi: 10.1161/CIRCULATIONAHA.117.029479
[3] HANSSON N C, GROVE E L, ANDERSEN H R, et al. Transcatheter aortic valve thrombosis: incidence, predisposing factors, and clinical implications[J]. J Am Coll Cardiol, 2016, 68(19): 2059-2069. doi: 10.1016/j.jacc.2016.08.010
[4] ADRICHEM R, BUDDE R P J, VAN MIEGHEM N M. Intravenous thrombolysis for bioprosthetic valve thrombosis[J]. Eur Heart J, 2023, 44(32): 3104. doi: 10.1093/eurheartj/ehad303
[5] ADRICHEM R, CABAU J R, MEHRAN R, et al. Treatment of transcatheter aortic valve thrombosis: JACC review topic of the week[J]. J Am Coll Cardiol, 2024, 84(9): 848-861. doi: 10.1016/j.jacc.2024.05.064
[6] DEL VAL D, PANAGIDES V, MESTRES C A, et al. Infective endocarditis after transcatheter aortic valve replacement: JACC state-of-the-art review[J]. J Am Coll Cardiol, 2023, 81(4): 394-412. doi: 10.1016/j.jacc.2022.11.028
[7] HABIB G, LANCELLOTTI P, ANTUNES M J, et al. 2015 esc guidelines for the management of infective endocarditis: the task force for the management of infective endocarditis of the European society of cardiology (esc). endorsed by: European association for Cardio-Thoracic surgery (eacts), the European association of nuclear medicine (eanm)[J]. Eur Heart J, 2015, 36(44): 3075-3128. doi: 10.1093/eurheartj/ehv319
[8] MANGI A A, RAMCHANDANI M, REARDON M. Surgical removal and replacement of chronically implanted transcatheter aortic prostheses: how I teach it[J]. Ann Thorac Surg, 2018, 105(1): 12-14. doi: 10.1016/j.athoracsur.2017.08.015
[9] GRUBITZSCH H, TARAR W, CLAUS B, et al. Risks and challenges of surgery for aortic prosthetic valve endocarditis[J]. Heart Lung Circ, 2018, 27(3): 333-343. doi: 10.1016/j.hlc.2017.05.143




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号
