Mechanism of Baijiang San in alleviating Crohn's disease by regulating oxidative stress based on bioinformatics analysis
-
摘要:目的
采用生物信息学分析探讨败酱散通过调节氧化应激(OS)缓解克罗恩病(CD)的作用靶点及潜在机制。
方法利用TCMSP数据库获取败酱散的活性成分及其所对应的靶标。在GEO数据库中下载CD相关数据集(GSE36807、GSE59071、GSE102133), 将差异分析得到的CD差异基因作为疾病治疗靶标。在Genecards数据库中搜索OS相关基因, 并获取药物活性成分与疾病、OS相关基因的共同作用靶点。使用Cytoscape软件构建“化合物-靶点”调控网络; 在String数据库制作蛋白互作(PPI)网络,将数据导入Cytoscape软件使用Cytohubba插件筛选核心靶点;利用R软件进行基因本体(GO)和京都基因与基因组百科全书(KEGG)富集分析; 使用Mirtarbase数据库、Starbase数据库、Targetscan数据库预测微小RNA(miRNA); 使用Enrichr数据库预测转录因子(TF), 使用Cytoscape软件构建“miRNA-TF-mRNA”调控网络。
结果CD差异基因175个,其中上调基因135个、下调基因40个。TCMSP数据库中败酱散有效成分: 薏苡仁9个,附子21个,败酱草13个。使用Cytohubba筛选排名前5的核心基因是白细胞介素-1β(IL-1β)、前列腺素内过氧化物合成酶2(PTGS2)、CXC趋化因子配体8(CXCL8)、细胞间黏附分子-1(ICAM1)、血管内皮细胞生长因子受体(KDR), 药物成分对应靶点较多的是槲皮素、山奈酚; KEGG富集分析的主要通路是糖尿病并发症中的晚期糖基化终产物及其受体(AGE-RAGE)信号通路、核因子κB(NF-κB)信号通路、肿瘤坏死因子(TNF)信号通路等;数据库中预测到76个miRNA, 5个转录因子。
结论败酱散通过调控OS缓解CD的机制是多成分、多靶点、多通路的生物过程。
Abstract:ObjectiveTo explore the target and potential mechanism of Baijiang San in alleviating Crohn's disease (CD) by regulating oxidative stress (OS) based on bioinformatics analysis.
MethodsThe active ingredients of Baijiang San and their corresponding targets were obtained by using TCMSP database. CD related datasets (GSE36807, GSE59071 and GSE102133) were downloaded from GEO database, and the CD differential genes obtained by differential analysis were used as targets for disease treatment. CD differential genes obtained by differential analysis were used as therapeutic targets for diseases. OS-related genes were searched in Genecards database, and the common targets of drug active ingredients, diseases and OS-related genes were obtained. Cytoscape software was used to construct the "compound-target" regulatory network; the protein-protein interaction (PPI) network was made in String database, and the data were imported into Cytoscape software to screen the core targets using Cytohubba plug-in; R software was used for Gene Ontology (GO) and Kyoto Encyclopedia of Genes and Genomes (KEGG) enrichment analysis; microRNA (miRNA) was predicted by Mirtarbase database, Starbase database and Targetscan database; the Enrichr database was used to predict transcription factor (TF) and Cytoscape software was used to construct "miRNA-TF-mRNA" networks.
ResultsThere were 175 differential CD genes, including 135 up-regulated genes and 40 down-regulated genes. In TCMSP database, Baijiang San included 9 effective ingredients in Yiyiren, 21 effective ingredients in Fuzi and 13 effective ingredients in Baijiangcao. The top 5 core genes screened by Cytohubba were interleukin-1β (IL-1β), prostaglandin-endoperoxide synthase 2 (PTGS2), C-X-C motif chemokine ligand 8 (CXCL8), intercellular adhesion molecule 1 (ICAM1), vascular endothelial cell growth factor-A receptor (KDR). Quercetin and kaempferol were the most common targets of drug components. The main pathways of KEGG enrichment analysis were advanced glycation end product (AGE)-receptor for AGE (AGE-RAGE) signaling pathway, nuclear factor-kappa B (NF-κB) signaling pathway and tumor necrosis factor (TNF) signaling pathway in diabetic complications; a total of 76 miRNAs and 5 transcription factors were predicted.
ConclusionThe mechanisms of Baijiang San in alleviating CD by regulating OS are a multi-component, multi-target and multi-pathway biological process.
-
Keywords:
- Baijiang San /
- Crohn's disease /
- oxidative stress /
- quercetin /
- kaempferol /
- bioinformatics analysis
-
克罗恩病(CD)属于炎症性肠炎(IBD), 是一种影响胃肠道的慢性炎性肉芽肿性疾病[1-2]。目前, CD尚不能根治,西医主要以抗炎药、免疫抑制药物[3]和抗肿瘤坏死因子为主的生物制剂治疗,这些药物服用期间限制较多,且疗效有限;新型药物如抑制淋巴细胞迁移的调节剂、靶向肠道组织降解和重塑的抑制剂等尚在研发中[4]。中医药辨证论治CD,具有独特疗效。
CD的临床特点与中医的“肠痈”“肛庸”“痔漏”“流注”相似,临床可从“肠痈”的角度来论治CD[5]。败酱散是治疗肠痈代表方[6], 出自《金匮要略》,由薏苡仁、附子、败酱草三味药组成,该方能排脓消痈,振奋阳气,临床应用广泛,对IBD疗效显著[7]。目前对该方治疗溃疡性结肠炎(UC)研究较多, CD与UC早期难以鉴别,根据中医辨证论治思想,该方亦适用于CD, 但对其治疗CD作用机制的研究较少。本研究基于生物信息学探讨败酱散调控氧化应激(OS)缓解CD的活性成分、潜在靶点、通路及机制,为进一步实验提供方向。
1. 数据库及软件
TCMSP数据库(https://tcmspw.com/tcmsp.php); Uniprot数据库(https://www.uniprot.org/); GEO数据库(https://www.ncbi.nlm.nih.gov/geo/); String11.5在线平台(https://stringdb.org); Genecards数据库(https://www.genecards.org/); Enrichr数据库(http://amp.pharm.mssm.edu/Enrichr/); Mirtarbase数据库(http://mirtarbase.mbc.nctu.edu.tw/index.html); Starbase数据库(https://starbase.sysu.edu.cn); Targetscan数据库(http://www.targetscan.org/vert_71/); Rstudio软件或R4.1.2软件; Cytoscape3.8.2软件。
2. 资料与方法
2.1 CD相关靶点筛选
利用GEO数据库,以“crohn′s disease”为检索词,通过筛选,下载GSE36807、GSE59071、GSE102133数据集以及对应GPL平台文件,将上述数据集中CD组(CD, n=86)以及对照组(正常, n=30)合并、矫正,使用R软件利用“Limma”包以lgFC>1、矫正后P < 0.05为条件筛选出差异表达基因,将这些基因作为疾病作用靶点。
2.2 药物活性成分及靶点筛选
以口服利用度(OB)≥30%, 类药性(DL)≥0.18为有效活性成分筛选条件,在TCMSP数据库筛选,获取薏苡仁、附子、败酱草3味中药有效成分。结合TCMSP中Relate Targets的文件得到有效成分对应的靶点,再通过Uniprot数据库中注释文件,将靶点名转化为基因名。
2.3 OS相关基因获取
在Genecards数据库中以“oxidative stress”为关键词搜索相关基因,以“Relevance score≥7”为条件筛选获得OS相关基因。
2.4 药物与疾病共同靶点筛选及作用靶点网络构建
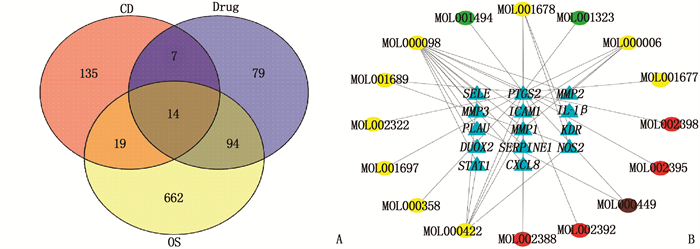
将2.1中的疾病靶点与2.2中药物靶点以及2.3中获取的OS相关基因取交集,绘制韦恩图,得到共同靶点数据,将其导入Cytoscape, 同时将上述“2.2”获得的活性成分及靶点关系数据导入进行调控网络构建。
2.5 蛋白互作(PPI)网络图构建与核心靶点筛选
将共同靶点导入String数据库,获取PPI网络图。下载TSV文件,导入Cytoscape软件,使用Cytohubba插件筛选出核心靶点。Cytohubba可准确筛选出网络中的重要节点,其中最大集团中心度(MCC)算法已被证实是预测重要靶点较为精确的方法[8]。
2.6 基因富集分析
通过R软件中相关的Bioconductor安装包,设置P=0.05, Q=0.05, 进行靶点基因的基因本体(GO)富集分析,保存富集结果并选取生物过程、细胞组分、分子功能各自前10位绘图。采用同样方法进行京都基因与基因组百科全书(KEGG)分析,并绘制与本研究相关的信号通路图。
2.7 微小RNA(miRNA)、转录因子(TF)预测及调控网络构建
使用Mirtarbase[9]、Starbase[10]和Targetscan[11]数据库预测共同靶点的靶向miRNA。取3个数据库交集miRNA作为预测的靶向miRNA。与共同靶点相关TFs在Enrichr数据库以P≤0.05为条件预测。将三者调控关系导入Cytoscape软件绘制调控网络图。
3. 结果
3.1 CD靶点筛选结果
在GEO数据库中获取CD相关数据: GSE36807、GSE59071、GSE102133数据集,选取其中正常组以及CD组,对数据进行归一化处理、合并、批次矫正。差异分析共得到差异基因175个,其中上调基因135个、下调基因40个,数据信息见表 1。
表 1 数据集信息表数据集 平台 正常组∶CD组 差异基因 上调基因 下调基因 GSE36807 GPL570 7∶13 135 40 GSE59071 GPL6244 11∶8 GSE102133 GPL6244 12∶65 3.2 药物成分及靶点筛选结果
使用TCMSP数据库搜索药物的成分,筛选后得到有效成分: 薏苡仁9个,附子21个,败酱草13个,见表 2。
表 2 药物有效成分药物 Mol ID 口服利用度/% 类药性 药物 Mol ID 口服利用度/% 类药性 薏苡仁 MOL008121 34.23 0.29 附子 MOL002419 82.54 0.21 薏苡仁 MOL008118 32.40 0.43 附子 MOL002421 84.08 0.25 薏苡仁 MOL002882 34.13 0.30 附子 MOL002422 50.82 0.73 薏苡仁 MOL002372 33.55 0.42 附子 MOL002423 33.41 0.19 薏苡仁 MOL001494 42.00 0.19 附子 MOL002433 41.52 0.22 薏苡仁 MOL001323 43.28 0.78 附子 MOL002434 38.16 0.80 薏苡仁 MOL000953 37.87 0.68 附子 MOL000359 36.91 0.75 薏苡仁 MOL000359 36.91 0.75 附子 MOL000538 31.39 0.26 附子 MOL002211 39.99 0.20 败酱草 MOL001676 33.96 0.22 附子 MOL002388 57.76 0.28 败酱草 MOL001677 58.02 0.52 附子 MOL002392 46.69 0.37 败酱草 MOL001678 39.94 0.41 附子 MOL002393 34.52 0.18 败酱草 MOL001790 39.84 0.71 附子 MOL002394 34.52 0.18 败酱草 MOL001689 34.97 0.24 附子 MOL002395 56.30 0.31 败酱草 MOL002322 31.29 0.72 附子 MOL002397 51.73 0.73 败酱草 MOL001697 63.39 0.53 附子 MOL002398 69.56 0.34 败酱草 MOL000358 36.91 0.75 附子 MOL002401 43.10 0.85 败酱草 MOL000359 36.91 0.75 附子 MOL002406 39.43 0.38 败酱草 MOL000422 41.88 0.24 附子 MOL002410 34.06 0.53 败酱草 MOL000006 36.16 0.25 附子 MOL002415 51.87 0.66 败酱草 MOL000098 46.43 0.28 附子 MOL002416 30.96 0.24 败酱草、薏苡仁 MOL000449 43.83 0.76 3.3 活性成分与作用靶点网络图
将败酱散调控靶点与CD差异基因以及OS相关基因取交集,共有14个基因,得到图 1A及交集数据,将交集数据以及药物成分与靶点关系导入Cytoscape软件,绘制调控网络图 1B, 包含30个节点、39条边,其中潜在基因靶点14个,对应的有效成分16个。对应靶点较多的败酱草的活性成分槲皮素对应11个靶点,其次是山奈酚对应6个靶点; 对应活性成分较多的靶点是前列腺素内过氧化物合成酶2(PTGS2, 对应16个活性成分),细胞间黏附分子-1(ICAM1)、一氧化氮合酶2(NOS2)和基质金属蛋白酶1(MMP1)分别对应3个活性成分,可能为败酱散调控OS缓解CD的重要靶点。
3.4 PPI网络与核心靶点
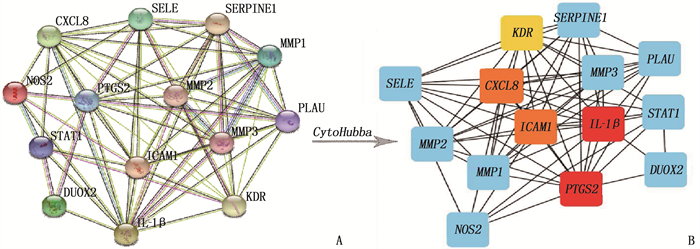
将14个共同靶点基因导入String数据库,设置置信度≥0.4, 并剔除独立于网络以外的靶点可得到图 2A, 获取PPI相关信息,利用Cytoscape软件对PPI信息进行可视化,并使用Cytohubba插件筛选排名前5的核心基因,见图 2B、表 3。
表 3 MCC得分前5位基因列表排名 基因 MCC得分/分 1 IL-1β 726 126 1 PTGS2 726 126 3 CXCL8 726 120 3 ICAM1 726 120 5 KDR 725 880 IL-1β: 白细胞介素-1β;
PTGS2: 前列腺素内过氧化物合成酶2;
CXCL8: CXC趋化因子配体8; ICAM1: 细胞间黏附分子-1;
KDR: 血管内皮细胞生长因子受体。3.5 富集分析
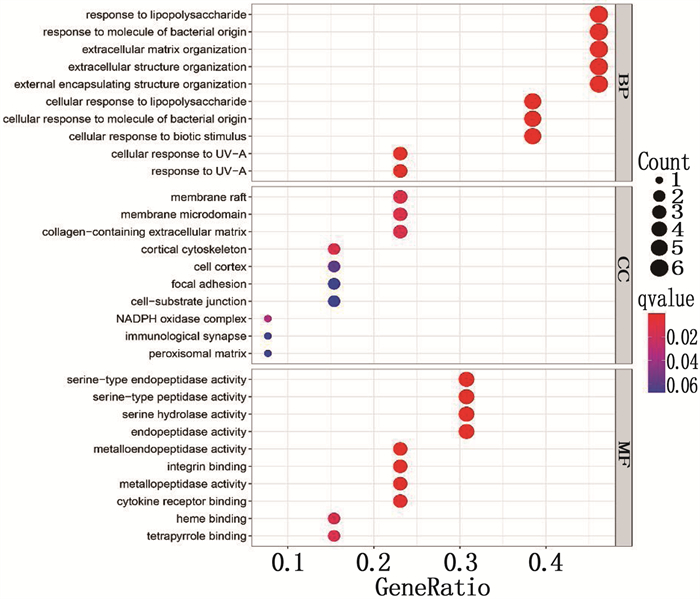
使用R软件对作用靶点基因进行GO富集分析得到图 3。结果显著富集于调控脂多糖(response to lipopolysaccharide)、调控细菌起源的分子(response to molecule of bacterialorigin)、细胞外间质组织(extracellular matrix organization)、细胞外结构组织(extracellular structure organization)等生物过程; 薄膜筏(membrane raft)、膜微区(membrane microdomain)等细胞组成; 丝氨酸型内肽酶活性(serine type endopeptidase activity)等分子功能。
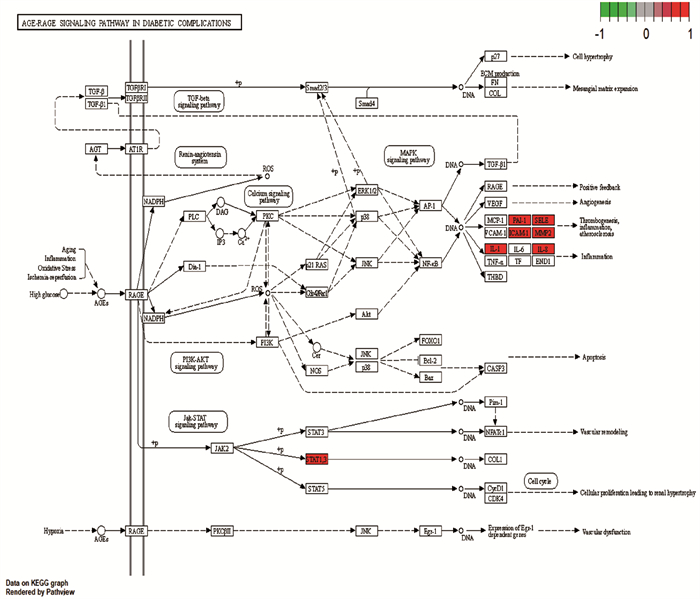
使用R软件进行KEGG富集分析,共富集到35条通路关系,排第1的晚期糖基化终产物及其受体(AGE-RAGE)信号通路图见图 4, 该信号通路内含有丝裂原活化蛋白激酶(MAKP)、磷脂酰肌醇3′-激酶(PI3K-AKT)等信号通路,且涉及OS反应,可能是败酱散调控OS缓解CD的重要通路。对应靶点数大于5的通路见表 4。
表 4 KEGG分析对应靶点数大于5的通路ID 条目 基因 基因数/个 hsa04933 糖尿病并发症中的晚期糖基化终产物及其受体 STAT1/ICAM1/SELE/MMP2/IL-1β/CXCL8/ERPINE1 7 hsa05417 脂质与动脉粥样硬化 MMP1/ICAM1/SELE/MMP3/IL-1β/CXCL8 6 hsa05323 类风湿性关节炎 MMP1/ICAM1/MMP3/IL-1β/CXCL8 5 hsa04657 白细胞介素-17信号通路 PTGS2/MMP1/MMP3/IL-1β/CXCL8 5 hsa04064 核因子κB信号通路 PTGS2/ICAM1/PLAU/IL1β/CXCL8 5 hsa04668 肿瘤坏死因子信号通路 PTGS2/ICAM1/SELE/MMP3/IL-1β 5 hsa05418 流体剪切应力与动脉粥样硬化 KDR/ICAM1/SELE/MMP2/IL-1β 5 hsa05171 新型冠状病毒肺炎 MMP1/STAT1/MMP3/IL-1β/CXCL8 5 STAT1: 转导与转录激活子; ICAM1: 细胞间黏附分子-1; SELE: E-选择素; MMP2: 基质金属蛋白酶2; IL-1β: 白细胞介素-1β;
CXCL8: CXC趋化因子配体8; MMP1: 基质金属蛋白酶1; MMP3: 基质金属蛋白酶3; PTGS2: 前列腺素内过氧化物合成酶2;
KDR: 血管内皮细胞生长因子受体。3.6 miRNA-TF-mRNA调控网络
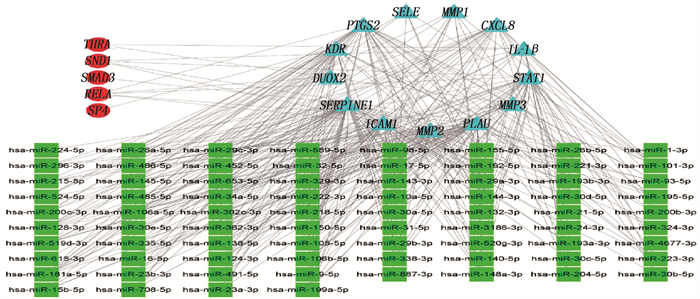
Mirtarbase数据库中预测出486个miRNA, Starbase数据库预测出185个miRNA, Targetscan数据库预测出4 679个miRNA, 3个数据库预测共有76个miRNA。Enrichr数据库中筛选出转录因子(TF)共5个,分别是甲状腺素受体(THRA)、含葡萄球菌核酸酶域1(SND1)、转录因子Sp4(SP4)、母亲DPP同源物3(果蝇)SMAD(SMAD3)、v-rel网状内皮细胞过多症病毒癌基因同源物A, B细胞κ轻肽基因增强子核因子3, p65(鸟类, RELA), 这些miRNA、TF参与调控的通路可能与败酱散调控OS缓解CD有关。miRNA-TF-mRNA调控网络见图 5, 有93个节点, 343个边。红色圆形代表预测的TF, 蓝色三角形是共同靶点基因,绿色正方形是miRNA。
4. 讨论
目前, CD的病因、病机尚未明确,可能与遗传因素、机体免疫功能、神经-体液调节功能、生活习惯及环境因素、肠道微生物等[12]相关。研究[13]发现,溃疡的发生发展与OS密切相关, CD常伴有溃疡。OS在CD发病机制中的关键作用已得到广泛认可,但具体机制仍未阐明。
OS的发生与抗氧化能力和自由基即活性氧(ROS)、活性氮(RNS)及其他未配对电子的分子平衡有关,过量自由基会导致氧化负荷与抗氧化能力失衡[14]发生OS; 同时OS可导致中性粒细胞炎性浸润,蛋白酶分泌增加,产生大量ROS。ROS一方面能参与细胞稳态; 另一方面除了对细胞产生直接损害,还可与DNA、脂质、氨基酸、细胞发生反应导致衰老、疾病和细胞死亡[15]。研究表明, CD中OS的发生与自由基、各种参与OS的酶、环境因素有关。
败酱散活性成分中的槲皮素具有抗自由基、抗氧化、抗菌抗炎、免疫调节等功能,研究[16]表明其可增强抗氧化酶活性,减少自由基生成,从而抑制OS发生。槲皮素可作用于AKT-PKB-mTOR、Nrf2-ARE[17-18]等多种信号通路,参与OS发生。山奈酚是一种众所周知的抗氧化剂,能通过激活腺苷酸活化蛋白激酶/烟酰胺腺嘌呤二核苷酸磷酸氧化酶4(AMPK/NOX4)等信号通路,抑制细胞增殖、ROS产生、NOX4等表达[19]缓解OS。
蛋白互作网络筛选出的核心基因有IL-1β、PTGS2、CXCL8、ICAM1、KDR。研究[20]表明, IL-1β能激发OS, 致使多种细胞衰老, CD中IL-1β表达升高,下调其表达能促进结肠炎性损伤的恢复[21]。PTGS2也被称为环氧化酶-2(COX-2), 是CD活动期关键基因[22]。研究[23]发现,肿瘤坏死因子-α(TNF-α)通过调节p38丝裂原活化蛋白激酶(P38-MAPK)通路产生PTGS2和热休克蛋白27(Hsp27), 刺激结肠肌成纤维细胞迁移,致使CD发生。CXCL8在CD患者中高表达,且与疾病活动相关[24], 未受刺激的细胞中几乎难以检测到CXCL8, 其表达可受包括ROS在内的多种因素的刺激调控[25]。ICAM1属于黏附分子免疫球蛋白超家族,参与机体免疫功能、炎症反应等的调控,其表达量在CD发病中显著升高[26], OS可快速激活MAPK通路,刺激ICAM1转录[27]。KDR是血管上皮因子受体,与血管内皮生长因子(VEGF)结合后,可介导内皮细胞增殖,促进血管生成[28], 减轻炎症反应及OS反应。
富集分析中涉及AGE-RAGE、核因子κB(NF-κB)、肿瘤坏死因子(TNF)等信号通路。研究[29]发现AGE-RAGE信号通路激活在CD的局部炎症级联反应中起重要作用。激活该通路可以提高烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶活性,促进ROS产生,使OS过度激活,经级联反应诱导细胞凋亡、变性坏死,加重微血管病变[30]。NF-κB通路对细胞自噬有抑制作用,研究[31]发现抑制NF-κB通路表达,能激活CD模型小鼠结肠自噬表达。同时NF-κB是氧化应激时细胞内的靶点,参与氧化还原调节, CD患者体内产生的大量自由基,除了直接损伤肠黏膜屏障外,还可激活NF-κB通路,导致肠道发生炎性反应[32]。在CD炎症过程早期, TNF-α即可被检测到[33]。抗TNF-α治疗是治疗CD的手段之一,该方案对重度和具有2种及以上不良预后危险因素的CD患者有较好疗效[34], 这与抗TNF-α疗法可减轻CD患者的氧化应激有关。在CD中有表达差异的miRNA可作为诊断生物标志物。本研究预测的76个miRNA中, miR-145-5p被证实通过抑制性别决定区域Y(SRY)相关的高迁移率族框9(SOX9)表达和恢复靠停蛋白8(CLDN8)表达来缓解三硝基苯磺酸9(NBS)诱导CD小鼠结肠炎症[35]。OS能通过NF-κB信号通路诱导miR-122的DNA甲基化,促进CD的进展[36]。
本研究结合OS相关差异基因,探讨OS缓解CD相关机制。本研究采用生物信息学分析发现败酱散调控OS可能与IL-1β、PTGS2、CXCL8、ICAM1、KDR等靶点有关,涉及通路主要为AGE-RAGE、NF-κB、TNF信号通路等,同时还预测了相关miRNA以及TF。但本研究以预测为主,其准确性还有待进一步进行体内外实验探讨。
-
表 1 数据集信息表
数据集 平台 正常组∶CD组 差异基因 上调基因 下调基因 GSE36807 GPL570 7∶13 135 40 GSE59071 GPL6244 11∶8 GSE102133 GPL6244 12∶65 表 2 药物有效成分
药物 Mol ID 口服利用度/% 类药性 药物 Mol ID 口服利用度/% 类药性 薏苡仁 MOL008121 34.23 0.29 附子 MOL002419 82.54 0.21 薏苡仁 MOL008118 32.40 0.43 附子 MOL002421 84.08 0.25 薏苡仁 MOL002882 34.13 0.30 附子 MOL002422 50.82 0.73 薏苡仁 MOL002372 33.55 0.42 附子 MOL002423 33.41 0.19 薏苡仁 MOL001494 42.00 0.19 附子 MOL002433 41.52 0.22 薏苡仁 MOL001323 43.28 0.78 附子 MOL002434 38.16 0.80 薏苡仁 MOL000953 37.87 0.68 附子 MOL000359 36.91 0.75 薏苡仁 MOL000359 36.91 0.75 附子 MOL000538 31.39 0.26 附子 MOL002211 39.99 0.20 败酱草 MOL001676 33.96 0.22 附子 MOL002388 57.76 0.28 败酱草 MOL001677 58.02 0.52 附子 MOL002392 46.69 0.37 败酱草 MOL001678 39.94 0.41 附子 MOL002393 34.52 0.18 败酱草 MOL001790 39.84 0.71 附子 MOL002394 34.52 0.18 败酱草 MOL001689 34.97 0.24 附子 MOL002395 56.30 0.31 败酱草 MOL002322 31.29 0.72 附子 MOL002397 51.73 0.73 败酱草 MOL001697 63.39 0.53 附子 MOL002398 69.56 0.34 败酱草 MOL000358 36.91 0.75 附子 MOL002401 43.10 0.85 败酱草 MOL000359 36.91 0.75 附子 MOL002406 39.43 0.38 败酱草 MOL000422 41.88 0.24 附子 MOL002410 34.06 0.53 败酱草 MOL000006 36.16 0.25 附子 MOL002415 51.87 0.66 败酱草 MOL000098 46.43 0.28 附子 MOL002416 30.96 0.24 败酱草、薏苡仁 MOL000449 43.83 0.76 表 3 MCC得分前5位基因列表
排名 基因 MCC得分/分 1 IL-1β 726 126 1 PTGS2 726 126 3 CXCL8 726 120 3 ICAM1 726 120 5 KDR 725 880 IL-1β: 白细胞介素-1β;
PTGS2: 前列腺素内过氧化物合成酶2;
CXCL8: CXC趋化因子配体8; ICAM1: 细胞间黏附分子-1;
KDR: 血管内皮细胞生长因子受体。表 4 KEGG分析对应靶点数大于5的通路
ID 条目 基因 基因数/个 hsa04933 糖尿病并发症中的晚期糖基化终产物及其受体 STAT1/ICAM1/SELE/MMP2/IL-1β/CXCL8/ERPINE1 7 hsa05417 脂质与动脉粥样硬化 MMP1/ICAM1/SELE/MMP3/IL-1β/CXCL8 6 hsa05323 类风湿性关节炎 MMP1/ICAM1/MMP3/IL-1β/CXCL8 5 hsa04657 白细胞介素-17信号通路 PTGS2/MMP1/MMP3/IL-1β/CXCL8 5 hsa04064 核因子κB信号通路 PTGS2/ICAM1/PLAU/IL1β/CXCL8 5 hsa04668 肿瘤坏死因子信号通路 PTGS2/ICAM1/SELE/MMP3/IL-1β 5 hsa05418 流体剪切应力与动脉粥样硬化 KDR/ICAM1/SELE/MMP2/IL-1β 5 hsa05171 新型冠状病毒肺炎 MMP1/STAT1/MMP3/IL-1β/CXCL8 5 STAT1: 转导与转录激活子; ICAM1: 细胞间黏附分子-1; SELE: E-选择素; MMP2: 基质金属蛋白酶2; IL-1β: 白细胞介素-1β;
CXCL8: CXC趋化因子配体8; MMP1: 基质金属蛋白酶1; MMP3: 基质金属蛋白酶3; PTGS2: 前列腺素内过氧化物合成酶2;
KDR: 血管内皮细胞生长因子受体。 -
[1] FEUERSTEIN J D, CHEIFETZ A S. Crohn disease: epidemiology, diagnosis, and management[J]. Mayo Clin Proc, 2017, 92(7): 1088-1103. doi: 10.1016/j.mayocp.2017.04.010
[2] PARKER C E, NGUYEN T M, SEGAL D, et al. Low dose naltrexone for induction of remission in Crohn's disease[J]. Cochrane Database Syst Rev, 2018, 4(4): CD010410.
[3] 汪燕燕, 戴钰洁, 胡乃中, 等. 英夫利西单抗治疗克罗恩病的临床评价[J]. 中国新药与临床杂志, 2021, 40(11): 756-759. https://www.cnki.com.cn/Article/CJFDTOTAL-XYYL202111006.htm [4] 柴常伟, 张翼翔, 张海婧, 等. 治疗炎症性肠道疾病的新兴靶点与药物[J]. 药学学报, 2022, 57(5): 1282-1288. https://www.cnki.com.cn/Article/CJFDTOTAL-YXXB202205007.htm [5] 曾耀明, 汪洋鹏, 柯晓. 基于藏象学说论治炎症性肠病的理论探讨[J]. 中华中医药学刊, 2018, 36(10): 2375-2377. https://www.cnki.com.cn/Article/CJFDTOTAL-ZYHS201810019.htm [6] 张锁, 陈晶. 薏苡附子败酱散加味临床应用探析[J]. 中华中医药杂志, 2021, 36(1): 263-266. https://www.cnki.com.cn/Article/CJFDTOTAL-BXYY202101068.htm [7] 柴妮, 朱惠蓉, 叶进. 薏苡附子败酱散的文献分析及研究评述[J]. 时珍国医国药, 2020, 31(4): 1001-1004. doi: 10.3969/j.issn.1008-0805.2020.04.073 [8] 宋厚盼, 刘恒铭, 仇婧玥, 等. 胃癌发病关键基因调控网络构建及其靶向治疗中药活性成分筛选研究[J]. 中草药, 2021, 52(22): 6939-6952. doi: 10.7501/j.issn.0253-2670.2021.22.020 [9] CHOU C H, SHRESTHA S, YANG C D, et al. miRTarBase update 2018: a resource for experimentally validated microRNA-target interactions[J]. Nucleic Acids Res, 2018, 46(D1): D296-D302. doi: 10.1093/nar/gkx1067
[10] YANG J H, LI J H, SHAO P, et al. starBase: a database for exploring microRNA-mRNA interaction maps from Argonaute CLIP-Seq and Degradome-Seq data[J]. Nucleic Acids Res, 2011, 39(Database issue): D202-D209.
[11] AGARWAL V, BELL G W, NAM J W, et al. Predicting effective microRNA target sites in mammalian mRNAs[J]. eLife, 2015, 4: e05005. doi: 10.7554/eLife.05005
[12] KHANNA S, RAFFALS L E. The microbiome in Crohn's disease: role in pathogenesis and role of microbiome replacement therapies[J]. Gastroenterol Clin North Am, 2017, 46(3): 481-492. doi: 10.1016/j.gtc.2017.05.004
[13] 李红, 杨龙宝, 赵刚, 等. 质子泵抑制剂联合雷尼替丁对消化性溃疡的治疗效果及对谷胱甘肽过氧化物酶、脂质过氧化物水平的影响[J]. 实用临床医药杂志, 2021, 25(21): 21-24. doi: 10.7619/jcmp.20212263 [14] 薛华, 魏胜全, 王智杰, 等. 慢性阻塞性肺疾病稳定期患者肺功能、营养状况及氧化应激能力分析[J]. 实用临床医药杂志, 2019, 23(9): 65-68. doi: 10.7619/jcmp.201909019 [15] 陈丽霏, 张世倡, 肖林, 等. 炎症性肠病中活性氧及抗氧化的研究进展[J]. 中国当代医药, 2020, 27(9): 24-27. doi: 10.3969/j.issn.1674-4721.2020.09.008 [16] 王叶情, 王宇红, 邹蔓姝, 等. 槲皮素及其糖苷衍生物抗抑郁作用及其机制的研究进展[J]. 中草药, 2022, 53(5): 1548-1557. https://www.cnki.com.cn/Article/CJFDTOTAL-ZCYO202205030.htm [17] 李泳欣. Nrf2-ARE信号通路抵御小鼠乳腺氧化应激的分子机制及槲皮素对其调控研究[D]. 杭州: 浙江大学, 2021. [18] 吴柳, 蒋永艳, 刘微, 等. 槲皮素通过PI3K/AKT/mTOR通路减轻脓毒症小鼠心肌损伤[J]. 中国急救医学, 2021, 41(3): 238-243. doi: 10.3969/j.issn.1002-1949.2021.03.011 [19] 玄露露, 李彦秋, 王怀杰, 等. 山奈酚调控AMPK/NOX4通路抑制高糖诱导的肾小球系膜细胞氧化应激和胞外基质积聚[J]. 天然产物研究与开发, 2021, 33(7): 1102-1111. https://www.cnki.com.cn/Article/CJFDTOTAL-TRCW202107004.htm [20] 徐伟, 廖冬发, 吴畏, 等. IL-1β通过诱导氧化应激促进软骨表层细胞衰老[J]. 免疫学杂志, 2022, 38(2): 164-169. doi: 10.3760/cma.j.issn.1673-4394.2022.02.009 [21] 张霁, 吴丽洁, 李志元, 等. 隔药灸对克罗恩病大鼠结肠NLRP3炎症小体及IL-1β调节作用的实验研究[J]. 上海针灸杂志, 2019, 38(2): 119-126. https://www.cnki.com.cn/Article/CJFDTOTAL-SHZJ201902001.htm [22] 陈洁玲, 沈杰, 刘国正. "益气解毒化瘀方"联合常规西药治疗溃疡性结肠炎30例临床研究[J]. 江苏中医药, 2021, 53(3): 34-37. https://www.cnki.com.cn/Article/CJFDTOTAL-JSZY202103016.htm [23] SAINI S, LIU T G, YOO J. TNF-α stimulates colonic myofibroblast migration via COX-2 and Hsp27[J]. J Surg Res, 2016, 204(1): 145-152. doi: 10.1016/j.jss.2016.04.034
[24] 刘迎春, 梅红, 高源, 等. 儿童克罗恩病差异表达基因的生物信息学分析[J]. 中国现代应用药学, 2020, 37(17): 2148-2152. https://www.cnki.com.cn/Article/CJFDTOTAL-XDYD202017019.htm [25] 高书华, 柴欣悦, 刘杭丰, 等. CXC趋化因子配体8促进结直肠癌微环境中M2型巨噬细胞趋化及浸润[J]. 中国生物化学与分子生物学报, 2022, 38(4): 495-504. https://www.cnki.com.cn/Article/CJFDTOTAL-SWHZ202204012.htm [26] YARUR A J, JAIN A, QUINTERO M A, et al. Inflammatory cytokine profile in Crohn's disease nonresponders to optimal antitumor necrosis factor therapy[J]. J Clin Gastroenterol, 2019, 53(3): 210-215. doi: 10.1097/MCG.0000000000001002
[27] 闫文生, 姜勇, 赵克森. ICAM-1基因表达的调节[J]. 国外医学: 生理、病理科学与临床分册, 2001, 21(5): 397-399. https://www.cnki.com.cn/Article/CJFDTOTAL-WYSB200105027.htm [28] WU H B, YANG S, WENG H Y, et al. Autophagy-induced KDR/VEGFR-2 activation promotes the formation of vasculogenic mimicry by glioma stem cells[J]. Autophagy, 2017, 13(9): 1528-1542. doi: 10.1080/15548627.2017.1336277
[29] SNELSON M, LUCUT E, COUGHLAN M T. The role of AGE-RAGE signalling as a modulator of gut permeability in diabetes[J]. Int J Mol Sci, 2022, 23(3): 1766. doi: 10.3390/ijms23031766
[30] 许笑雯, 储全根, 储俊, 等. 痰瘀同治法对糖尿病大鼠心肌微血管病变AGEs/RAGE轴及氧化应激的影响[J]. 南方医科大学学报, 2021, 41(10): 1527-1533. doi: 10.12122/j.issn.1673-4254.2021.10.11 [31] 张丹. 黄蜀葵花总黄酮通过NF-κB信号通路调控自噬治疗克罗恩病的作用机制研究[D]. 南京: 南京中医药大学, 2019. [32] 聂君书, 胡惠洁, 徐晶, 等. NF-κB在动物应激调控中的作用及机制研究进展[J]. 中国兽医学报, 2021, 41(9): 1874-1878. https://www.cnki.com.cn/Article/CJFDTOTAL-ZSYX202109033.htm [33] ADEGBOLA S O, SAHNAN K, WARUSAVITARNE J, et al. Anti-TNF therapy in Crohn's disease[J]. Int J Mol Sci, 2018, 19(8): 2244. doi: 10.3390/ijms19082244
[34] 李青霞. 抗TNF-α制剂降阶梯治疗克罗恩病的疗效与安全性的Meta分析[D]. 太原: 山西医科大学, 2021. [35] ZHUANG X J, CHEN B L, HUANG S S, et al. Hypermethylation of miR-145 promoter-mediated SOX9-CLDN8 pathway regulates intestinal mucosal barrier in Crohn's disease[J]. EBioMedicine, 2022, 76: 103846. doi: 10.1016/j.ebiom.2022.103846
[36] BAI J N, YU J C, WANG J T, et al. DNA methylation of miR-122 aggravates oxidative stress in colitis targeting SELENBP1 partially by p65NF-κ B signaling[J]. Oxid Med Cell Longev, 2019, 2019: 5294105.
-
期刊类型引用(0)
其他类型引用(1)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号