Establishment of prediction model of deep venous thrombosis formation of lower extremity after general surgery
-
摘要:目的
探讨血栓弹力图(TEG)与常规凝血指标预测普通外科术后下肢深静脉血栓(DVT)形成的价值,并建立预测模型。
方法选取2018年1月—2021年1月普通外科手术患者272例为研究对象,根据术后多普勒超声结果将其分为DVT组249例与非DVT组23例。比较2组凝血酶原时间(PT)、活化部分凝血酶原时间(APTT)、凝血酶时间(TT)、纤维蛋白原(Fib)、D-二聚体以及凝血反应时间(R)、血液凝固时间(K)、凝固角(α角)、血栓最大振幅(MA)。筛选血栓相关因素,采用Logistic回归分析建立预测模型。
结果DVT组患者年龄大于非DVT组,差异有统计学意义(P < 0.05); DVT组手术时间长于非DVT组,差异有统计学意义(P < 0.05)。DVT组术前D-二聚体水平高于非DVT组,差异有统计学意义(P < 0.05); DVT组术前PT、APTT、TT短于非DVT组,差异有统计学意义(P < 0.05)。DVT组术前K、α角、MA长于或大于非DVT组,差异有统计学意义(P < 0.05); DVT组术前R短于非DVT组,差异有统计学意义(P < 0.05)。术前α角、MA、K、D-二聚体、PT对DVT发生具有中等预测价值[曲线下面积(AUC)为0.7~0.9]。将年龄、手术时间、PT、APTT、TT、D-二聚体、R、α角(K因与α角含义类似而未纳入)、MA共9个术前变量纳入二元Logistic回归分析,获得手术后血栓的预测模型。该模型受试者工作特征(ROC)曲线的AUC为0.964(95%CI: 0.934~0.983, P < 0.05)。当约登指数最大时,其所对应的最佳分界值(cut-off值)为0.174, 灵敏度为91.30%, 特异度为95.18%。
结论综合年龄、手术时间、PT、APTT、TT、D-二聚体以及TEG中R、α角、MA共9个术前变量建立的预测模型能较好地筛查出DVT高危患者。
Abstract:ObjectiveTo investigate the value of thrombelastography (TEG) and conventional coagulation indexes in predicting the formation of deep vein thrombosis (DVT) of lower extremities after general surgery, and to establish a prediction model.
MethodsA total of 272 patients undergoing general surgery from January 2018 to January 2021 were selected as research objects. According to the postoperative Doppler ultrasound results, they were divided into DVT group (249 cases) and non-DVT group (23 cases). The prothrombin time (PT), activated partial prothrombin time (APTT), thrombin time (TT), fibrinogen (Fib), D-dimer, coagulation reaction time (R), blood clotting time (K), α-angle and maximum amplitude (MA) were compared between the two groups. The factors related to thrombosis were screened, and Logistic regression analysis was used to establish a prediction model.
ResultsThe age of patients in the DVT group was significantly higher than that in the non-DVT group (P < 0.05); the operation time of the DVT group was significantly longer than that of the non-DVT group (P < 0.05). The level of D-dimer in the DVT group was significantly higher than that in the non-DVT group (P < 0.05); the preoperative PT, APTT and TT of the DVT group were significantly shorter than those of the non-DVT group (P < 0.05). The preoperative K, α-angle and MA of the DVT group were significantly longer or greater than those of the non-DVT group (P < 0.05); the preoperative R of the DVT group was significantly shorter than that of the non-DVT group (P < 0.05). Preoperative α-angle, MA, K, D-dimer and PT had moderate predictive value for DVT[area under the curve (AUC) was 0.7 to 0.9]. Nine preoperative variables including age, operation time, PT, APTT, TT, D-dimer, R, α-angle (K was not included because of the similar meaning of with α-angle) and MA were included in binary Logistic regression analysis to obtain the prediction model of postoperative thrombosis. The AUC of receiver operating characteristic (ROC) curve of the model was 0.964 (95%CI, 0.934 to 0.983, P < 0.05). When the Youden index was the maximum, the corresponding optimal cut-off value was 0.174, the sensitivity was 91.30%, and the specificity was 95.18%.
ConclusionThe prediction model based on 9 preoperative variables including age, operation time, PT, APTT, TT, D-dimer as well as R, α-angle and MA in TEG can better screen high-risk patients with DVT.
-
Keywords:
- deep vein thrombosis /
- thrombelastography /
- coagulation indicator /
- predictive model
-
下肢深静脉血栓(DVT)是一种血液循环障碍性疾病,下肢栓子脱落会进一步引起肺栓塞,导致严重的呼吸循环障碍[1]。欧美国家普通外科患者无预防措施下,术后DVT发生率为10%~40%, 术后肺栓塞(PE)发生率为0.2%~0.9%[2]。DVT的形成和发展不仅可加重病情,甚至可能危及患者的生命[3]。目前,临床上缺少操作简单、灵敏度高和特异度高的血栓评估方法[4]。本研究回顾性分析蚌埠医学院附属泰兴医院普通外科手术患者的临床资料,筛选出术后DVT预测的相关指标,并建立了DVT预测模型,现报告如下。
1. 资料与方法
1.1 一般资料
选取2018年1月—2021年1月普通外科手术患者272例为研究对象,根据术后多普勒超声结果分为DVT组249例与非DVT组23例。纳入标准: ①术前所有检查结果明确有手术指征者; ②在本院接受手术治疗者; ③ 20岁以上者; ④术前DVT阴性者; ⑤病例资料齐全者。排除标准: ①有急性脑梗死、心肌梗死等疾病者; ②既往有血液制品输注史或凝血功能障碍、易栓症家族病史者; ③孕妇或长期服用口服避孕药和性激素类药物,停药时间少于90 d者; ④术前下肢彩色多普勒超声检查显示DVT者。本研究已获得蚌埠医学院附属泰兴医院伦理委员会批准,所有患者及其家属均签署知情同意书。
1.2 方法
所有入院患者均按照普通外科疾病诊疗规范进行医治,详细制订患者的手术方案,由同一批外科医师进行手术,根据常规操作程序及临床经验,对患者进行预防性抗凝治疗。入院第2天早晨,取患者空腹静脉血5 mL, 采用日本Sysmex公司生产的CA-7000全自动血凝检测仪,检测凝血酶原时间(PT)、活化部分凝血酶原时间(APTT)、凝血酶时间(TT)、纤维蛋白原(Fib)、D-二聚体等常规凝血指标。使用血栓弹力图(TEG)分析仪5000 (美国, Braintree, Massachusetts)对所有患者进行全血测试,记录TEG的凝血反应时间(R)、凝固角(α角)、血栓最大振幅(MA)和血液凝固时间(K)。术后行彩色多普勒超声诊断,对患者下肢静脉进行检测,并将其分为DVT组和非DVT组。
1.3 统计学分析
采用SPSS 24.0软件分析数据。符合正态分布的计量资料采用(x±s)表示,方差齐行t检验,方差不齐采用近似t检验; 计数资料采用[n(%)]表示,行卡方检验。将单因素分析中具有统计学意义的指标纳入Logistic回归,建立血栓的预测模型: P预测概率=$=\frac{exp ({Logit}\;P)}{1+exp ({Logit}\;P)}$。根据每位手术患者得到的P预测概率与血栓事件的关系建立受试者工作特征(ROC)曲线,运用R version 4.1.0绘制受试者ROC曲线,运用MedCalc 20.0软件计算曲线下面积(AUC)、最佳阈值(约登指数最大时所对应的分界点为最佳阈值)、灵敏度、特异度和约登指数。AUC>0.9提示预测价值较高, AUC>0.7~0.9提示预测价值中等, AUC>0.5~0.7提示预测价值较低。P < 0.05为差异有统计学意义。
2. 结果
2.1 2组患者基线资料比较
2组患者性别、体质量指数(BMI)及高血压、糖尿病、饮酒、吸烟情况比较,差异无统计学意义(P>0.05)。DVT组患者年龄大于非DVT组,差异有统计学意义(P < 0.05); DVT组手术时间长于非DVT组,差异有统计学意义(P < 0.05), 见表 1。
表 1 2组患者治疗前基线资料比较(x±s)[n(%)]指标 非DVT组(n=249) DVT组(n=23) χ2/t P 年龄/岁 62.86±13.93 71.74±12.12 2.952 0.003 男性 139(55.82) 11(47.83) 0.544 0.461 体质量指数/(kg/m2) 23.76±3.10 24.01±2.46 0.380 0.705 手术时间 < 1 h 145(58.23) 5(21.74) 12.182 0.002 1~2 h 50(20.08) 7(30.43) >2 h 54(21.69) 11(47.83) 高血压 61(24.50) 7(30.43) 0.396 0.529 糖尿病 23(9.24) 2(8.70) 0.007 0.931 吸烟 99(39.76) 7(30.43) 0.770 0.380 饮酒 74(29.72) 5(21.74) 0.651 0.420 2.2 术前传统凝血功能试验(CCTs)参数比较
DVT组术前D-二聚体水平高于非DVT组,差异有统计学意义(P < 0.05); DVT组术前PT、APTT、TT短于非DVT组,差异有统计学意义(P < 0.05)。2组Fib比较,差异无统计学意义(P>0.05)。见表 2。
表 2 2组患者术前CCTs参数比较(x±s)参数 非DVT组(n=249) DVT组(n=23) χ2/t P PT/s 12.55±1.29 11.26±0.74 7.382 < 0.001 Fib/(g/L) 3.54±1.10 3.69±0.54 1.081 0.286 APTT/s 35.50±1.82 33.95±2.40 3.016 0.006 TT/s 15.80±1.46 15.00±1.78 2.458 0.015 D-二聚体/(μg/L) 475.98±436.59 974.61±529.97 5.142 < 0.001 PT: 凝血酶原时间; Fib: 纤维蛋白原; APTT: 活化部分凝血活酶原时间; TT: 凝血酶时间。 2.3 术前TEG指标比较
DVT组术前K、α角、MA长于或大于非DVT组,差异有统计学意义(P < 0.05); DVT组术前R短于非DVT组,差异有统计学意义(P < 0.05)。见表 3。
表 3 2组患者术前TEG指标比较(x±s)指标 非DVT组(n=249) DVT组(n=23) χ2/t P R/min 4.90±1.28 4.17±1.60 2.135 0.043 K/min 3.25±0.55 3.96±0.50 5.987 < 0.001 α角/° 66.00±6.25 75.10±4.89 6.793 < 0.001 MA/mm 63.78±6.97 72.78±6.81 5.936 < 0.001 R: 凝血反应时间; K: 血液凝固时间; α角: 凝固角; MA: 最大振幅。 2.4 术前TEG和CCTs指标对术后血栓发生的预测价值
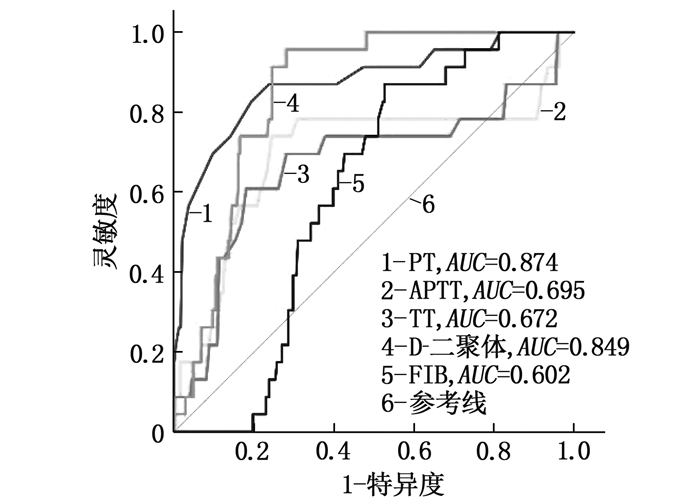
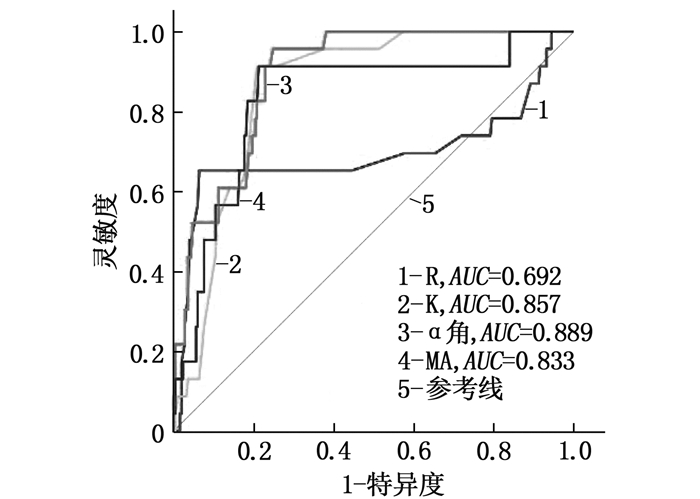
以患者术后是否发生下肢血栓作为诊断金标准,以术前TEG以及CCTs各项指标绘制ROC曲线,结果显示,术前K、α角、MA、PT以及D-二聚体对术后发生DVT具有中等预测价值(AUC为0.7~0.9), R、APTT、TT以及Fib对术后发生DVT的预测价值均较低(AUC < 0.7), 见图 1、图 2和表 4。
表 4 患者术前各指标对术后发生DVT的预测结果指标 AUC 最佳阈值 灵敏度/% 特异度/% 约登指数 R 0.692 3.6 65.22 93.57 0.587 9 K 0.857 3.5 91.30 79.12 0.704 2 α角 0.889 68.9 95.60 75.10 0.707 5 MA 0.833 68.8 91.30 78.71 0.700 2 PT 0.874 11.5 82.61 80.72 0.633 3 Fib 0.602 3.2 86.96 47.39 0.343 5 APTT 0.695 34.7 73.91 75.50 0.494 2 TT 0.672 14.5 60.87 81.93 0.428 0 D-二聚体 0.849 561.0 95.65 71.89 0.675 4 R: 凝血反应时间; K: 血液凝固时间; α角: 凝固角; MA: 最大振幅;
PT: 凝血酶原时间; Fib: 纤维蛋白原;
APTT: 活化部分凝血活酶原时间; TT: 凝血酶时间。2.5 基线资料、术前TEG、CCTs指标联合预测价值
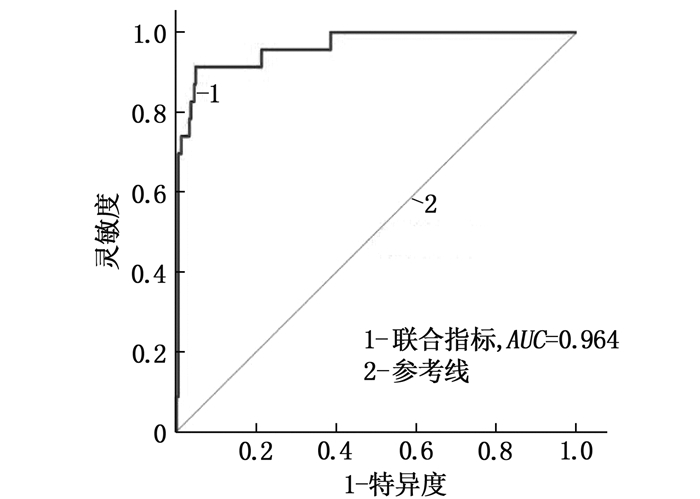
将年龄、手术时间、PT、APTT、TT、D-二聚体、R、α角(K因与α角含义类似而未纳入)、MA共9个术前变量纳入二元Logistic回归分析,获得手术后血栓的预测模型: P预测概率=$\frac{exp ( { Logit }\; P)}{1+exp ( { Logit } \;P)}$[Logit P=0.085×年龄+1.297×手术时间(B)+1.886×手术时间(C)-2.431×PT-0.093×APTT+0.332×TT +0.002×D-二聚体+0.06×R+0.138×α+0.113×MA-1.571], 根据每位手术患者(n=272)得到的P预测概率与血栓事件的关系建立ROC曲线(图 3), AUC为0.964(95%CI: 0.934~0.983, P < 0.05)。当约登指数最大时,其所对应的最佳分界值(cut-off值)为0.174, 灵敏度为91.30%, 特异度为95.18%。
3. 讨论
DVT在普通外科患者中并不少见,手术对患者来说是一种创伤性操作,再加上麻醉会使血管扩张,下肢肌肉会变得麻木,血管内血液流动缓慢, DVT的发生率随之增高。此外,大部分患者术后需卧床休息,甚至需要长期卧床,下肢运动量减少,血液循环缓慢,进而增大DVT的发病风险[5-6]。故临床需寻找早期DVT风险识别指标,并建立预测模型筛选出血栓高危患者,对其进行预防、治疗,以降低患者术后DVT发生率。
传统凝血试验只能检测凝血过程中的某一阶段,不能评估血凝块形成到纤维溶解的整个过程,也不能评估血小板在凝血过程中的作用[7]。新型的凝血检测技术TEG通过对凝血、抗凝、纤溶等动态过程进行物理方法模拟,从而得到更好的反映凝血状态的参数,并根据相应的参数绘制出曲线图,更加直观地反映出凝血的动态演变、凝血的速度、血凝块的硬度及纤溶系统的活力等[8]。
本研究发现普通外科患者术后DVT的发生率为8.46%, 大部分患者没有临床症状或者症状较轻。DVT组患者年龄大于非DVT组,提示老年患者可能更容易在术后发生DVT,因此临床工作中对此类患者实施抗凝治疗时应更加谨慎。研究[9-11]表明,长时间手术可造成患者血液瘀滞、血液高凝状态、血管内皮损伤,促使血栓发生,与本研究结果一致。本研究结果显示, DVT组术前K、α角、MA、D-二聚体显著长于或大于或高于非DVT组; 术前R、APTT、TT、PT显著短于非DVT组患者; K、α角、MA、D-二聚体和PT对术后DVT具有中等预测价值,其他指标预测价值较低。本研究利用Logistic回归分析建立血栓预测模型,并通过ROC曲线发现该模型AUC、灵敏度、特异度均大于90%, 说明其可用于筛选DVT高危患者。
综上所述,血栓预测模型的建立可帮助临床早期筛选识别DVT高危患者,并尽早干预。
-
表 1 2组患者治疗前基线资料比较(x±s)[n(%)]
指标 非DVT组(n=249) DVT组(n=23) χ2/t P 年龄/岁 62.86±13.93 71.74±12.12 2.952 0.003 男性 139(55.82) 11(47.83) 0.544 0.461 体质量指数/(kg/m2) 23.76±3.10 24.01±2.46 0.380 0.705 手术时间 < 1 h 145(58.23) 5(21.74) 12.182 0.002 1~2 h 50(20.08) 7(30.43) >2 h 54(21.69) 11(47.83) 高血压 61(24.50) 7(30.43) 0.396 0.529 糖尿病 23(9.24) 2(8.70) 0.007 0.931 吸烟 99(39.76) 7(30.43) 0.770 0.380 饮酒 74(29.72) 5(21.74) 0.651 0.420 表 2 2组患者术前CCTs参数比较(x±s)
参数 非DVT组(n=249) DVT组(n=23) χ2/t P PT/s 12.55±1.29 11.26±0.74 7.382 < 0.001 Fib/(g/L) 3.54±1.10 3.69±0.54 1.081 0.286 APTT/s 35.50±1.82 33.95±2.40 3.016 0.006 TT/s 15.80±1.46 15.00±1.78 2.458 0.015 D-二聚体/(μg/L) 475.98±436.59 974.61±529.97 5.142 < 0.001 PT: 凝血酶原时间; Fib: 纤维蛋白原; APTT: 活化部分凝血活酶原时间; TT: 凝血酶时间。 表 3 2组患者术前TEG指标比较(x±s)
指标 非DVT组(n=249) DVT组(n=23) χ2/t P R/min 4.90±1.28 4.17±1.60 2.135 0.043 K/min 3.25±0.55 3.96±0.50 5.987 < 0.001 α角/° 66.00±6.25 75.10±4.89 6.793 < 0.001 MA/mm 63.78±6.97 72.78±6.81 5.936 < 0.001 R: 凝血反应时间; K: 血液凝固时间; α角: 凝固角; MA: 最大振幅。 表 4 患者术前各指标对术后发生DVT的预测结果
指标 AUC 最佳阈值 灵敏度/% 特异度/% 约登指数 R 0.692 3.6 65.22 93.57 0.587 9 K 0.857 3.5 91.30 79.12 0.704 2 α角 0.889 68.9 95.60 75.10 0.707 5 MA 0.833 68.8 91.30 78.71 0.700 2 PT 0.874 11.5 82.61 80.72 0.633 3 Fib 0.602 3.2 86.96 47.39 0.343 5 APTT 0.695 34.7 73.91 75.50 0.494 2 TT 0.672 14.5 60.87 81.93 0.428 0 D-二聚体 0.849 561.0 95.65 71.89 0.675 4 R: 凝血反应时间; K: 血液凝固时间; α角: 凝固角; MA: 最大振幅;
PT: 凝血酶原时间; Fib: 纤维蛋白原;
APTT: 活化部分凝血活酶原时间; TT: 凝血酶时间。 -
[1] WINTER W E, FLAX S D, HARRIS N S. Coagulation testing in the core laboratory[J]. Lab Med, 2017, 48(4): 295-313. doi: 10.1093/labmed/lmx050
[2] GEERTS W H, BERGQVIST D, PINEO G F, et al. Prevention of venous thromboembolism: American college of chest physicians evidence-based clinical practice guidelines (8th edition)[J]. Chest, 2008, 133(6): 381S-453S. doi: 10.1378/chest.08-0656
[3] HOLLI HALSET J, HANSSEN S W, ESPINOSA A, et al. Tromboelastography: variability and relation to conventional coagulation test in non-bleeding intensive care unit patients[J]. BMC Anesthesiol, 2015, 15: 28. doi: 10.1186/s12871-015-0011-2
[4] HENKE P K. Adding thrombodynamic assessment to Caprini risk assessment to improve venous thromboembolism risk specificity[J]. J Vasc Surg Venous Lymphat Disord, 2020, 8(1): 42-43. doi: 10.1016/j.jvsv.2019.08.013
[5] 韩博, 任麦芳, 王湘辉, 等. 利伐沙班预防腹腔镜手术后深静脉血栓形成的效果观察[J]. 实用临床医药杂志, 2020, 24(24): 88-91. doi: 10.7619/jcmp.202024026 [6] LINKINS L A, TAKACH LAPNER S. Review of D-dimer testing: good, bad, and ugly[J]. Int J Lab Hematol, 2017, 39(Suppl 1): 98-103.
[7] KIRLIKAYA B, LANGRIDGE B, DAVIES A H, et al. Metabolomics as a tool to improve decision making for the vascular surgeon-wishful thinking or a dream come true?[J]. Vascul Pharmacol, 2019, 116: 1-3. doi: 10.1016/j.vph.2019.03.005
[8] 张翥, 范修才, 刘品刚, 等. 血栓弹力图分析抗血小板药物治疗的冠心病患者经皮冠状动脉介入后血液高凝状态和缺血事件的价值[J]. 实用临床医药杂志, 2021, 25(21): 43-46. doi: 10.7619/jcmp.20213934 [9] MOULDER J K, MOORE K J, STRASSLE P D, et al. Effect of length of surgery on the incidence of venous thromboembolism after benign hysterectomy[J]. Am J Obstet Gynecol, 2021, 224(4): 364. e1-364364. e7.
[10] MAJMUDAR K, QUINTERO L D, FUENTES H E, et al. Postoperative venous thromboembolism and mortality in patients with pancreatic surgery[J]. J Surg Oncol, 2019, 120(3): 494-500. doi: 10.1002/jso.25589
[11] MÜSSLE B, BUCK N, SCHADE S, et al. Impact of pulmonary embolism on morbidity and mortality in patients undergoing pancreatic surgery[J]. Langenbecks Arch Surg, 2021, 406(3): 893-902.




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号