Mechanism of Zhizi Dahuang Decoction for anti-liver injury based on network pharmacology
-
摘要:目的
基于网络药理学探讨栀子大黄汤防治肝损伤的潜在作用机制。
方法从数据库检索栀子大黄汤中每味药材所含的化学成分, 对化合物进行初筛; 获取栀子大黄汤的潜在作用靶点和肝损伤的治疗靶点,取交集后对成分-靶点的相互作用进行分析,构建蛋白-蛋白相互作用(PPI)网络,筛选关键靶点基因; 通过基因本体(GO)功能富集分析和京都基因与基因组百科全书(KEGG)信号通路富集分析确定栀子大黄汤治疗肝损伤的关键作用靶点与作用通路; 采用分子对接技术评估关键活性成分与关键靶点的结合活力。
结果栀子大黄汤中共有71种化合物为潜在活性成分; 341个疾病相关靶点与138个化合物靶点取交集,得到47个交集靶点,进一步筛选后得到栀子大黄汤治疗肝损伤的7个关键靶点基因,包括肿瘤坏死因子(TNF)、血红素加氧酶1(HMOX1)、白细胞介素-6(IL6)、丝裂原激活蛋白激酶8(MAPK8)、前列腺素内过氧化物合成酶2(PTGS2)、热休克蛋白90 Alpha家族A级成员1(HSP90AA1)和半胱天冬酶3(CASP3)。GO功能富集分析和KEGG信号通路富集分析结果显示,栀子大黄汤可降低肝脏脂质过氧化水平,提高抗氧化酶水平,从而发挥抗氧化应激作用,还可抑制TNF信号通路发挥抗炎作用。分子对接结果显示,栀子大黄汤中3种关键活性成分与关键蛋白(大黄素-TNF、芦荟大黄素-HSP90AA1、黄柏酮-CASP3)的结合活力非常高。
结论栀子大黄汤通过抑制氧化应激、炎症反应、肝细胞凋亡等途径发挥治疗肝损伤的效果。
Abstract:ObjectiveTo explore the potential mechanism of Zhizi Dahuang Decoction in the prevention and treatment of liver injury based on network pharmacology.
MethodsThe chemical constituents of each herb in Zhizi Dahuang Decoction were retrieved from the databases and then subjected to preliminary screening; the potential action targets of Zhizi Dahuang Decoction and the therapeutic targets for liver injury were collected. After taking the intersection, the composition-target interaction was analyzed, the protein-protein interaction (PPI) network was constructed, and the key target genes were screened. Gene ontology (GO) and Kyoto Encyclopedia of Genes and Genomes (KEGG) enrichment analysis were carried out to determine the key action targets and pathways of Zhizi Dahuang Decoction in the treatment of liver injury. Finally, the binding activity of key constituents to key targets was assessed by molecular docking.
ResultsA total of 71 phytochemical components were identified as potential active components from Zhizi Dahuang Decoction. A total of 47 intersection targets were generated after 341 disease-related targets were intersected with 138 compound targets. After further screening, seven key target genes of Zhizi Dahuang Decoction in the treatment of liver injury were obtained, including tumor necrosis factor (TNF), heme oxygenase-1 (HMOX1), interleukin-6 (IL6), mitogen-activated protein kinase 8 (MAPK8), prostaglandin intra peroxidase synthase 2 (PTGS2), and heat shock protein 90 alpha family class A member 1 (HSP90AA1) and Caspase 3 (CASP3). GO and KEGG pathway analysis showed that Zhizi Dahuang Decoction could reduce the level of lipid peroxidation in the liver and increase the level of antioxidant enzymes, thereby exerting an anti-oxidative stress effect; it could also play an anti-inflammatory effect by inhibiting the TNF signaling pathway. The molecular docking results showed that the three key active components in the Zhizi Dahuang Decoction had a very high binding activity to the key proteins(emodin-TNF, aloe emodin-HSP90AA1, obakunone-CASP3).
ConclusionZhizi Dahuang Decoction could exert its medicinal effect on liver injury by inhibiting oxidative stress, inflammatory response and hepatocyte apoptosis.
-
Keywords:
- Zhizi Dahuang Decoction /
- liver injury /
- mechanism /
- network pharmacology /
- molecular docking /
- targets
-
栀子大黄汤为汉代张仲景所著《金匮要略》中经典名方,由栀子、大黄、枳实和淡豆豉4味药材组成。方中栀子、大黄清泄湿热,枳实破气行滞,淡豆豉轻清宣散,诸药相合,共奏清肝利胆、理气退黄之效[1]。现代药理学研究[2]表明,栀子大黄汤具有显著的利胆、抗炎活性。目前,栀子大黄汤已被广泛应用于热重湿轻之肝胆疾患或心经郁热者的临床治疗,如新生儿病理性黄疸、黄疸型肝炎等[3-4]。然而栀子大黄汤的作用机制尚未阐明,加之中药成分复杂,作用靶点和途径较多,故其药效物质基础及作用机制仍需进一步探索。网络药理学的概念于2007年由英国学者Hopkins提出,其基于系统生物学、药理学、计算分析等多学科理论,多层次探讨药物干预疾病的分子机制。大量研究[5-7]发现,基于网络药理学方法研究中药的作用机制符合中医药的整体作用特点,且效果准确可靠。本研究基于网络药理学方法筛选栀子大黄汤的活性成分和靶点,构建“药材-活性成分-靶点”网络模式,旨在为进一步阐述栀子大黄汤抗肝损伤的作用机制提供科学依据。
1. 材料与方法
1.1 栀子大黄汤潜在活性成分筛选
通过中药系统药理学分析平台(TCMSP Ver 2.3, http://tcmspw.com/tcmsp.php)、中医药百科全书数据库(ETCM, http://www.tcmip.cn/ETCM/)检索栀子、大黄、枳实和淡豆豉化合物,建立栀子大黄汤化学成分数据库。筛选口服生物利用度(OB)≥30%且类药性(DL)≥0.18的化合物作为潜在活性成分,并纳入相关文献[8-9]报道的重要活性成分。
1.2 潜在活性成分相关基因靶标获取与“药材-活性成分-靶点”网络构建
借助STITCH DB Ver 5.0(http://stitch.embl.de)进行研究,物种设置为“智人”,阈值设置为默认,将有证据验证的靶点基因纳入成分相关靶点,否则剔除。通过Cytoscape 3.7.0软件构建“药材-活性成分-靶点”网络,并分析节点和边。
1.3 疾病相关靶点获取
肝损伤相关靶点来源于GeneCards Ver 5.12.0 (https://www.genecards.org)和Pharm GKB (https://www.pharmgkb.org), 检索关键词"liver injury", 其中GeneCards数据库选取相关性大于1的靶点。将获得的靶点通过Uniport数据库(https://www.uniprot.org)进行名称标准化。
1.4 药物-疾病靶点网络建设
为了明确栀子大黄汤治疗肝损伤潜在靶点之间的相互作用,将药物成分靶点与疾病靶点进行交集。应用STRING平台(https://string-db.org, Ver 11.0)进行分析,蛋白来源种类设置为“智人”,相互作用阈值设置为默认,获取蛋白-蛋白相互作用(PPI), 然后通过Cytoscape软件构建PPI网络。通过Cytoscape软件的CytoNCA插件获得PPI网络中的自由度中心性(DC)、介度中心性(BC)、接近性中心性(CC)、特征向量中心性(EC)、网络中心性(NC)、局部边连通性(LAC)。筛选标准: 指标数值大于中位数,即为关键基因。
1.5 基因通路与功能分析
借助R语言软件(Ver 4.03)的clusterprofiler包将药物与疾病交集的靶标基因名转化成基因ID, 并对栀子大黄汤潜在抗肝损伤靶点进行基因本体(GO)功能富集分析和京都基因与基因组百科全书(KEGG)信号通路富集分析。以q≤0.05为阈值,再应用R语言软件中的ggplot包绘制条形图。
1.6 化合物与靶点相互作用的分子对接
为了阐明潜在化合物与其潜在靶标的相互作用,选择关键靶点基因与活性化合物进行分子对接。通过PubChem(http://pubchem.ncbi.nlm.nih.gov)获得所选活性化合物的SDF结构,然后通过ChemBio3D 17.0获得化合物最低能量的MOL2结构。关键靶点基因对应蛋白质的晶体结构来源于PDB数据库(http://www.rcsb.org), 优先选择“智人”种属、分辨率大于2.5 Å、含有活性配体、X射线晶体结构蛋白质的晶体结构,利用PyMol软件进行去水、加氢、调整电荷等预处理。使用Autodock 4.2和AutodockTool计算所选化合物和目标靶点蛋白之间的结合亲和力。目标靶点蛋白包括细胞间黏附分子-1(ICAM-1)(PDB ID: 1P53)、肿瘤坏死因子(TNF)(PDB ID: 1TNR)、基质金属蛋白酶9(MMP9)(PDB ID: 6ESM)的X射线晶体结构) 和白细胞介素-10(IL-10)(PDB ID: 2H24)。
2. 结果
2.1 活性化合物的筛选与网络构建
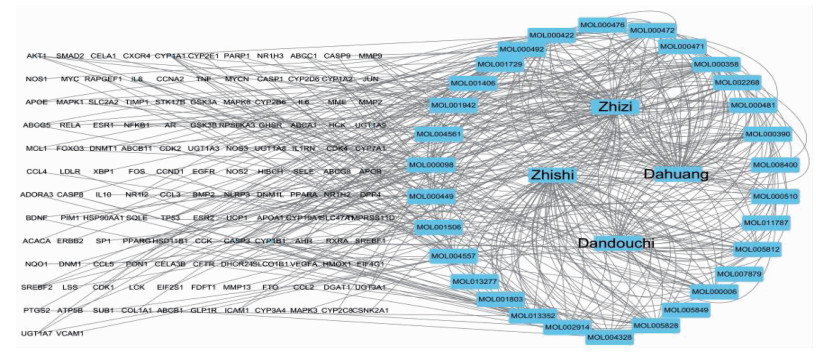
通过TCMSP和ETCM数据库检索栀子、大黄、枳实、淡豆豉化合物,以OB≥30%且DL≥0.18为条件筛选出活性成分81个(其中18个来自栀子, 21个来自大黄, 33个来自枳实, 9个来自淡豆豉),剔除重复成分10个,最终获得71个成分。利用STITCH数据库共检索到138个相关靶点基因,无靶点基因的化合物未被纳入本研究,最终共获得31种活性成分,见表 1。利用通过Cytoscape软件构建的“药材-活性成分-靶点”网络进行拓扑分析,共有169个节点和460条对应相互关系的边,见图 1。
表 1 栀子大黄汤中活性成分的基本信息编号 化合物成分 OB/% DL 相对分子质量 来源 MOL002268 大黄酸(rhein) 47.07 0.28 284.22 大黄 MOL000358 谷甾醇(sitosterol) 36.91 0.75 414.72 栀子、大黄 MOL000471 芦荟大黄素(aloe-emodin) 83.38 0.24 270.24 大黄 MOL000472 大黄素(emodin) 24.40 0.24 270.24 大黄 MOL000476 大黄素甲醚(physcion) 22.29 0.27 284.26 大黄 MOL000422 山奈酚(kaempferol) 41.88 0.24 286.25 栀子、大黄 MOL000492 儿茶素(catechin) 54.83 0.24 290.29 大黄 MOL001729 大黄酚(chrysophanol) 18.64 0.21 254.25 大黄 MOL001406 藏花酸(crocetin) 35.30 0.26 328.44 栀子 MOL001941 欧前胡素(imperatorin) 45.46 0.23 270.30 栀子 MOL004561 苏丹Ⅲ(Sudan Ⅲ) 84.07 0.59 352.42 栀子 MOL000098 槲皮素(quercetin) 46.43 0.28 302.25 栀子 MOL000449 豆甾醇(stigmasterol) 43.83 0.76 412.77 栀子 MOL001506 角鲨烯(squalene) 33.55 0.42 410.80 栀子 MOL001942 异欧前胡素(isoimperatorin) 45.46 0.23 270.30 栀子 MOL004557 栀子苷(geniposide) 14.64 0.44 388.41 栀子 MOL013277 异橙黄酮(Isosinensetin) 51.15 0.44 372.40 枳实 MOL001803 橙黄酮(sinensetin) 50.56 0.45 372.37 枳实 MOL013352 黄柏酮(obacunone) 43.29 0.77 454.51 枳实 MOL002914 黄烷酮(flavanone) 41.35 0.24 288.27 枳实 MOL004328 柚皮素(naringenin) 59.29 0.21 272.27 枳实 MOL005828 川皮苷(nobiletin) 61.67 0.52 402.39 枳实 MOL005849 蜂草苷(didymin) 38.55 0.24 286.30 枳实 MOL000006 木犀草素(luteolin) 36.16 0.24 286.25 枳实 MOL007879 四甲氧基木犀草素(Tetramethoxyluteolin) 43.68 0.37 341.37 枳实 MOL005812 柚皮苷(naringin) 6.92 0.78 580.59 枳实 MOL011787 黄豆黄素苷(glycitin) 22.48 0.78 446.41 淡豆豉 MOL000510 鸡豆黄素A(biochanin A) 25.21 0.24 284.26 淡豆豉 MOL008400 黄豆黄素(glycitein) 50.48 0.24 284.26 淡豆豉 MOL000390 大豆黄酮(daidzein) 19.44 0.18 254.24 淡豆豉 MOL000481 染料木黄酮(genistein) 17.93 0.21 270.24 淡豆豉 OB: 口服生物利用度; DL: 类药性。 2.2 肝损伤相关靶点筛选
检索GeneCards、PharmGKB数据库,分别获取肝损伤相关靶点401、20个,剔除重复项,校正后最终获得341个靶点。
2.3 栀子大黄汤抗肝损伤PPI网络构建与关键靶点筛选
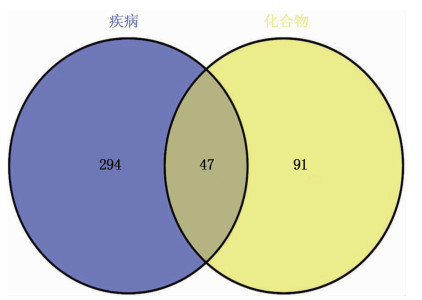
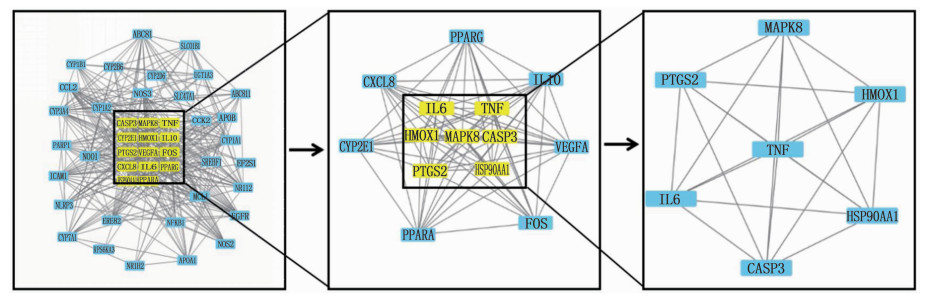
将341个疾病相关靶点与138个化合物靶点取交集,得到共同靶点47个,见图 2。应用Cytoscape软件构建栀子大黄汤药材抗肝损伤的PPI网络,靶点-靶点相互作用关系的边共410条。采用CytoNCA插件根据网络节点的拓扑属性进行2次筛选,共获取关键靶点基因7个,包括TNF、血红素加氧酶1(HMOX1)、白细胞介素-6(IL6)、丝裂原激活蛋白激酶8(MAPK8)、前列腺素内过氧化物合成酶2(PTGS2)、热休克蛋白90 Alpha家族A级成员1(HSP90AA1)、半胱天冬酶3(CASP3), 见图 3。
2.4 GO功能富集分析
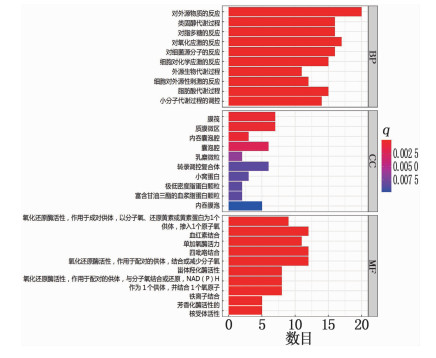
GO功能富集分析结果见图 4, 横轴表示基因富集数目,纵轴为富集条目, q值用不同颜色表示,颜色越深表示差异性越显著。①生物过程(BP)注释主要包括: 对外源物质的反应; 类固醇代谢过程; 对脂多糖的反应; 对氧化应激的反应; 对细菌源分子的反应; 细胞对化学应激的反应; 外源生物代谢过程; 细胞对外源性刺激的反应; 脂肪酸代谢过程; 小分子代谢过程的调控。②细胞组成(CC)注释主要包括: 膜筏; 质膜微区; 内吞囊泡腔; 囊泡腔; 乳糜微粒; 转录调控复合体; 小窝蛋白; 极低密度脂蛋白颗粒; 富含甘油三酯的血浆脂蛋白颗粒; 内吞膜泡。③分子功能(MF)注释主要包括: 氧化还原酶活性,作用于成对供体,以分子氧、还原黄素或黄素蛋白为1个供体,掺入1个原子氧; 血红素结合; 单加氧酶活力; 四吡咯结合; 氧化还原酶活性,作用于配对的供体,结合或减少分子氧; 甾体羟化酶活性; 氧化还原酶活性,作用于配对的供体,与分子氧结合或还原, NAD(P)H作为1个供体,并结合1个氧原子; 铁离子结合; 芳香化酶活性; 核受体活性。
2.5 KEGG信号通路富集分析
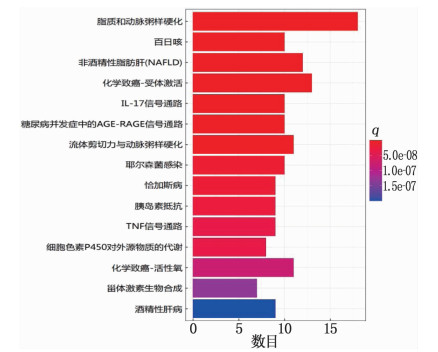
根据KEGG富集条目绘制前15条信号通路的条形图,其中横轴表示富集数目,纵轴表示通路名称,不同颜色表示不同大小的q值,见图 5。结果显示,栀子大黄汤抗肝损伤通路主要与脂质和动脉粥样硬化、百日咳、非酒精性脂肪肝、化学致癌-受体激活、IL-17信号通路、糖尿病并发症中的AGE-RAGE信号通路、流体剪切力与动脉粥样硬化、耶尔森菌感染、恰加斯病、胰岛素抵抗、TNF信号通路、细胞色素P450对外源物质的代谢、化学致癌-活性氧、甾体激素生物合成、酒精性肝病相关。
2.6 分子对接结果
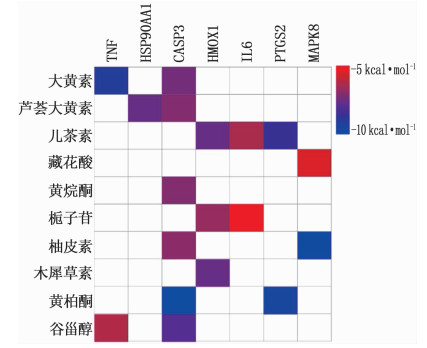
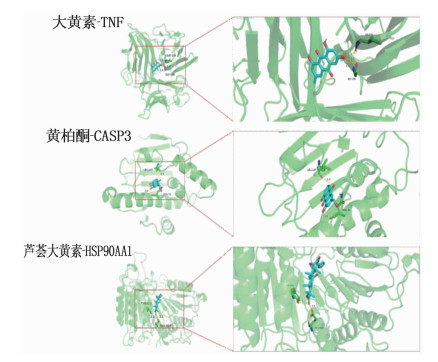
对PPI网络中的基因进行2次筛选后共获得7个关键靶点基因,从PDB数据库下载其对应蛋白质的晶体结构,即TNF(PDB: 7JRA)、HMOX1(PDB: 3HOK)、IL6(PDB: 1ALU)、MAPK8(PDB: 4L7F)、PTGS2(PDB: 5F1A)、HSP90AA1(PDB: 2YI7)、CASP3(PDB: 1RHJ), 在此基础上进行关键靶点与活性成分的分子对接。通过结合能评估对接结果,结合能越小表示分子对接效果越好,结合能数值小于-7 kcal/mol表示结合活性较好,结合能数值小于-9 kcal/mol表示结合活性非常好。分子对接结果显示,大黄素-TNF、芦荟大黄素-HSP90AA1、黄柏酮-CASP3这3组典型分子对接的结合活性均很高,见图 6。借助PyMol软件将这3组分子对接结果进行可视化,结果见图 7。
3. 讨论
栀子大黄汤组方出自《金匮要略》,临床应用历史悠久,目前涉及该组方中单味药材的研究已有报道[10], 但关于全方药材及其应用于肝损伤治疗的药效物质基础与作用机制的研究尚很少见。本研究采用网络药理学方法筛选栀子大黄汤的活性成分,基于成分-靶点相互作用分析筛选关键作用靶点,并通过富集分析筛选关键作用通路,最后采用分子对接技术对关键活性成分与关键靶点的结合活性进行验证。结果显示,栀子大黄汤的化学成分复杂,基于数据库检索与OB、DL筛选共检出71种植物化学成分,其中大部分成分来源于枳实,来源于淡豆豉的成分最少。从化学结构上看,筛选出的潜在活性成分主要为环烯醚萜苷类、蒽醌类、黄酮类、异黄酮类,与既往研究[11-13]结论一致。
肝损伤是指在一系列理化因素作用下,肝细胞发生不同程度的肿胀、变性、坏死和凋亡,是各种肝病发生与发展的共有病理特征。肝损伤若不能及时被纠正,将使肝病慢性化,进而导致更严重的肝脏疾病。因此,通过清除自由基、抑制肝细胞凋亡、抑制炎性反应减轻肝组织炎症、修复受损肝细胞,从而缓解肝损伤具有重要意义[14]。肝损伤可归属于中医学“胁痛”“黄疸”“酒疸”“药毒”“积聚”“臌胀”等范畴[15], 《黄帝内经》亦明确指出,胁痛的发生主要与肝胆病变相关。目前,肝损伤治疗药物大多存在作用途径单一、疗效不足、副作用大等问题,而中医药辨证治疗肝损伤历史悠久,开发潜力巨大,其中桅子大黄汤为代表方之一。近年来,诸多学者将现代科技应用于桅子大黄汤治疗肝损伤的实验研究,并取得了一定进展。刘天凤等[16]采用α-萘异硫氰酸酯(ANIT)制备大鼠急性肝内胆汁淤积模型,发现乙酸乙酯部位为栀子大黄汤抗肝内胆汁淤积的有效部位,能显著改善模型大鼠血清丙氨酸转氨酶(ALT)、总胆红素(TBIL)水平,并显著改善血清碱性磷酸酶(ALP)、总胆汁酸(TBA)、γ-谷氨酰转肽酶(γ-GT)和肝组织丙二醛(MDA)、超氧化物歧化酶(SOD)水平。李伦等[17]研究了栀子大黄汤对四氯化碳所致小鼠急性肝损伤的保护作用,发现栀子大黄汤可显著降低血清ALT、天冬氨酸转氨酶(AST)、MDA水平,提升肝组织SOD活性,减轻肝细胞变形、坏死程度,其药效机制与下调肝组织Bax、Cleaved-Caspase-3表达和上调Bcl-2表达有关。张晓书等[18]建立体内外酒精性肝损伤模型发现,栀子大黄汤可有效降低模型组大鼠升高的血清ALT、AST和甘油三酯(TG)水平,并降低受损肝组织中MDA含量,提升肝组织SOD活性和谷胱甘肽(GSH)含量,对酒精性肝损伤具有明显的防治作用。
中药复方具有整体性和多样性的特点,可发挥多层次、多环节、多靶点综合作用,所以栀子大黄汤对肝损伤的防治作用可能来源于多重药理作用与分子机制。本研究通过检索并筛选获得341个疾病相关靶点与138个药物潜在靶点,将其交集后得到47个交集靶点,进一步对靶点-靶点进行网络拓扑学分析,筛选出TNF、HMOX1、IL6、MAPK8、PTGS2、HSP90AA1、CASP3为栀子大黄汤治疗肝损伤的关键靶点基因。多种因素会对肝脏造成损伤,导致肝脏出现炎症,因此抑制炎症是缓解肝损伤的重要途径之一。TNF、IL6、PTGS2是参与炎症反应的关键效应因子,栀子大黄汤可通过降低TNF、IL6、PTGS2等炎症因子水平发挥防治肝损伤的效果。Caspase-3作为Caspase家族成员中执行细胞凋亡的关键酶之一,是细胞凋亡的中枢效应器,可被多种刺激因素激活,经剪切活化成Cleaved-Caspase-3, 然后裂解多种蛋白,阻止DNA复制和细胞修复,破坏细胞核整体结构,最终导致细胞凋亡。栀子大黄汤可以抑制Caspase-3活化,减少肝细胞的凋亡,从而缓解肝脏损伤。GO功能分析和KEGG通路分析结果表明,栀子大黄汤可降低肝脏脂质过氧化水平,提高抗氧化酶水平,从而发挥抗氧化应激作用,还可通过抑制TNF信号通路发挥抗炎作用,与相关研究[13-15]结论一致。此外,分子对接结果表明栀子大黄汤中关键活性成分大黄素、芦荟大黄素、黄柏酮等与关键蛋白TNF、CASP3等的结合活力非常高,进一步确证栀子大黄汤能够通过抑制氧化应激、炎症反应、肝细胞凋亡等途径发挥治疗肝损伤的效果。
-
表 1 栀子大黄汤中活性成分的基本信息
编号 化合物成分 OB/% DL 相对分子质量 来源 MOL002268 大黄酸(rhein) 47.07 0.28 284.22 大黄 MOL000358 谷甾醇(sitosterol) 36.91 0.75 414.72 栀子、大黄 MOL000471 芦荟大黄素(aloe-emodin) 83.38 0.24 270.24 大黄 MOL000472 大黄素(emodin) 24.40 0.24 270.24 大黄 MOL000476 大黄素甲醚(physcion) 22.29 0.27 284.26 大黄 MOL000422 山奈酚(kaempferol) 41.88 0.24 286.25 栀子、大黄 MOL000492 儿茶素(catechin) 54.83 0.24 290.29 大黄 MOL001729 大黄酚(chrysophanol) 18.64 0.21 254.25 大黄 MOL001406 藏花酸(crocetin) 35.30 0.26 328.44 栀子 MOL001941 欧前胡素(imperatorin) 45.46 0.23 270.30 栀子 MOL004561 苏丹Ⅲ(Sudan Ⅲ) 84.07 0.59 352.42 栀子 MOL000098 槲皮素(quercetin) 46.43 0.28 302.25 栀子 MOL000449 豆甾醇(stigmasterol) 43.83 0.76 412.77 栀子 MOL001506 角鲨烯(squalene) 33.55 0.42 410.80 栀子 MOL001942 异欧前胡素(isoimperatorin) 45.46 0.23 270.30 栀子 MOL004557 栀子苷(geniposide) 14.64 0.44 388.41 栀子 MOL013277 异橙黄酮(Isosinensetin) 51.15 0.44 372.40 枳实 MOL001803 橙黄酮(sinensetin) 50.56 0.45 372.37 枳实 MOL013352 黄柏酮(obacunone) 43.29 0.77 454.51 枳实 MOL002914 黄烷酮(flavanone) 41.35 0.24 288.27 枳实 MOL004328 柚皮素(naringenin) 59.29 0.21 272.27 枳实 MOL005828 川皮苷(nobiletin) 61.67 0.52 402.39 枳实 MOL005849 蜂草苷(didymin) 38.55 0.24 286.30 枳实 MOL000006 木犀草素(luteolin) 36.16 0.24 286.25 枳实 MOL007879 四甲氧基木犀草素(Tetramethoxyluteolin) 43.68 0.37 341.37 枳实 MOL005812 柚皮苷(naringin) 6.92 0.78 580.59 枳实 MOL011787 黄豆黄素苷(glycitin) 22.48 0.78 446.41 淡豆豉 MOL000510 鸡豆黄素A(biochanin A) 25.21 0.24 284.26 淡豆豉 MOL008400 黄豆黄素(glycitein) 50.48 0.24 284.26 淡豆豉 MOL000390 大豆黄酮(daidzein) 19.44 0.18 254.24 淡豆豉 MOL000481 染料木黄酮(genistein) 17.93 0.21 270.24 淡豆豉 OB: 口服生物利用度; DL: 类药性。 -
[1] 尚炽昌, 王付. 经方配伍用药指南[M]. 北京: 中国中医药出版社, 1998: 25-35. [2] 许阳贤, 杨吉勇, 曹锦峰. 栀子大黄汤利胆抗炎作用的实验研究[J]. 江苏中医药, 2013, 15(9): 74-75. doi: 10.3969/j.issn.1672-397X.2013.09.046 [3] 陈明丽. 栀子大黄汤加减联合双歧杆菌三联活菌肠溶胶囊、蓝光照射治疗新生儿病理性黄疸的效果[J]. 医学信息, 2021, 34(24): 154-156. doi: 10.3969/j.issn.1006-1959.2021.24.040 [4] 魏雯佳, 王树民, 丁娅. 栀子大黄汤合柴胡疏肝散治疗黄疸型肝炎的临床观察[J]. 中国中医药科技, 2019, 26(4): 593-595. https://www.cnki.com.cn/Article/CJFDTOTAL-TJYY201904048.htm [5] 杨柳, 张王宁, 刘月涛, 等. 基于网络药理学的黄芪治疗肾病综合征的机制研究[J]. 中草药, 2019, 50(8): 1828-1837. https://www.cnki.com.cn/Article/CJFDTOTAL-ZCYO201908010.htm [6] 甘丽华, 李志敏, 何泉, 等. 基于分子对接技术与网络药理学分析方法的半夏-黄连药对治疗胃食管反流病的作用机制研究[J]. 实用临床医药杂志, 2021, 25(21): 1-6. doi: 10.7619/jcmp.20211655 [7] 覃薇, 殷梓辛, 华维维, 等. 基于网络药理学和分子对接探讨通关藤治疗胃癌的作用机制[J]. 实用临床医药杂志, 2022, 26(1): 1-7, 17. https://www.cnki.com.cn/Article/CJFDTOTAL-XYZL202201001.htm [8] 褚晓文, 韩飞, 宋爱华, 等. 基于HPLC-FT-ICR MS技术的栀子大黄汤在大鼠胆汁中原形成分及代谢产物的分析鉴定[J]. 沈阳药科大学学报, 2019, 36(11): 998-1010, 1040. https://www.cnki.com.cn/Article/CJFDTOTAL-SYYD201911008.htm [9] ZHU H, BI K, HAN F, et al. Identification of the absorbed components and metabolites of Zhi-Zi-Da-Huang Decoction in rat plasma by ultra-high performance liquid chromatography coupled with quadrupole-time-of-flight mass spectrometry[J]. J Pharm Biomed Anal, 2015, 111: 277-287. doi: 10.1016/j.jpba.2015.03.043
[10] 高雨, 朱琦, 陈蕾蕾, 等. 栀子主要有效成分的代谢及毒性研究进展[J]. 中南药学, 2021, 19(2): 254-260. https://www.cnki.com.cn/Article/CJFDTOTAL-ZNYX202102014.htm [11] 屈义虎. 药用大黄成分分析及结合型蒽醌生物转化研究[D]. 汉中: 陕西理工大学, 2019. [12] 刘李婷, 石菲, 刘叶, 等. 不同豆制品中大豆异黄酮的种类和含量分析[J]. 食品安全导刊, 2022(19): 100-102. https://www.cnki.com.cn/Article/CJFDTOTAL-SPAQ202219035.htm [13] 童培珍, 李国卫, 何嘉莹, 等. 基于指纹图谱和多指标成分含量测定的枳壳与枳实药材质量差异性研究[J]. 中南药学, 2022, 20(4): 898-904. https://www.cnki.com.cn/Article/CJFDTOTAL-ZNYX202204026.htm [14] GADD V L, ALEKSIEVA N, FORBES S J. Epithelial plasticity during liver injury and regeneration[J]. Cell Stem Cell, 2020, 27(4): 557-573.
[15] 唐颖慧, 刘皎皎, 李粉萍, 等. 急性药物性肝损伤患者中医证候要素分布特征探讨[J]. 实用临床医药杂志, 2022, 26(7): 8-12. https://www.cnki.com.cn/Article/CJFDTOTAL-XYZL202207002.htm [16] 刘天凤, 马丽, 李艳婷, 等. 栀子大黄汤抗肝内胆汁淤积有效部位的筛选及其化学成分分析[J]. 沈阳药科大学学报, 2017, 34(8): 644-653. https://www.cnki.com.cn/Article/CJFDTOTAL-SYYD201708006.htm [17] 李伦, 钟伟超, 梁伟海, 等. 栀子大黄汤对四氯化碳致小鼠急性肝损伤的保护作用[J]. 中国实验方剂学杂志, 2016, 22(12): 108-112. https://www.cnki.com.cn/Article/CJFDTOTAL-ZSFX201612022.htm [18] 张晓书, 韩飞, 朱鹤云, 等. 栀子大黄汤抗酒精性肝损伤的体内外实验[J]. 沈阳药科大学学报, 2016, 33(7): 565-571. https://www.cnki.com.cn/Article/CJFDTOTAL-SYYD201607011.htm -
期刊类型引用(0)
其他类型引用(3)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号