Evaluation of carotid geometry of the internal carotid artery atheromatous plaque by head and neck CT angiography imaging
-
摘要:目的
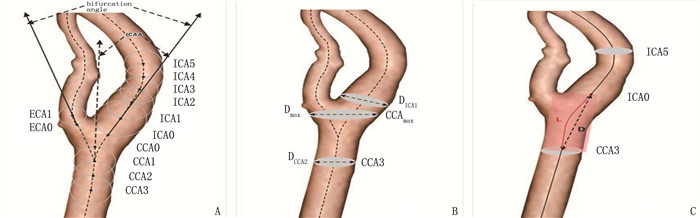
基于头颈部CT血管成像(CTA)探讨不同颈动脉几何形态与缺血性卒中患者颈内动脉(ICA)起始部粥样斑块形成的相关性。
方法回顾性收集因缺血性卒中住院并完成头颈部CTA检查患者的资料。纳入92例单侧ICA起始部粥样硬化斑块患者为斑块组,并选择人口统计学变量相似的30例双侧ICA正常者为对照组。同时将单侧ICA起始部粥样硬化斑块分为斑块侧和非斑块侧。分别比较2组间和斑块组内斑块侧及非斑块侧的颈动脉几何形态差异。
结果斑块组患者的颈内动脉角、颈动脉扩张度和ICA/颈总动脉(CCA)直径比等颈动脉几何形态学参数与对照组比较,差异有统计学意义(P < 0.05)。与非斑块侧比较,斑块侧的颈内动脉角更大,颈动脉扩张度更高, ICA/CCA直径比更低,差异有统计学意义(P < 0.05)。多因素Logistic回归分析结果显示,较大的颈内动脉角和颈动脉扩张度及低ICA/CCA直径比与ICA起始部粥样斑块形成相关。
结论不同个体间颈动脉几何形态特征存在差异。在轻度ICA粥样硬化病变患者中,较大的颈内动脉角、颈动脉扩张度和较小的ICA/CCA直径比是ICA起始部粥样斑块形成的独立危险因素。
Abstract:ObjectiveTo investigate the relationship between different carotid geometry and the formation of atherosclerotic plaque in the initial part of internal carotid artery (ICA) in patients with ischemic stroke based on CT angiography (CTA) of head and neck.
MethodsData of patients hospitalized for ischemic stroke and who completed head and neck CTA were retrospectively collected. Ninety-two patients with atherosclerotic plaques at the beginning of unilateral ICA were included in the plaque group, and 30 patients with bilateral normal ICA with similar demographic variables were selected as the control group. At the same time, unilateral ICA initiation atherosclerotic plaque were divided into plaque side and non-plaque side. The differences of carotid artery geometry between the two groups and in the plaque and non-plaque sides were compared.
ResultsThe geometric parameters of carotid artery, such as internal carotid artery angle, carotid artery dilation and ICA/common carotid artery (CCA) diameter ratio in the plaque group showed significant difference compared with those in the control group (P < 0.05). Compared with the non-plaque side, the internal carotid artery angle on the plaque side was significantly larger, carotid artery dilation was significantly higher, and ICA/CCA diameter ratio was significantly lower (P < 0.05). Multivariate Logistic regression analysis results showed that larger internal carotid artery angle and carotid artery dilatation and lower ICA/CCA diameter ratio were associated with atherosclerotic plaque formation at ICA initiation.
ConclusionThe geometric features of carotid artery are different among different individuals. In patients with mild ICA atherosclerotic lesions, larger internal carotid artery angle, carotid artery dilation and smaller ICA/CCA diameter ratio are independent risk factors for atherosclerotic plaque formation at the initiation of ICA.
-
Keywords:
- carotid artery /
- atherosclerosis /
- geometry /
- wall shear stress /
- hemodynamics /
- CT angiography
-
急性前循环进展性脑梗死通常发生在发病后6 h~1周,多数在24 h内恶化。该病具有高病死率、高致残率,预后普遍不佳[1-2]。因此,实施早期遏制病情、加速神经功能恢复的治疗策略,对于减轻残疾程度及改善预后至关重要[3]。目前,临床治疗该病主要为扩张血管、改善颅内循环、保护受损神经细胞等,同时辅以抗血小板、调脂等基础治疗。然而,部分患者疗效仍不理想[4]。替罗非班是一种抗血小板药物,近年来广泛用于急性脑梗死的治疗[5]。《2019 AHA/ASA急性缺血性卒中早期管理指南全面解读(下)》[6]推荐替罗非班用于急性缺血性脑梗死的Ⅱb级治疗。然而,针对急性前循环进展性脑梗死患者应用替罗非班的治疗方案,目前尚缺乏广泛临床数据直接证实其有效性。鉴于急性心肌梗死与动脉粥样硬化性脑梗死在血小板活化与聚集机制上的相似性,且前循环脑梗死的进展与动脉粥样硬化严重程度紧密相关,推测替罗非班治疗可能潜在遏制此类患者梗死病灶的进一步恶化。此外,奥拉西坦能直接作用于大脑皮层,促进神经细胞RNA、蛋白质合成,减轻再灌注损伤,对急性前循环进展性脑梗死患者的认知功能恢复也至关重要。本研究探讨替罗非班联合奥拉西坦对急性前循环进展性脑梗死的影响,以期为该病治疗开辟新途径。
1. 资料与方法
1.1 一般资料
本研究采用前瞻性研究设计,选取2022年10月—2024年1月在本院行血管内治疗的急性前循环进展性脑梗死患者为研究对象,其中男103例,女68例,年龄50~65岁,平均(56.46±6.88)岁。纳入标准: ①符合急性前循环进展性脑梗死的诊断标准[7], 经头颅磁共振成像明确诊断者。患者符合血管内治疗指征,治疗后24 h内出现病情逐渐加重,美国国立卫生研究院卒中量表(NIHSS)评分较血管内治疗后增加≥2分。②收缩压、舒张压≤180、110 mmHg(1 mmHg=0.133 kPa) 者; ③非心源性栓塞者; ④签署知情同意书者。排除标准: ①头颅影像学显示脑出血者; ②有活动性内脏出血者; ③合并凝血功能障碍者; ④ NIHSS评分≥16分的危重型卒中者; ⑤对本研究药物过敏者。将符合上述标准的171例患者按照随机数字表法分为3组,其中对照组57例,观察A组57例和观察B组57例,详细记录3组患者资料,具体资料比较见表 1。本研究经医院伦理委员会审批通过(审批号: K2022-批件-032)。
表 1 3组基线资料比较(x±s)[n(%)]基线资料 分类 对照组(n=57) 观察A组(n=57) 观察B组(n=57) 性别 男 34(59.65) 32(56.14) 37(64.91) 女 23(40.35) 25(43.86) 20(35.09) 年龄/岁 56.23±7.26 57.02±6.55 56.38±7.02 体质量指数/(kg/m2) 23.26±2.02 23.55±1.89 23.34±1.92 吸烟史 32(56.14) 30(52.63) 28(49.12) 高血压 22(38.60) 24(42.11) 20(35.09) 高血脂 14(24.56) 11(19.30) 12(21.06) 糖尿病 20(35.09) 18(31.58) 17(29.82) 血压 收缩压/mmHg 142.26±10.54 140.98±11.67 141.91±10.24 舒张压/mmHg 86.26±8.25 85.97±9.02 87.11±8.67 NIHSS评分/分 9.43±2.15 9.46±2.20 9.41±2.17 实验室指标 血红蛋白/(g/L) 125.26±10.54 124.98±11.54 122.98±13.52 白细胞/(×109/L) 7.21±1.87 7.19±1.88 7.24±1.84 血小板/(×109/L) 182.25±30.25 180.65±32.74 184.54±31.62 血肌酐/(μmol/L) 78.25±18.28 79.65±19.67 78.98±18.66 尿素氮/(mmol/L) 6.65±1.69 6.71±1.64 6.67±1.67 活化部分凝血活酶时间/s 36.25±4.11 37.02±4.02 36.54±4.08 凝血酶原时间/s 13.62±1.05 13.38±1.17 13.49±1.14 凝血酶时间/s 19.32±2.57 18.97±2.68 19.20±2.61 总胆固醇/(mmol/L) 4.12±1.02 4.19±1.14 4.02±1.08 高密度脂蛋白/(mmol/L) 1.42±0.41 1.45±0.38 1.40±0.37 低密度脂蛋白/(mmol/L) 2.44±0.47 2.48±0.51 2.42±0.49 1 mmHg=0.133 kPa。NIHSS: 美国国立卫生研究院卒中量表。 1.2 治疗方法
所有患者均给予营养神经、保护脑组织、降低颅内压、改善侧支循环等常规对症治疗,同时予以血管内治疗。对照组采用常规治疗,血管内治疗24 h后口服阿司匹林肠溶片(石药集团欧意药业,批准文号H20153035), 100 mg/次, 1次/d。硫酸氯吡格雷片(江苏联环药业,批准文号H20203534), 75 mg/次, 1次/d。观察A组应用标准剂量替罗非班,起始3 min内静脉推注盐酸替罗非班注射液(鲁南贝特制药,批准文号H20090225)10 μg/kg, 维持泵维持至少24 h。之后予以阿司匹林及氯吡格雷(重叠4 h, 剂量同对照组)联合序贯治疗。观察B组在观察A组的基础上增加奥拉西坦治疗。注射用奥拉西坦(石药集团欧意药业,批准文号H20100040, 规格1.0 g), 4 g/次, 1次/d。3组均治疗14 d。
1.3 评价指标
1.3.1 有效性评价
① 疗效评价[8]。治疗后14 d, NIHSS评分较基线降低4分或以上为神经功能改善; 治疗后14 d, NIHSS评分较基线升高≥4分或死亡为神经功能恶化; 治疗后90 d时改良Rankin量表(MRS)评分≤ 2分为预后良好。根据神经功能躯体恢复状况[0分(无症状)至6分(死亡)]以及MRS评分评价预后。②次要疗效结果: 治疗7、14 d NIHSS评分较基线评分的变化。
1.3.2 认知功能
记录各时点(治疗前以及治疗后14、30、90 d)认知功能。采用蒙特利尔认知评估量表(MOCA)评分评价认知功能。MOCA包含11项,共计30分,评分越高说明认知功能越好。
1.3.3 安全性指标
由专人记录用药期间有无出血表现。重点观察症状性颅内出血、致死性颅内出血(因症状性颅内出血致患者死亡)及90 d病死率发生情况。
1.4 统计学方法
采用SPSS 20.0软件统计数据,符合正态分布的计量资料以(x±s)表示,多组间比较采用单因素方差分析,两两比较采用t检验; 不符合正态分布的计量资料以[M ( P25, P75)]表示,比较采用Kruskal-Wallis秩和检验; 计数资料以[n(%)]表示,采用χ2检验; 将血管内治疗前NIHSS评分作为自变量,予以混合效应模型进行治疗效果的矫正评价。P < 0.05为差异有统计学意义。
2. 结果
2.1 3组疗效比较
3组治疗后14 d神经功能改善率和神经功能恶化率以及治疗后90 d预后良好率和MRS评分比较,差异无统计学意义(P>0.05)。3组治疗后7、14 d NIHSS评分与基线评分比较,差异有统计学意义(P < 0.05), 且观察B组以上时点NIHSS评分与基线的差值高于观察A组和对照组,差异有统计学意义(P < 0.05), 见表 2。
表 2 3组疗效比较(x±s)[n(%)][M ( P25, P75)]疗效结果 分类 对照组(n=57) 观察A组(n=57) 观察B组(n=57) 未校正95%CI 未校正P 校正95%CI 校正P 主要疗效结果 治疗后14 d神经功能改善 38(66.67) 41(71.93) 43(75.44) 0.598~0.623 0.610 0.165~0.185 0.175 治疗后14 d神经功能恶化 6(10.53) 5(8.77) 4(7.02) 0.939~0.950 0.945 0.305~0.329 0.317 治疗后90 d预后良好 27(47.37) 30(52.63) 32(26.14) 0.661~0.685 0.673 0.188~0.208 0.198 治疗后90 d MRS评分/分 3(1, 5) 2(1, 4) 2(1, 4) 0.653~0.677 0.665 0.183~0.204 0.194 次要疗效结果 治疗后7 d NIHSS评分与基线的差值/分 -0.70±0.50* -1.53±1.05* -2.08±1.26 0.009~0.014 0.012 0.006~0.010 0.009 治疗后14 d NIHSS评分与基线的差值/分 -2.23±1.36* -2.93±1.22* -3.06±1.26 0.025~0.034 0.030 0.017~0.029 0.021 NIHSS: 美国国立卫生研究院卒中量表; MRS: 改良Rankin量表。与观察B组比较, * P < 0.05。 2.2 3组认知功能比较
3组治疗前MOCA评分比较,差异无统计学意义(P>0.05)。治疗后14、30、90 d, 观察B组MOCA评分高于观察A组和对照组,差异有统计学意义(P < 0.05), 见表 3。
表 3 3组认知功能比较(x±s)分 MOCA评分 对照组(n=57) 观察A组(n=57) 观察B组(n=57) 未校正95%CI 未校正P 校正95%CI 校正P 治疗前 23.01±3.02 23.03±3.25 23.15±3.18 0.382~0.407 0.394 0.213~0.276 0.244 治疗后14 d 24.11±2.14* 24.29±2.11* 25.64±2.48 0.001~0.006 0.003 0.001~0.004 0.002 治疗后30 d 25.24±1.24* 25.77±1.42* 26.84±1.53 — < 0.001 — < 0.001 治疗后90 d 26.22±1.33* 26.33±1.44* 27.11±1.02 0.006~0.011 0.010 0.004~0.008 0.006 MOCA: 蒙特利尔认知评估量表。与观察B组比较, * P < 0.05。 2.3 3组安全性比较
3组症状性颅内出血率、致死性颅内出血率及90 d病死率比较,差异均无统计学意义(P>0.05), 见表 4。
表 4 3组安全性比较[n(%)]安全性结果 对照组(n=57) 观察A组(n=57) 观察B组(n=57) 未校正95%CI 未校正P 校正95%CI 校正P 症状性颅内出血 2(3.51) 4(7.02) 3(5.26) 0.628~0.653 0.641 0.395~0.420 0.408 致死性颅内出血 0 1(1.75) 0 — — 0.660~0.684 0.672 治疗后90 d病死 10(17.54) 9(15.79) 7(12.28) 0.799~0.819 0.809 0.507~0.532 0.520 3. 讨论
急性前循环进展性脑卒中因局部脑组织血流灌注不足,导致缺血、缺氧性脑损害[9], 进展机制尚未完全阐明[10]。脑梗死发生后缺血半暗带期间进行及时干预可恢复血液供应[11-12]。血栓溶解是缺血半暗带期间唯一被广泛认可的治疗方法[13]。目前,对于超出溶栓时间窗进行血管内治疗者,内科治疗的选择仍显局限且效果不明确。本研究结果发现,替罗非班联合奥拉西坦疗效显著,有助于改善认知功能且不会增加出血风险,联合应用可提升急性前循环进展性脑梗死的治疗效果。
血小板聚集与血栓形成过程紧密相连,可遏制血栓发展,并打断血小板聚集的级联效应,是治疗策略的核心环节[14]。目前,在脑梗死治疗中,抗血小板药物占据核心地位。双联抗血小板疗法能有效遏制神经功能恶化,但部分患者疗效仍不理想[15], 这是因为其难以全面覆盖进展性脑梗死的复杂病理过程。替罗非班半衰期较短,给药后能迅速起效,仅需数分钟血小板抑制率即可超过96%, 能有效遏制血栓扩展[16]。既往研究[17-18]表明,替罗非班在ST段抬高的心肌梗死治疗中能显著提高血管再通率和心肌灌注,为患者预后改善开辟了新途径。该药物与rt-PA联合使用有助于增高大鼠大脑中动脉闭塞的再通率。本研究结果显示,替罗非班在促进神经功能恢复方面具有显著疗效,不仅能快速溶解微血栓,还能破坏血栓结构,激活内源性溶栓途径,从血栓形成根源上进行阻断,进而促进血管再通。针对动脉粥样硬化的特定病理环境,替罗非班作为GP Ⅱb/Ⅲa受体的可逆性拮抗剂,能有效应对血流动力学变化触发的血小板活化,抑制血栓形成[19-20]。同时,其可通过降低单核因子趋化蛋白及炎性因子水平,减轻炎症反应,进一步优化微循环环境,促进神经功能恢复,从而显著提升整体治疗效果。
血栓形成后导致血小板聚集,脑部血液供应减少,脑神经元细胞缺血性损害加重及凋亡增加,影响机体认知功能[21]。为减轻认知功能损害,本研究在替罗非班药物基础上加用奥拉西坦,结果显示,观察B组MOCA评分较观察A组和对照组高,说明替罗非班联合奥拉西坦能够改善认知功能。这可能与奥拉西坦作为一类神经营养药,能促进羟基氨基丁酸环状衍生物的合成,可穿过血脑脊液屏障,使葡萄糖的吸收和利用增强,同时脑组织代谢利用率显著提升,从而改善脑组织缺血、低氧状态,促进认知功能恢复。与替罗非班联合应用可通过多重作用机制协同增效,改善认知功能。在安全性方面,鉴于抗血小板药物应用时最大不良反应为出血,本研究重点评估出血风险。结果显示,3组症状性颅内出血、致死性颅内出血及术后90 d病死率比较,差异无统计学意义(P>0.05), 证明该方案治疗安全性高,不增加出血风险。
综上所述,替罗非班联合奥拉西坦可改善急性前循环进展性脑梗死患者的认知及神经功能,不会增加出血风险,预后良好,且有较高的疗效和安全性,能为相关疾病的治疗提供新的理论依据,也为抗血小板药物和神经营养药物的联合应用提供了新思路和方法。然而,由于样本量的限制和个体差异等因素,该结果的普适性尚需进一步验证。
-
表 1 斑块组与对照组患者的基线特征比较(x±s)[n(%)]
临床特征 斑块组(n=92) 对照组(n=30) t/χ2 P 年龄/岁 67.26±9.09 66.10±9.38 0.603 0.548 男性 60(65.22) 23(76.76) 1.364 0.243 高血压 74(80.43) 20(66.67) 2.425 0.119 糖尿病 38(41.30) 8(26.67) 2.064 0.151 高脂血症 30(32.61) 8(26.67) 0.372 0.542 高同型半胱氨酸血症 14(15.22) 6(20.00) 0.378 0.539 吸烟史 15(16.30) 6(20.00) 0.217 0.641 既往卒中史 15(16.30) 3(10.00) 0.715 0.398 冠心病史 5(5.43) 1(3.33) 0.212 0.645 表 2 斑块组斑块侧与对照组对应侧的颈动脉几何形态参数比较(x±s)[M(Q1, Q3)]
几何参数 斑块组 对照组 t/Z P 右侧颈动脉分叉角/° 67.40±14.08 64.35±10.09 1.016 0.313 右侧颈内动脉角/° 29.5(25.90, 34.50) 22.55(20.38, 29.82) -3.392 0.001 右侧ICA/CCA直径比 0.72±0.10 0.78±0.09 -2.695 0.009 右侧颈动脉扩张度 2.38±0.45 1.57±0.18 9.437 < 0.001 右侧CCA-ICA弯曲度 0.047(0.029, 0.058) 0.040(0.022, 0.058) -0.465 0.642 左侧颈动脉分叉角/° 70.59±13.39 66.81±9.95 1.335 0.186 左侧颈内动脉角/° 29.00(26.35, 34.35) 24.00(18.58, 33.55) -2.394 0.017 左侧ICA/CCA直径比 0.71±0.10 0.77±0.07 -3.311 0.001 左侧颈动脉扩张度 2.34±0.48 1.67±0.23 7.031 < 0.001 左侧CCA-ICA弯曲度 0.039(0.025, 0.053) 0.047(0.028, 0.063) -1.746 0.140 ICA: 颈内动脉; CCA: 颈总动脉。 表 3 斑块组斑块侧与非斑块侧的颈动脉几何形态参数比较(x±s)[M(Q1, Q3)]
几何形态参数 斑块侧 非斑块侧 t/Z P 颈动脉分叉角/° 69.10±13.74 67.20±13.48 0.942 0.347 颈内动脉角/° 29.15(26.2, 34.5) 25.95(21.85, 29.68) -4.075 < 0.001 ICA/CCA直径比 0.71±0.10 0.76±0.09 -3.152 0.001 颈动脉扩张度 2.37±0.47 2.05±0.52 4.343 < 0.001 CCA-ICA弯曲度 0.042(0.028, 0.055) 0.044(0.025, 0.054) -0.208 0.835 ICA: 颈内动脉; CCA: 颈总动脉。 表 4 ICA起始部粥样斑块影响因素的单因素和多因素Logistic回归分析
自变量 单因素分析 多因素分析 OR(95%CI) P OR(95%CI) P 年龄 1.01 (0.98~1.03) 0.703 0.99 (0.95~1.03) 0.697 性别 0.81 (0.47~1.42) 0.463 0.83 (0.38~1.82) 0.649 高血压病 1.37 (0.74~2.62) 0.329 1.99 (0.88~4.63) 0.103 糖尿病 1.28 (0.75~2.17) 0.367 1.18 (0.56~2.49) 0.661 高脂血症 1.12 (0.64~1.94) 0.701 1.25 (0.60~2.62) 0.546 HHcy 0.87 (0.42~1.74) 0.700 0.66 (0.26~1.61) 0.368 吸烟史 0.90 (0.44~1.78) 0.770 1.03 (0.40~2.60) 0.954 卒中史 1.22 (0.58~2.48) 0.596 0.82 (0.30~2.19) 0.695 冠心病 1.19 (0.34~3.84) 0.772 1.68 (0.35~7.98) 0.514 颈动脉分叉角 1.02 (1.00~1.04) 0.136 0.94 (0.91~0.97) 0.159 颈内动脉角 1.09 (1.05~1.13) < 0.001 1.08 (1.02~1.15) 0.007 ICA/CCA直径比 0.27 (0.15~0.46) < 0.001 0.18 (0.09~0.35) < 0.001 颈动脉扩张度 7.35(4.08~13.95) < 0.001 12.21(5.47~29.66) < 0.001 CCA-ICA弯曲度 0.86 (0.51~1.45) 0.576 0.62 (0.32~1.20) 0.160 ICA: 颈内动脉; CCA: 颈总动脉; HHcy: 高同型半胱氨酸血症。 -
[1] 康钦, 王豪, 宋嫣, 等. 彩色多普勒超声检测颈动脉内中膜厚度、斑块及颈动脉狭窄对缺血性脑卒中的诊断价值[J]. 实用临床医药杂志, 2019, 23(14): 43-45. doi: 10.7619/jcmp.201914011 [2] APAYDIN M, CETINOGLU K. Carotid angle in young stroke[J]. Clin Imaging, 2021, 70: 10-17. doi: 10.1016/j.clinimag.2020.10.020
[3] 刘伊桐, 黄燕琪, 李明利, 等. 颈动脉几何形态: 60岁及以下无高危因素人群颅内动脉粥样硬化的潜在预测指标[J]. 中国卒中杂志, 2022, 17(9): 925-931. doi: 10.3969/j.issn.1673-5765.2022.09.003 [4] 江培榕, 薛蕴菁, 赵锡海, 等. 高分辨率MRI评估早期颈动脉粥样硬化患者双侧颈动脉分叉几何形态差异[J]. 中国医学影像技术, 2020, 36(12): 1799-1803. doi: 10.13929/j.issn.1003-3289.2020.12.009 [5] STRECKER C, KRAFFT A J, KAUFHOLD L, et al. Carotid geometry and wall shear stress independently predict increased wall thickness-a longitudinal 3D MRI study in high-risk patients[J]. Front Cardiovasc Med, 2021, 8: 723860. doi: 10.3389/fcvm.2021.723860
[6] 杨雪, 胡勇, 向波, 等. CTA探讨颈动脉几何形态与粥样硬化斑块的关系[J]. 西部医学, 2019, 31(8): 1273-1277, 1282. doi: 10.3969/j.issn.1672-3511.2019.08.028 [7] JIANG P R, CHEN Z S, HIPPE D S, et al. Association between carotid bifurcation geometry and atherosclerotic plaque vulnerability: a Chinese atherosclerosis risk evaluation study[J]. Arterioscler Thromb Vasc Biol, 2020, 40(5): 1383-1391. doi: 10.1161/ATVBAHA.119.313830
[8] KWON W, KIM Y, KIM J, et al. Bilateral carotid artery geometry using magnetic resonance angiography: a 10-year longitudinal single center study[J]. Sci Rep, 2022, 12(1): 4932. doi: 10.1038/s41598-022-09062-7
[9] STULA I, KOJUNDZIC S L, GUIC M M, et al. Carotid artery stenosis in correlation with neck and carotid artery anatomy[J]. Vascular, 2022, 30(3): 524-531. doi: 10.1177/17085381211018603
[10] THOMAS J B, ANTIGA L, CHE S L, et al. Variation in the carotid bifurcation geometry of young versus older adults: implications for geometric risk of atherosclerosis[J]. Stroke, 2005, 36(11): 2450-2456. doi: 10.1161/01.STR.0000185679.62634.0a
[11] BIJARI P B, ANTIGA L, GALLO D, et al. Improved prediction of disturbed flow via hemodynamically-inspired geometric variables[J]. J Biomech, 2012, 45(9): 1632-1637. doi: 10.1016/j.jbiomech.2012.03.030
[12] PHAN T G, BEARE R J, JOLLEY D, et al. Carotid artery anatomy and geometry as risk factors for carotid atherosclerotic disease[J]. Stroke, 2012, 43(6): 1596-1601. doi: 10.1161/STROKEAHA.111.645499
[13] MÜLLER M D, AHLHELM F J, VON HESSLING A, et al. Vascular anatomy predicts the risk of cerebral ischemia in patients randomized to carotid stenting versus endarterectomy[J]. Stroke, 2017, 48(5): 1285-1292. doi: 10.1161/STROKEAHA.116.014612
[14] DOMANIN M, GALLO D, VERGARA C, et al. Prediction of long term restenosis risk after surgery in the carotid bifurcation by hemodynamic and geometric analysis[J]. Ann Biomed Eng, 2019, 47(4): 1129-1140. doi: 10.1007/s10439-019-02201-8
[15] NGUYEN K T, CLARK C D, CHANCELLOR T J, et al. Carotid geometry effects on blood flow and on risk for vascular disease[J]. J Biomech, 2008, 41(1): 11-19. doi: 10.1016/j.jbiomech.2007.08.012
[16] DEL BRUTTO V J, DONG C H, CULLISON K, et al. Internal carotid artery angle variations are poorly explained by vascular risk factors: the northern Manhattan study[J]. J Stroke Cerebrovasc Dis, 2022, 31(8): 106540. doi: 10.1016/j.jstrokecerebrovasdis.2022.106540
[17] ZHANG B, GU J Y, QIAN M, et al. Correlation between quantitative analysis of wall shear stress and intima-media thickness in atherosclerosis development in carotid arteries[J]. Biomed Eng Online, 2017, 16(1): 137. doi: 10.1186/s12938-017-0425-9
[18] SHAABAN A M, DUERINCKX A J. Wall shear stress and early atherosclerosis: a review[J]. AJR Am J Roentgenol, 2000, 174(6): 1657-1665. doi: 10.2214/ajr.174.6.1741657
[19] YAO X K, DAI Z Z, ZHANG X, et al. Carotid geometry as a predictor of In-stent neointimal hyperplasia-A computational fluid dynamics study[J]. Circ J, 2019, 83(7): 1472-1479. doi: 10.1253/circj.CJ-18-1152
[20] HUANG X, YIN X P, XU Y J, et al. Morphometric and hemodynamic analysis of atherosclerotic progression in human carotid artery bifurcations[J]. Am J Physiol Heart Circ Physiol, 2016, 310(5): H639-H647. doi: 10.1152/ajpheart.00464.2015
[21] LEE S W, ANTIGA L, SPENCE J D, et al. Geometry of the carotid bifurcation predicts its exposure to disturbed flow[J]. Stroke, 2008, 39(8): 2341-2347. doi: 10.1161/STROKEAHA.107.510644
[22] BIJARI P B, WASSERMAN B A, STEINMAN D A. Carotid bifurcation geometry is an independent predictor of early wall thickening at the carotid bulb[J]. Stroke, 2014, 45(2): 473-478.




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
