Role of fecal microbiota transplantation in treating slow transit constipation based on 16S rDNA detection
-
摘要:目的
通过16S rDNA检测技术探讨慢传输型便秘(STC)患者肠道菌群特点以及肠道菌群移植(FMT)的作用。
方法选取30例STC患者作为STC组,给予2个疗程的规范化FMT治疗; 选取同期20例健康成年人作为对照组。采用粪便16S rDNA测序技术对STC组和对照组肠道菌群进行比较,并对STC患者实施FMT前后的肠道菌群进行比较。
结果与对照组相比, STC组肠道菌群多样性降低,厚壁菌门相对丰度降低,而变形菌门和梭杆菌门相对丰度升高,差异均有统计学意义(P < 0.05)。经FMT治疗后,功能性便秘患者菌群多样性升高,差异有统计学意义(P < 0.05); 在门水平上, STC患者实施FMT后拟杆菌门和梭状菌门相对丰度降低,而厚壁菌门和变形菌门相对丰度升高,差异有统计学意义(P < 0.05)。STC组胃肠生活质量评分(GIQLI)、Wexner便秘评分均较治疗前下降,差异有统计学意义(P < 0.05)。STC组抑郁自评量表(SDS)评分、焦虑自评量表(SAS)评分、匹兹堡睡眠质量评分(PSQI)均较治疗前下降,差异有统计学意义(P < 0.05)。
结论STC患者肠道菌群易发生紊乱,菌群多样性及分布发生改变。FMT可通过调节肠道菌群来改善便秘症状,改变肠道菌群的分布和多样性。
-
关键词:
- 慢传输型便秘 /
- 肠道菌群 /
- 肠道菌群移植 /
- 16S rDNA检测技术
Abstract:ObjectiveTo investigate the characteristics of intestinal flora in patients with slow transit constipation (STC) and role of fecal microbiota transplantation (FMT) by 16S rDNA sequencing technology.
MethodsA total of 30 patients with STC were selected as STC group, and they were treated with standardized FMT therapy for two courses; another 20 healthy adults in the same period were selected as control group. Fecal 16S rDNA sequencing technology was used to compare the intestinal flora between the control group and the STC group, and the intestinal flora before and after FMT in patients with STC was compared.
ResultsCompared with the control group, the diversity of intestinal flora in the STC group decreased significantly, the relative abundance of Firmicutes decreased significantly, and the relative abundances of Proteobacteria and Fusobacteria increased significantly (P < 0.05). After FMT treatment, the diversity of flora in patients with functional constipation increased significantly (P < 0.05); at the phylum level, the relative abundances of Bacteroidetes and Fusobacteria decreased significantly while the relative abundances of Firmicutes and Proteobacteria increased significantly in STC patients after implementing FMT (P < 0.05). The Gastrointestinal Quality of Life Index (GIQLI) score and Wexner constipation score in the STC group decreased significantly after treatment when compared to those before treatment (P < 0.05). The Self-rating Depression Scale (SDS) score, Self-rating Anxiety Scale (SAS) score and Pittsburgh Sleep Quality Index (PSQI) score in the STC group decreased significantly after treatment when compared to those before treatment (P < 0.05).
ConclusionSTC patients are prone to disruption of intestinal flora, resulting in changes of microbial diversity and distribution. FMT can improve constipation symptoms and change the distribution and diversity of intestinal flora by regulating intestinal flora.
-
慢传输型便秘(STC)是一种常见的由非器质性疾病引起的便秘,主要表现为排便次数减少或粪便干硬伴排便困难。全球成年人慢性便秘的患病率为8.2%~32.9%[1], 中国人群为4.0%~10.0%[2-3]。STC的常见治疗策略包括调节生活方式、改变饮食习惯、应用泻药、生物反馈治疗以及通过益生菌、益生元和合成菌改善肠道菌群[3], 但存在容易复发、易导致一系列的副作用等问题,其中泻药的滥用导致便秘的治疗更为困难[4]。肠道菌群移植(FMT)是通过某种途径将健康人肠道中的功能菌群移植到患者肠道中,以调节肠道菌群,重建肠道微生态平衡,从而发挥治疗作用[5]。粪便悬浮液可通过鼻胃管或鼻十二指肠管、结肠镜、灌肠剂或胶囊进行移植[6-7]。
研究[8]发现, FMT对胃肠功能性疾病疗效显著,肠道菌群的改变与便秘及便秘相关症状密切相关,但其菌群变化和改善机制仍需要更多的临床和实验研究。肠道菌群研究通常采用16S rDNA检测进行分析,这也是目前微生物群落分析的“金标准” [9-10]。本研究基于16S rDNA基因测序,初步分析了STC患者的菌群多样性及分布特点,并同步分析了经FMT治疗后患者菌群分布的变化以及患者便秘症状和精神心理状态,现将结果报告如下。
1. 资料与方法
1.1 一般资料
STC患者诊断和纳入标准: ①成年人,性别不限; ②符合功能性便秘罗马Ⅳ诊断标准者,并经传输试验证实存在结肠慢传输(>48 h), 伴或不伴焦虑症和抑郁症; ③经口服药物或生物反馈疗法等综合治疗半年后仍便秘者; ④无严重心功能不全、严重肺功能障碍者,肝肾功能基本正常; ⑤患者接受上一次治疗后至少2周; ⑥ Barthel评分为60分以上者; ⑦直肠测压正常者,直肠功能正常,影像学检查无解剖异常(脱肛或肠套叠)导致对比剂排出困难; ⑧能配合观察不良反应、疗效和随访者; ⑨既往无肠道手术病史者; ⑩凝血功能正常者。排除标准: ①哺乳期女性或孕妇; ②各种原因导致的肠道屏障严重受损的患者; ③各种原因导致无法耐受机体所需一半以上热卡需求的肠内营养者; ④免疫缺陷病患者或正在进行免疫抑制治疗患者; ⑤合并乙型肝炎、结核、梅毒及艾滋病病毒抗体阳性者或任何传染性疾病急性期者; ⑥入组前已参加其他任何菌群治疗者; ⑦患者处于疾病末期或者可能在研究中死亡或试验期间研究者认定的可能影响受试者依从性和(或)完成试验相关操作的情况。
健康供体[11]的筛查: ①生理标准。18~25岁非孕期健康成人,传染病病原体检查阴性; 幽门螺杆菌、血液检查、粪便检查阴性。②精神心理标准。医生访谈认定心理状态良好,抑郁自评量表(SDS)、焦虑自评量表(SAS)、匹兹堡睡眠质量评分(PSQI)等评分正常。③个人史。生活方式健康,未参加过药物试验,无胃肠道疾病、精神神经系统疾病、过敏性疾病、恶性肿瘤及其他基础疾病和传染病史。近2周无胃肠道不适; 近3个月内未使用抗生素、抑酸剂或免疫抑制剂等; 无消化系统手术史; 无恶性肿瘤病史。④供体具有稳定性。每8周复查以上项目,供体应保持长期捐赠粪便。⑤根据受体要求,供体需在捐赠粪便前5 d限制部分受体不耐受或过敏食物。
本研究方案得到了十堰市国药东风总医院伦理审查委员会的审查和批准。FMT治疗在湖北省十堰市国药东风总医院胃肠外科进行,所有试验根据1964年《赫尔辛基宣言》及其修正案进行。患者和捐赠者均被告知FMT的潜在风险和益处及其实验性质。所有参与本研究的对象均签署知情同意书。
1.2 肠道和粪便取样及FMT
菌液制备、保存及检测: 采用手工法或智能微生物分离系统(南京法迈特)制备菌液,粪便悬液加入无菌甘油浓度达到10%, -80 ℃保存待用,储存时间最长4周; 使用前, 37 ℃融化,每次供体取样制备菌液前及患者FMT前留取小样,以供后期溯源。
治疗流程方案: 患者入院后经评估可以行FMT治疗,予以留取粪便送检16S rDNA检测,置入鼻空肠管,经平片确定鼻肠管在位后,行3 d肠道准备(万古霉素500 mg, 2次/d), 连续6 d通过鼻肠管给予100 mL新鲜菌液, 1次/d, 5 min内灌注完成。1个月后再行第2个疗程治疗。治疗结束后1个月复查粪便16S rDNA。
1.3 临床量表评估
疗效分析采用胃肠生活质量指数(GIQLI)、Wexner便秘评分及每天记录的排便日记。精神心理评估采用SDS、SAS、PSQI, 比较治疗前后血检结果,记录治疗期间及治疗后不良反应及严重不良事件。
1.4 粪便DNA提取、PCR扩增及测序和生物信息学方法
按照QIAsymphony DSP Virus/Pathogen Midi Kit (QIAGEN,德国)说明书操作提取粪便细菌总DNA,送往金域医学检验中心,建立16S rDNA文库并测序。经质量控制后的全基因组DNA样本采用Ion 16STM Metagenomics Kit(Thermo Scientific)对细菌中16S rDNA基因的高变区(v2-4-6、v3-6、7-9)进行PCR扩增。使用Ion ReporterTM软件内的Ion 16STM宏基因组学分析模块直接分析,对复杂微生物样品进行快速和版定量评估。采用Life Ion Torrent PGM二代测序仪进行测序。采用IR(Life)对样本进行聚类分析及菌群注释,以97%的一致性将所有的序列聚类成OTUs, 得到各个分类水平中的群落结构。计算alpha多样性指数,包括物种丰富度(Chao1)和物种多样性指数(Shannon指数)。测序和标准生物信息学数据处理由金域医学检验提供。
1.5 统计学分析
采用GraphPad Prism 9进行数据绘图,采用SPSS 26.0软件进行数据统计分析,定性资料比较采用χ2检验,独立定量资料采用独立样本t检验,配对定量资料采用配对样本t检验,不符合正态分布的数据采用中位数及四分位数间距(IQR)描述并采用非参数秩和检验(Man-Whitney U检验)。P<0.05为差异有统计学意义。
2. 结果
2.1 临床资料比较
共纳入30例STC患者为STC组,其中男13例,女17例,平均年龄(60.37±8.02)岁。共纳入20例健康志愿者为对照组,其中男8例,女12例,平均年龄(61.05±6.56)岁。STC组与对照组性别、年龄比较,差异无统计学意义(P>0.05)。所有便秘患者病程8~32年,平均(18.03±6.07)年,中位排便时间为6 d。
2.2 对照组和STC组粪便微生物群落比较
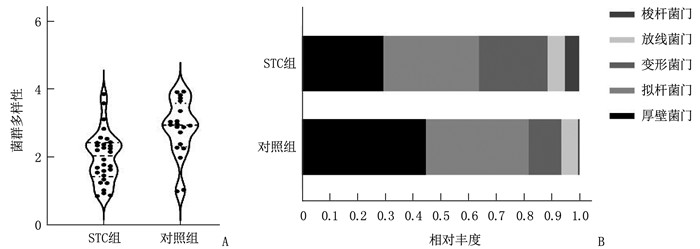
STC组菌群多样性较对照组菌群多样性低,差异有统计学意义(P<0.05); 在门水平上, STC组和对照组的类群主要由厚壁菌门、拟杆菌门、变形菌门、放线菌门、梭杆菌门组成,STC组厚壁菌门相对丰度较对照组降低,而变形菌门和梭状菌门较对照组升高,差异有统计学意义(P<0.05)。见图 1、表 1。
表 1 STC组和对照组粪便菌群比较(x ± s[M(IQR)]组别 菌群多样性 厚壁菌门 拟杆菌门 变形菌门 放线菌门 梭杆菌门 STC组 2.00±0.76 0.29±0.24 0.34±0.25 0.25±0.20 0.03(0.01~0.05) 0.01(0~0.07) 对照组 2.84±0.84* 0.45±0.21* 0.37±0.28 0.12±0.11* 0.05(0.01~0.07) 0.02(0~0.01)* 与STC组比较, *P<0.05。 2.3 实施FMT前后的粪便微生物群落动态变化
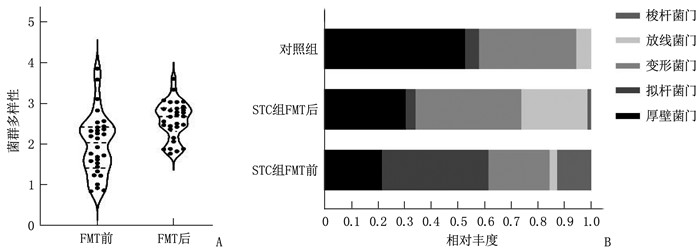
STC患者经FMT治疗后菌群多样性较治疗前升高,差异有统计学意义(P<0.05); 门水平上,便秘患者移植后拟杆菌门和梭杆菌门相对丰度较治疗前降低,而厚壁菌门和变形菌门相对丰度升高,差异有统计学意义(P<0.05)。见表 2、图 2。STC患者经FMT治疗后,在门水平上菌群分布也趋向于捐赠者的菌群分布。
表 2 STC患者FMT前后粪便菌群比较(x ± s)[M(IQR)]时点 菌群多样性 厚壁菌门 拟杆菌门 变形菌门 放线菌门 梭杆菌门 FMT前 2.00±0.76 0.29±0.24 0.34±0.25 0.25±0.20 0.03(0.01~0.05) 0.01(0~0.07) FMT后 2.60±0.47* 0.47±0.11* 0.10±0.10* 0.33±0.16* 0.04(0.01~0.09) 0(0~0.02)* 与FMT前比较, *P<0.05。 2.4 FMT治疗STC的疗效分析及心理评估
使用FMT治疗后,患者的Wexner便秘评分由原来的15.17分下降至正常水平(<8分), GIQLI评分也下降,差异均有统计学意义(P<0.05)。根据受试者每天记录的排便日记,可知STC患者的中位排便次数由每6 d 1次(IQR: 5.0~7.0)下降至每2 d 1次(IQR: 1.5~2.3), 可以认为FMT对STC有效,差异有统计学意义(P<0.05)。
共有6例患者诊断为轻度抑郁,其中5例经治疗后评分变为正常。6例患者诊断为轻度焦虑, 1例为中度焦虑,经治疗后评分全部变为正常。部分患者虽不能诊断焦虑或抑郁,但焦虑、抑郁症状明显改善,评分较治疗前下降明显。应用FMT治疗后,患者的SDS评分、SAS评分、PSQI均较治疗前下降,差异有统计学意义(P<0.05),见表 3。
表 3 STC患者实施FMT前后精神心理评估及疗效评估(x ± s)分 时点 SDS评分 SAS评分 PSQI GIQLI Wexner便秘评分 FMT前 44.73±9.18 44.50±7.62 10.03±3.98 66.63±16.36 15.17±1.49 FMT后 39.03±8.20* 35.77±7.47* 8.23±2.70* 50.40±16.13* 2.27±1.14* SDS: 抑郁自评量表; SAS: 焦虑自评量表; PSQI: 匹兹堡睡眠质量评分; GIQLI: 胃肠生活质量指数。与FMT前比较, *P<0.05。 2.5 FMT过程中并发症发生情况及安全性分析
经过2个疗程治疗后,患者体质量指数(BMI)、红细胞(RBC)、白细胞(WBC)、谷氨酸-丙酮酸转氨酶(ALT)、天门冬氨酸转氨酶(AST)、肌酐(CREA)、尿素(UREA)比较,差异无统计学意义(P>0.05), 见表 4。治疗期间有7例患者出现咽痛,考虑为插管引起,未予处置,治疗结束后症状消失。5例患者在注射菌液后轻微腹胀,通过实施注射前后步行0.5 h等措施后症状缓解。所有患者治疗期间及治疗后随访6个月均未出现其他不良反应及不良事件。
表 4 STC患者实施FMT前后BMI和血检指标比较(x ± s)时点 BMI/(kg/m2) RBC/(×1012/L) WBC/(×109/L) ALT/(U/L) AST/(U/L) CREA/(μmol/L) UREA/(mmol/L) FMT前 22.27±2.08 4.12±0.62 4.27±0.68 16.14±6.14 30.03±8.88 66.97±10.45 4.70±1.19 FMT后 22.30±2.02 4.14±0.55 4.29±0.51 14.57±4.17 28.03±5.88 66.67±9.85 4.49±0.93 3. 讨论
人类肠道微生物群丰富,其中90%以上是细菌,细菌数量繁多,高达数万亿株[12-13]。这些微生物群不仅能维持消化道结构及黏膜屏障的完整,还能参与宿主的营养及药物代谢,调节免疫系统功能,在维持肠道健康和生理功能方面发挥关键作用[14-16]。肠道微生物群以特定的数量和比例存在于不同的肠段中,并维持着共生或对抗的关系[17]。肠道微生物群及其代谢物和肠黏膜共同形成肠道微生态并处于动态平衡状态,当受到多种因素诱导时则会导致微生态失衡,进而导致各种疾病[18-19]。
FMT治疗作为一种新兴的治疗方式,目前其临床应用管理已发表于中国专家共识[11, 20], 并常规应用于慢性便秘患者,取得了临床成功,有效率达55.47%~72.73%[21-22]。本中心为确保疗效,在FMT前进行肠道准备,选择4周内的菌液进行移植,鼻空肠管作为移植途径。STC患者经过2个疗程规范化治疗,症状缓解明显。FMT对胃肠功能性疾病有一定疗效,但肠道菌群的机制和变化仍缺乏临床和实验室资料。本研究显示,便秘患者的菌群多样性显著低于健康人群(P<0.05); 菌群以厚壁菌门、拟杆菌门、变形菌门、放线菌门、梭状菌门为主,且在门水平上也存在分布差异,具体表现为便秘患者厚壁菌门显著降低(P<0.05), 而变形菌门和梭状菌门显著升高(P<0.05),拟杆菌门和放线菌门则无显著差异(P>0.05)。这与国内外部分研究[23-26]不尽相同,究其原因可能为: 肠道菌群构成受多种因素影响,例如地区、饮食、年龄、性别等; 慢性功能性便秘导致的因素较为复杂,除肠道微生态改变外,还与盆底肌功能障碍、中枢或外周神经源性障碍等有关[27]。检测患者移植前和移植后1个月粪便16S rDNA结果发现, STC患者经FMT治疗后,菌群多样性显著增加(P<0.05), 且在门水平上菌群分布也趋向于捐赠者的菌群分布。此外,移植途径对疗效及菌群多样性和分布均有影响。口服胶囊较难保证菌群稳定性; 结肠镜较易定植,但属侵入性操作,风险较高。鼻空肠管的临床疗效和可操作性都相对稳定,因此本研究选择鼻空肠管作为移植方法,且在治疗前进行肠道准备,并在FMT治疗1个疗程后进行第2个疗程巩固治疗,以此提高菌群定植能力和长期疗效。
此外,关于精神心理因素与功能性便秘的关系也日益受到重视,研究[28]表明慢性便秘合并焦虑和(或)抑郁的发生率高达52.7%。国外研究[29]也表明肠道中部分菌群丰度和抑郁症的发生相关,且抑郁、失眠等情绪障碍更易发生在便秘群体中[30], 而在对抑郁症患者使用益生菌辅助治疗时,患者抑郁症症状明显改善[31]。目前关于精神心理评估的方式种类繁多,选择不当可能会对患者和医生都产生负面影响,而自评量表因具有条目少、省时、患者依从性高等特点,被推荐作为简易评估患者心理状态的首选方案。本研究采用SAS、SDS及PSQI评估STC患者的精神心理状态,结果显示, STC患者焦虑和抑郁的伴随发病率分别为23.3%和20.0%, 且经过FMT治疗后,其焦虑评分和抑郁评分均显著下降(P<0.05)。精神心理因素与慢性便秘的关系及机制尚未完全明确,但研究[10, 14]表明可能与脑肠轴调节有关, FMT通过改变肠道菌群,不仅能缓解便秘症状,还能通过调控短链脂肪酸、神经递质等菌群代谢产物对肠神经系统近端神经元进行调控,经下丘脑-垂体-肾上腺轴完成对神经精神系统的控制与调节。
本研究的局限性: 样本量较少、来源地区单一,未将地域差异所引起的菌群差异纳入观察指标,后期需开展多中心、大样本、更长时间随访的临床研究; 此外,还应进一步进行菌株水平的鉴定和分类,更直观、更准确地对肠道菌群变化进行解读与分析,为进一步的个体化特定菌株移植提供思路与指导方案。
-
表 1 STC组和对照组粪便菌群比较(x ± s[M(IQR)]
组别 菌群多样性 厚壁菌门 拟杆菌门 变形菌门 放线菌门 梭杆菌门 STC组 2.00±0.76 0.29±0.24 0.34±0.25 0.25±0.20 0.03(0.01~0.05) 0.01(0~0.07) 对照组 2.84±0.84* 0.45±0.21* 0.37±0.28 0.12±0.11* 0.05(0.01~0.07) 0.02(0~0.01)* 与STC组比较, *P<0.05。 表 2 STC患者FMT前后粪便菌群比较(x ± s)[M(IQR)]
时点 菌群多样性 厚壁菌门 拟杆菌门 变形菌门 放线菌门 梭杆菌门 FMT前 2.00±0.76 0.29±0.24 0.34±0.25 0.25±0.20 0.03(0.01~0.05) 0.01(0~0.07) FMT后 2.60±0.47* 0.47±0.11* 0.10±0.10* 0.33±0.16* 0.04(0.01~0.09) 0(0~0.02)* 与FMT前比较, *P<0.05。 表 3 STC患者实施FMT前后精神心理评估及疗效评估(x ± s)
分 时点 SDS评分 SAS评分 PSQI GIQLI Wexner便秘评分 FMT前 44.73±9.18 44.50±7.62 10.03±3.98 66.63±16.36 15.17±1.49 FMT后 39.03±8.20* 35.77±7.47* 8.23±2.70* 50.40±16.13* 2.27±1.14* SDS: 抑郁自评量表; SAS: 焦虑自评量表; PSQI: 匹兹堡睡眠质量评分; GIQLI: 胃肠生活质量指数。与FMT前比较, *P<0.05。 表 4 STC患者实施FMT前后BMI和血检指标比较(x ± s)
时点 BMI/(kg/m2) RBC/(×1012/L) WBC/(×109/L) ALT/(U/L) AST/(U/L) CREA/(μmol/L) UREA/(mmol/L) FMT前 22.27±2.08 4.12±0.62 4.27±0.68 16.14±6.14 30.03±8.88 66.97±10.45 4.70±1.19 FMT后 22.30±2.02 4.14±0.55 4.29±0.51 14.57±4.17 28.03±5.88 66.67±9.85 4.49±0.93 -
[1] TAMURA A, TOMITA T, OSHIMA T, et al. Prevalence and self-recognition of chronic constipation: results of an Internet survey[J]. J Neurogastroenterol Motil, 2016, 22(4): 677-685.
[2] LONG Y, HUANG Z, DENG Y, et al. Prevalence and risk factors for functional bowel disorders in South China: a population based study using the Rome Ⅲ criteria[J]. Neurogastroenterol Motil, 2017, 29(1): 1-9.
[3] 中华医学会消化病学分会胃肠动力学组, 中华医学会消化病学分会功能性胃肠病协作组. 中国慢性便秘专家共识意见(2019, 广州)[J]. 中华消化杂志, 2019, 39(9): 577-598. doi: 10.3760/cma.j.issn.0254-1432.2019.09.001 [4] HUANG L S, ZHU Q, QU X, et al. Microbial treatment in chronic constipation[J]. Sci China Life Sci, 2018, 61(7): 744-752. doi: 10.1007/s11427-017-9220-7
[5] KELLY C R, KAHN S, KASHYAP P, et al. Update on fecal microbiota transplantation 2015: indications, methodologies, mechanisms, and outlook[J]. Gastroenterology, 2015, 149(1): 223-237. doi: 10.1053/j.gastro.2015.05.008
[6] 张发明, 龙楚彦, 李潘. 粪菌移植体系的整体整合医学思考[J]. 生命科学, 2017, 29(7): 651-659. doi: 10.13376/j.cbls/2017089 [7] BRUMBAUGH D E, DE ZOETEN E F, PYO-TWIST A, et al. An Intragastric Fecal Microbiota Transplantation Program for Treatment of Recurrent Clostridium difficile in Children is Efficacious, Safe, and Inexpensive[J]. J Pediatr, 2018, 194: 123-127, e1. doi: 10.1016/j.jpeds.2017.10.016
[8] ZHAO Y, YU Y B. Intestinal microbiota and chronic constipation[J]. SpringerPlus, 2016, 5(1): 1130. doi: 10.1186/s40064-016-2821-1
[9] WANG Y F, DONG Q B, HU S X, et al. Decoding microbial genomes to understand their functional roles in human complex diseases[J]. iMeta, 2022, 1(2): e14.
[10] WEI Y J, LI X Q, JI B Y, et al. Recent advances on the recovery, modulation and synthetic biology of gut microbiota and hosts[J]. Sci Sin-Vitae, 2022, 52(2): 249-265. doi: 10.1360/SSV-2021-0088
[11] 中华医学会肠外肠内营养学分会, 中国国际医疗保健促进交流会加速康复外科分会, 中国微生态治疗创新联盟, 等. 菌群移植标准化方法学的建立与临床应用中国专家共识[J]. 中华胃肠外科杂志, 2020, 23(S1): 5-13. [12] SENDER R, FUCHS S, MILO R. Are we really vastly outnumbered revisiting the ratio of bacterial to host cells in humans[J]. Cell, 2016, 164(3): 337-340. doi: 10.1016/j.cell.2016.01.013
[13] ROBERTSON S J, GOETHEL A, GIRARDIN S E, et al. Innate immune influences on the gut microbiome: lessons from mouse models[J]. Trends Immunol, 2018, 39(12): 992-1004. doi: 10.1016/j.it.2018.10.004
[14] HILL J H, ROUND J L. SnapShot: Microbiota effects on host physiology[J]. Cell, 2021, 184(10): 2796-2796, e1. doi: 10.1016/j.cell.2021.04.026
[15] AARNOUTSE R, ZIEMONS J, PENDERS J, et al. The clinical link between human intestinal microbiota and systemic cancer therapy[J]. Int J Mol Sci, 2019, 20(17): 4145. doi: 10.3390/ijms20174145
[16] 张成岗, 巩文静, 李志慧, 等. 双脑模型假说—由肠道菌群微生态构建的"菌脑"可能是人体对物质记忆的"第二大脑"[J]. 实用临床医药杂志, 2019, 23(6): 1-6. doi: 10.7619/jcmp.201906001 [17] LI Q, GUO L, WANG L, et al. Composition of "Gold Juice" Using an Ancient Method Based on Intestinal Microecology[J]. The Journal of International Medical Research, 2020, 48(9): 1-18.
[18] LIU T H, YANG Z S, ZHANG X M, et al. 16S rDNA analysis of the effect of fecal microbiota transplantation on pulmonary and intestinal flora[J]. 3 Biotech, 2017, 7(6): 370. doi: 10.1007/s13205-017-0997-x
[19] 刘昌孝. 肠道菌群与健康、疾病和药物作用的影响[J]. 中国抗生素杂志, 2018, 43(1): 1-14. doi: 10.3969/j.issn.1001-8689.2018.01.001 [20] 国家卫生健康委员会医院管理研究所, 中华医学会肠外肠内营养学分会, 中华医学会肠外肠内营养学分会肠道微生态协作组. 肠道菌群移植临床应用管理中国专家共识(2022版)[J]. 中华胃肠外科杂志, 2022, 25(9): 747-756. doi: 10.3760/cma.j.cn441530-20220725-00324 [21] 陈启仪, 杨波, 田宏亮, 等. 菌群移植3 932例治疗效果和并发症的5年随访分析[J]. 中华消化杂志, 2020, 40(11): 768-777. [22] 赵琪, 房永坤, 严成, 等. 经自然腔道取标本手术联合金陵术治疗顽固性便秘的疗效分析[J]. 实用临床医药杂志, 2022, 26(12): 69-75. doi: 10.7619/jcmp.20220092 [23] 刘启鸿, 方文怡, 胡露楠, 等. 基于16S rRNA高通量测序技术分析福州地区慢传输型便秘患者肠道菌群的变化[J]. 中国微生态学杂志, 2022, 34(3): 323-326. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGWS202203015.htm [24] 徐蓓蓓, 黄益, 叶毅, 等. 慢传输型便秘患者肠黏膜菌的变化特征[J]. 中国药物与临床, 2019, 19(24): 4293-4296. https://www.cnki.com.cn/Article/CJFDTOTAL-YWLC201924031.htm [25] GUO M Q, YAO J F, YANG F, et al. The composition of intestinal microbiota and its association with functional constipation of the elderly patients[J]. Future Microbiol, 2020, 15: 163-175. doi: 10.2217/fmb-2019-0283
[26] CHEN Y T, WU T, LU W W, et al. Predicting the role of the human gut microbiome in constipation using machine-learning methods: a meta-analysis[J]. Microorganisms, 2021, 9(10): 2149. doi: 10.3390/microorganisms9102149
[27] 徐岚, 谢忱, 殷民月, 等. 功能性便秘临床症状与肛门直肠测压特征的相关性研究[J]. 实用临床医药杂志, 2023, 27(2): 67-72. doi: 10.7619/jcmp.20221852 [28] 刘巍, 刘晓红, 方秀才, 等. 北京地区门诊慢性便秘患者多中心流行病学调查[J]. 胃肠病学, 2010, 15(2): 95-98. https://www.cnki.com.cn/Article/CJFDTOTAL-WIEC201002010.htm [29] CHEN L M, WANG D M, GARMAEVA S, et al. The long-term genetic stability and individual specificity of the human gut microbiome[J]. Cell, 2021, 184(9): 2302-2315. e12.
[30] 叶雅玲, 钱希, 吕璨. 睡眠障碍对老年慢性功能性便秘患者焦虑抑郁情绪和生活质量的影响分析[J]. 世界华人消化杂志, 2020, 28(11): 443-447. https://www.cnki.com.cn/Article/CJFDTOTAL-XXHB202011011.htm [31] MIYAOKA T, KANAYAMA M, WAKE R, et al. Clostridium butyricum MIYAIRI 588 as adjunctive therapy for treatment-resistant major depressive disorder: a prospective open-label trial[J]. Clin Neuropharmacol, 2018, 41(5): 151-155.
-
期刊类型引用(3)
1. 邹欣甫,王得昌,邹欣妍,王康锋,陈泽涛. 基于脑-肠轴理论的便秘型肠易激综合征伴焦虑抑郁中西医认识述要. 世界中医药. 2024(12): 1833-1839 .  百度学术
百度学术
2. 徐度天,张虹玺. 中医药治疗慢传输型便秘的实验研究进展. 中医临床研究. 2024(32): 113-118 .  百度学术
百度学术
3. 郭晗,刘斌. 慢传输型便秘发病机制研究进展. 中外医学研究. 2023(30): 181-184 .  百度学术
百度学术
其他类型引用(2)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
