Molecular mechanism of luteolin in treatment of cervical cancer based on network pharmacology and molecular docking technology
-
摘要:目的
基于网络药理学与分子对接技术探讨木犀草素治疗宫颈癌的分子机制。
方法运用中药系统药理学数据库与分析平台(TCMSP)对木犀草素进行类药性分析。分别在PharmMapper、Super-PRED和Swiss Target Prediction数据库中获取木犀草素作用靶点。运用GeneCards、OMIM和PharmGKB数据库获取宫颈癌相关靶点。通过EVenn获得木犀草素与宫颈癌的交集靶点, 并使用Cytoscape3.8.1构建“木犀草素-交集靶点-宫颈癌”网络图。利用STRIING数据库对交集靶点进行蛋白质互作(PPI)网络分析,筛选核心靶点。采用David数据库对靶点进行基因本体论(GO)基因功能分析、京都基因和基因组百科全书(KEGG)信号通路富集分析。利用PyMoL 2.6.0、AutoDockTool 1.5.7和OpenBabel 2.4.1软件开展核心靶点与木犀草素的分子对接。将核心靶点在GEPIA数据库中进行生存分析及泛癌分析。
结果获得木犀草素靶点449个、宫颈癌相关靶点1 334个; 木犀草素与宫颈癌交集靶点100个,其中核心靶点有24个,包括MMP2、HRAS、MAPK1、AKT1、RHOA和PGR等。GO和KEGG富集分析发现交集靶点参与生物过程455条,细胞组分70条,分子功能119条和143条KEGG信号通路。分子对接发现MMP2与木犀草素结合较好。宫颈癌患者生存曲线显示RHOA、MAPK1、MMP2和AKT1基因风险比率>1, HRAS和PGR的风险比率 < 1。泛癌分析显示HRAS和MAPK1在宫颈癌中高表达,并且HRAS有显著表达差异。
结论木犀草素通过多靶点、多途径的作用方式治疗宫颈癌。
Abstract:ObjectiveTo explore the molecular mechanism of luteolin in the treatment of cervical cancer based on network pharmacology and molecular docking technology.
MethodsThe drug-like properties of luteolin were analyzed by the Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform (TCMSP). The targets of luteolin were obtained from PharmMapper, Super-PRED, and Swiss Target Prediction databases. The targets related to cervical cancer were acquired from GeneCards, OMIM, and PharmGKB databases. The intersection targets of luteolin and cervical cancer were obtained through EVenn, and the "luteolin-intersection targets-cervical cancer" network diagram was constructed by Cytoscape 3.8.1. The STRING database was used to analyze the protein-protein interaction (PPI) network of intersection targets and screen the core targets. The Database for Annotation, Visualization and Integrated Discovery (David) was used to conduct Gene Ontology (GO) gene function analysis and Kyoto Encyclopedia of Genes and Genomes (KEGG) signaling pathway enrichment analysis of the targets. PyMoL 2.6.0, AutoDockTool 1.5.7 and OpenBabel 2.4.1 software were used to perform molecular docking between the core targets and luteolin. The survival analysis and pan-cancer analysis of the core targets were performed in the GEPIA database.
ResultsA total of 449 targets of luteolin and 1 334 targets related to cervical cancer were obtained; there were 100 intersection targets between luteolin and cervical cancer, of which 24 were core targets, including MMP2, HRAS, MAPK1, AKT1, RHOA and PGR. GO and KEGG enrichment analyses revealed that the intersection targets participated in 455 biological processes, 70 cellular components, 119 molecular functions, and 143 KEGG signaling pathways. Molecular docking revealed a good binding of MMP2 with luteolin. The survival curves of cervical cancer patients showed that the risk ratios of RHOA, MAPK1, MMP2 and AKT1 genes were greater than 1, while those of HRAS and PGR were less than 1. Pan-cancer analysis showed that HRAS and MAPK1 were highly expressed in cervical cancer, and HRAS had significant expression differences.
ConclusionLuteolin treats cervical cancer through a multi-target and multi-pathway mechanism.
-
Keywords:
- network pharmacology /
- cervical cancer /
- luteolin /
- molecular mechanism /
- molecular docking /
- signaling pathway
-
据GLOBOCAN 2020癌症统计数据[1]显示,宫颈癌已经成为女性第4位癌症死亡原因。2020年全球宫颈癌新发病例604 127例,死亡341 831例[2]。高危型人乳头瘤病毒(HPV)的持续感染是造成宫颈癌的主要危险因素[3]。近年来,随着宫颈癌癌前病变的早期筛查以及临床诊治手段的逐步提高,通过增加HPV疫苗接种和早期筛查可有效降低宫颈癌的发病率和病死率。低中收入国家HPV疫苗覆盖率低,宫颈癌筛查工作不完善,宫颈癌发病率和病死率仍高于发达国家[4]。在非转移性宫颈癌患者中,目前主要的治疗方法仍然是手术治疗和放射疗法,对转移性宫颈癌患者则采用放化疗联合治疗,患者迫切需要新型、高效、价廉、低毒性的治疗药物[5]。
研究[6]表明,中草药及其所含活性成分对宫颈癌细胞或动物肿瘤模型具有良好的治疗效果。木犀草素化学名为3, 4, 5, 7-四羟基黄酮,是一种天然黄酮,广泛存在于全叶青兰、辣椒、野菊花、金银花等植物中,具有抗炎、抗氧化、抗肿瘤、神经保护等作用[7-8]。木犀草素在治疗癌症方面的潜在作用机制包括诱导癌细胞凋亡、抑制癌细胞增殖、抑制血管生成和癌细胞转移[9]。木犀草素作为一种潜在的抗癌药物,可通过多种方式阻止癌症的发展[10]。当木犀草素和肿瘤坏死因子相关凋亡诱导配体(TRAIL)联合使用时,可增强HeLa宫颈癌细胞的凋亡效果,其中木犀草素可以通过抑制E6/E7基因,激活外源和内源信号通路,诱导宫颈癌细胞凋亡[11]。网络药理学基于现有数据库挖掘药物分子、疾病靶点,构建药物分子与疾病靶点之间的联系,利用基因本体论(GO)基因功能分析、京都基因和基因组百科全书(KEGG)信号通路富集分析,通过分子对接技术确认药物分子经具体靶点及信号通路发挥药物治疗功能的机制[12]。本研究基于网络药理学和分子对接技术探讨木犀草素抗宫颈癌的核心靶点与作用机制,为木犀草素在肿瘤治疗中的应用提供理论支持。
1. 材料与方法
1.1 木犀草素分析及靶点获取
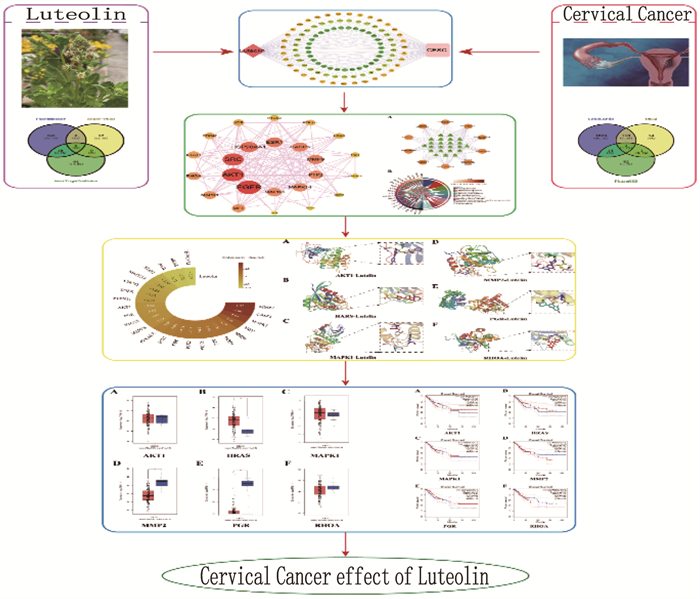
本研究流程见图 1。通过中药系统药理学数据库与分析平台(TCMSP, https://old.tcmsp-e.com/tcmsp.php), 以口服利用度(OB)≥30%和药物相似度(DL)≥0.18为标准,对木犀草素进行评价。以“Luteolin”为关键词,在PubChem(https://pubchem.ncbi.nlm.nih.gov)数据库中获得木犀草素分子结构的SDF格式,导入PharmMapper(https://lilab-ecust.cn/pharmmapper/index.html)[13]获取ID号,在Uniprot (https://www.uniprot.org/)数据库中将ID号转换为木犀草素的相关靶点; 以“Luteolin”为关键词直接在Super-PRED(https://prediction.charite.de/)[14]数据库中挖掘木犀草素作用靶点; 将“Luteolin”作为检索对象,通过PubChem数据库获取木犀草素SMILES编号,导入Swiss Target Prediction(http://swisstargetprediction.ch/)[15]数据库中获取木犀草素的潜在靶点。
1.2 宫颈癌靶点收集
将物种设定为“Homo sapiens”,以“Cervical Cancer”为关键词,在GeneCards (https://www.genecards.org/)[16]数据库中检索宫颈癌潜在靶点,并通过OMIM (https://www.omim.org/)[17]和PharmGKB(https://www.pharmgkb.org/)[18]数据库补充宫颈癌疾病靶点信息。
1.3 木犀草素-靶点-宫颈癌网络构建
使用Venny 2.1.0分别将木犀草素和宫颈癌的靶点取并集,再通过EVenn对木犀草素和宫颈癌的靶点取交集,得到木犀草素与宫颈癌的交集靶点。使用Cytoscape 3.8.1分别构建“成分-靶点”和“成分-靶点-疾病”网络图。
1.4 蛋白质互作(PPI)网络构建
将木犀草素与宫颈癌的共同靶点导入STRING数据库(https://cn.string-db.org/)[19], 物种设定为“Homo sapiens”, 置信度设为≥0.700, 得到蛋白质的相互作用关系TSV文件。将结果导入Cytoscape 3.8.1软件,按degree降序且颜色由深到浅对交集靶点进行可视化分析,对network进行分析并导出。将交集靶点以degree≥中间值2倍、介数中心性(betweenness centrality)≥中间值、接近系数(closeness coefficient)≥中间值为筛选条件,获得木犀草素抗宫颈癌的核心靶点。
1.5 GO和KEGG富集分析
将核心靶点导入DAVID(https://david.ncifcrf.gov/)[20]数据库,分别进行GO分析与KEGG富集分析,将结果导出,分别按照P值排序,选择GO-CC、GO-MF、GO-BP和KEGG前10条通路。使用微生信平台分别绘制GO-CC、GO-MF和GO-BP富集桑基图,使用SangerBox (http://sangerbox.com)绘制KEGG富集结果圈图。将KEGG富集分析的前10条通路和靶点导入Cystoscape 3.8.1, 进行可视化分析并构建“通路-靶点”网络。根据KEGG给出的通路,选取与宫颈癌相关的通路,通过BioRender(https://www.biorender.com/)网站绘制木犀草素抗宫颈癌信号通路图。
1.6 分子对接验证
分子对接用于探索大分子靶标结合位点内采用的配体构象,通过评估分子间识别过程中涉及的关键现象来估计配体-受体结合自由能[21]。将宫颈癌的核心靶点与木犀草素进行分子对接。将木犀草素的2D结构导入ChemBio 3D进行结构优化。在Uniprot数据库中分别搜索核心靶点,选择“Reviewed、Human”。选择Gene names相同的靶点,保留Entry, 通过PDB数据库对Entry进行检索,根据Homo sapiens、有无配体、分辨率、更新时间、Length接近全长和Unique Ligands个数少等条件进行筛选,下载其PDB format格式作为大分子。
通过PyMOL 2.6.0将大分子中的水分子和原始配体去除,以PDB格式导出。使用AutoDockTools 1.5.7软件进行分子对接。对大分子、小分子进行加氢、计算电荷数、确定原子的刚性结构,导出PDBQT格式。先后通过Grid和Docking面板对接后进行分析,记录对接的结合能,结合能≤-5 kcal/mol说明小分子与蛋白靶标的结合能力较强,即表示对接形成的结构较稳定,利用PyMOL 2.6.0进行可视化,将分子对接所得的结合能在Chiplot绘制热图。
1.7 生存分析和泛癌分析
基于GEPIA平台分别对核心靶点进行生存分析和泛癌分析。癌症类型选择宫颈鳞癌和腺癌(CESC)患者,将Group Cutoff取中位数(Cutoff-High为50%, Cutoff-Low为50%), 置信区间取95%并用虚线标记。生存曲线横坐标为观察时间,纵坐标为生存率,高表达基因标为红色实线,低表达基因标为蓝色实线。泛癌分析中,取核心靶点为Gene名字, Log2FC _cutoff取1, P-value Cutoff取0.01, 癌症名称选择CESC, 在宫颈癌和正常组织中分析核心靶点基因的表达差异,并绘制箱线图。
2. 结果
2.1 木犀草素靶点及宫颈癌靶点
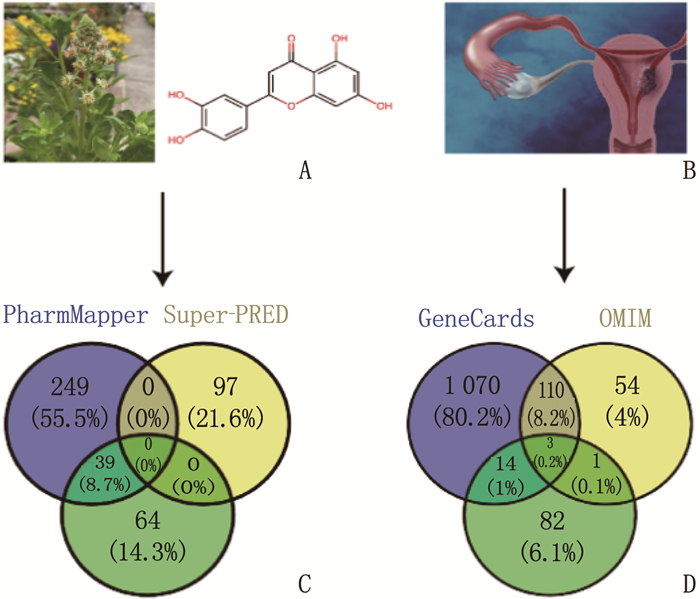
木犀草素OB为36.16%, DL为0.25, 远超TCMSP药物分子筛选标准。分别在PharmMapper、Super-PRED和Swiss Target Prediction数据库筛选得到288、103、97个木犀草素靶点,使用Venny 2.1.0对三者取并集,共获得449个木犀草素相关靶点。在OMIM、GeneCards、PharmGKB数据库分别获得宫颈癌靶点168、1 197、100个,使用Venny 2.1.0对三者取并集,最终筛选得到宫颈癌相关靶点1 334个。见图 2。
2.2 “木犀草素-靶点-宫颈癌”网络构建
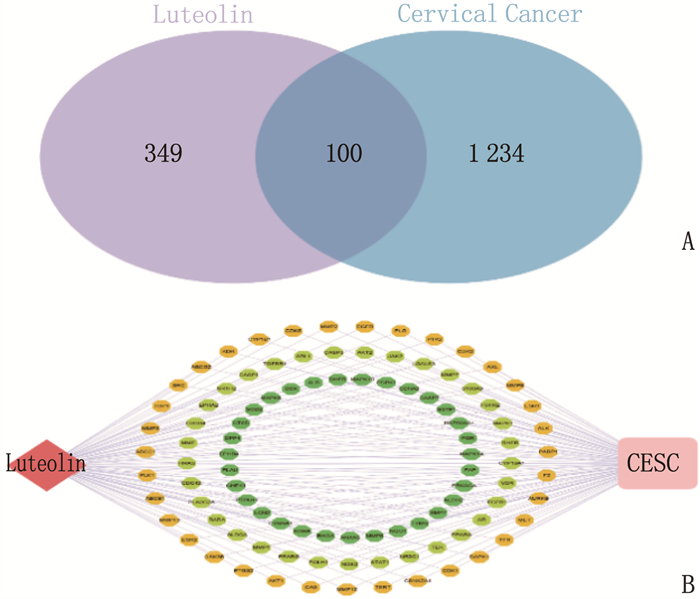
使用Venny 2.1.0分别将木犀草素和宫颈癌靶点取交集,之后将木犀草素和宫颈癌的交集靶点导入Cytoscape 3.8.1进行可视化分析,构建“木犀草素-靶点-疾病”网络,该网络包含1个成分节点,1个疾病节点,100个交集靶点节点。见图 3。
2.3 木犀草素抗宫颈癌核心靶点的筛选
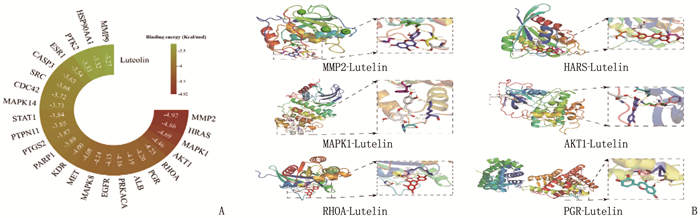
将所得的交集靶点信息导入STRING数据库,获取交集靶点蛋白质的相互作用关系; 通过Cytoscape 3.8.1分析结果拓扑属性,筛选出木犀草素核心靶点24个,并分别将交集靶点和核心靶点按degree值降序排序,构建PPI网络,交集靶点的PPI可视化网络包含100个节点,核心靶点PPI可视化网络包含24个节点。基于PPI网络获得的核心靶点,其中主要靶点为AKT1、MAPK1、HRAS、PGR、RHOA和MMP2, Degree值分别为36、20、16、14、13和12。见图 4。
2.4 基于GO、KEGG富集探讨木犀草素抗宫颈癌潜在机制
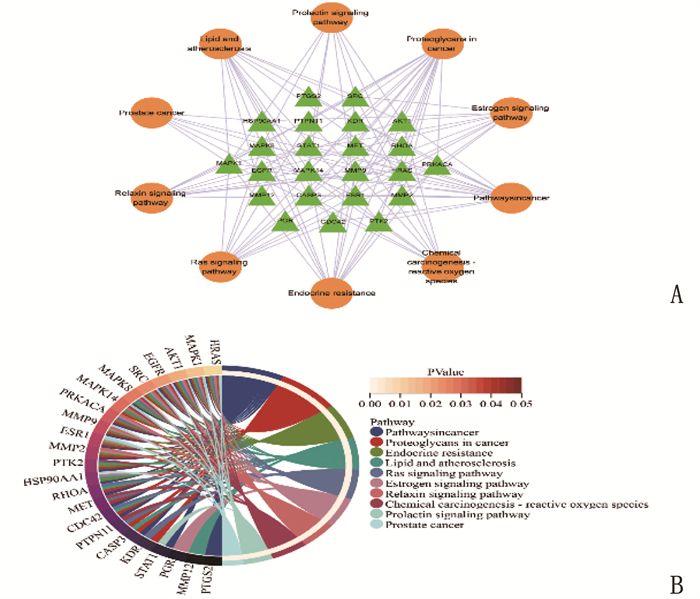
通过DAVID数据库对木犀草素抗宫颈癌的核心靶点进行GO分析。GO-CC、GO-BP、GO-MF分别包括70条、455条、119条,涉及细胞质(cytoplasm)、凋亡过程的负向调控(negative regulation of apoptotic process)、蛋白质磷酸化(protein phosphorylation)等。分别取前10条制作桑基图,见图 5。利用Cytoscape 3.8.1对KEEG的通路和靶点进行可视化分析,绘制“靶点-通路”网络; 对木犀草素抗宫颈癌靶点进行KEGG分析,获得通路143条,主要涉及癌症途径(pathways in cancer)、癌症中的蛋白聚糖(proteoglycans in cancer)和内分泌抗性(endocrine resistance)等信号通路,取其前10条通路制作弦图,见图 6。根据KEGG预测出的木犀草素与宫颈癌相关通路,在BioRender网站绘制木犀草素抗宫颈癌通路图,见图 7。
2.5 分子对接验证木犀草素与其抗宫颈癌核心靶点的相互作用
根据24个核心靶点所对应的配体分别与木犀草素进行分子对接,并将其结果通过热图可视化,结果显示,结合能最低的前6个核心靶点为MMP2、HRAS、MAPK1、AKT1、RHOA和PGR, 结合能均低于-5 kcal/mol。将这6个核心靶点通过PyMOL 2.6.0分别与木犀草素进行可视化分析,见图 8。
2.6 生存曲线和泛癌分析
通过GEPIA平台,分别将MMP2、HRAS、MAPK1、AKT1、RHOA和PGR与CESC进行生存分析,结果显示RHOA、MAPK1、MMP2和AKT1的风险比率(HR)>1, 说明这些高表达基因为宫颈癌风险因素。低表达基因HRAS和PGR的HR < 1, 分别为0.8和0.74, 说明HRAS和PGR的低表达为宫颈癌保护因素。见图 9。
通过GEPIA平台分别对MMP2、HRAS、MAPK1、AKT1、RHOA和PGR进行泛癌分析,结果显示HRAS和MAPK1在CESC中高表达,其中HRAS的表达有显著差异, AKT1、MMP2、PGR和RHOA在CESC中低表达,其中PGR的表达有显著差异。见图 10。
3. 讨论
中医药是中国的宝贵财富,具有独特的疾病预防和治疗优势,与新一代医学研究范式相吻合,并且催生了网络药理学的发展[22]。网络药理学是一种综合运用网络科学、系统生物学和药理学等多学科知识的研究方法,旨在揭示药物与疾病之间的相互作用关系[23]。网络药理学可以帮助理解药物的多靶点、多组分协同作用和多途径调控作用,为药物研发和临床应用提供新的思路和方法[24]。网络药理学和中医药是相互促进、相互补充的关系,可以共同推动药物研发和临床实践的发展[25]。
本研究基于网络药理学技术明确了木犀草素治疗宫颈癌的核心靶点及作用机制,在宫颈癌患者中验证了核心靶点的差异表达情况及对患者生存时间的影响,进一步使用分子对接证实了木犀草素与核心靶点的直接相互作用。
AKT1是PI3K/AKT/mTOR信号通路中的关键信号传导分子之一。AKT1被激活后,可以磷酸化下游靶蛋白,从而调控细胞的增殖、存活和代谢等生物学过程[26]。AKT1的过度表达或突变与多种癌症的发生和发展密切相关, AKT1可以通过多种机制促进肿瘤细胞的生存与增殖,并与抗癌药物的耐药性相关[27]。此外, AKT1还参与癌细胞的迁移和侵袭,突显了其在癌症进展和转移中的重要性[28-32]。研究[33]发现AKT1在宫颈癌细胞中起到促进细胞增殖的作用。GDF15通过磷酸化AKT1和Erk1/2来促进宫颈癌细胞的增殖,并且通过与ErbB2受体结合来激活PI3K/AKT和MAPK/ERK信号通路[34]。
根据GO和KEGG富集分析结果,木犀草素可能通过靶向MMP2、HRAS、MAPK1、AKT1、RHOA和PGR等核心靶点,抑制细胞增殖、迁移、生长,诱导细胞凋亡,从而对宫颈癌发挥治疗作用。GO富集分析结果表明,木犀草素通过相同蛋白质结合(identical protein binding)、ATP结合(ATP binding)、酶结合(enzyme binding)等途径发挥生物功能,影响受体复合物(receptor complex)、细胞溶质(cytosol)、细胞核(nucleus)、大分子复合物(macromolecular complex)、黏着斑(focal adhesion)等作用,因此有助于细胞对蛋白质自磷酸化(protein autophosphorylation)、蛋白质磷酸化(protein phosphorylation)和细胞凋亡过程的负调控(negative regulation of apoptotic process)反应。KEGG富集分析表明,木犀草素在宫颈癌中的作用机制主要与Pathways in cancer、Proteoglycans in cancer及Ras signaling pathway中的RAF-MEK-ERK (MAPK)信号通路以及PI3K-AKT信号通路的RAS激活有关。
HRAS是RAS家族的一员, HRAS基因突变是人类癌症中较少见的RAS基因突变,仅占4%。HRAS突变导致RAS蛋白处于持续激活状态,从而促进细胞增殖、生存和转移[35]。HRAS突变还可以通过激活下游效应蛋白的信号通路来促进癌症的发展[36]。RAF/MEK/ERK和PI3K/AKT途径是HRAS基因调节细胞周期的2个主要信号通路。RAF/MEK/ERK途径和PI3K/AKT途径的激活可以促进细胞周期,而HRAS基因过表达可以通过这2个途径来缩短G1期[37]。相关研究[38]表明, HRAS与蛋白磷酸酶2A的癌性抑制因子(CIP2A)合作,通过MEK/ERK信号通路促进上皮-间质转化(EMT)过程,进而促进宫颈癌的发展。此外,本研究通过分子对接验证了木犀草素与其抗宫颈癌核心靶点的直接相互作用,如MMP2、HRAS与木犀草素具有较强的结合亲和力。
综上所述,本研究基于网络药理学方法,探究木犀草素通过多靶点、多途径抑制宫颈癌的作用机制。通过分子对接初步验证了木犀草素与宫颈癌靶点之间的相互作用关系,为进一步体外实验验证提供了理论基础。本研究的结果是基于网络药理学开展的数据挖掘与分析,具有一定预测效果,但缺少实验验证,因此木犀草素抗宫颈癌的分子机制需要进一步通过实验来阐明。
-
-
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. doi: 10.3322/caac.21660
[2] SINGH D, VIGNAT J, LORENZONI V, et al. Global estimates of incidence and mortality of cervical cancer in 2020: a baseline analysis of the WHO Global Cervical Cancer Elimination Initiative[J]. Lancet Glob Health, 2023, 11(2): e197-e206.
[3] REVATHIDEVI S, MURUGAN A K, NAKAOKA H, et al. APOBEC: a molecular driver in cervical cancer pathogenesis[J]. Cancer Lett, 2021, 496: 104-116.
[4] RAHANGDALE L, MUNGO C, O'CONNOR S, et al. Human papillomavirus vaccination and cervical cancer risk[J]. BMJ, 2022, 379: e070115.
[5] GOPU P, ANTONY F, CYRIAC S, et al. Updates on systemic therapy for cervical cancer[J]. Indian J Med Res, 2021, 154(2): 293-302.
[6] 程志新, 公瑞, 张玥, 等. 基于数据挖掘的臁疮古医案内治法用药规律研究[J]. 实用临床医药杂志, 2023, 27(10): 25-30. doi: 10.7619/jcmp.20230525 [7] FRANZA L, CARUSI V, NUCERA E, et al. Luteolin, inflammation and cancer: Special emphasis on gut microbiota[J]. Biofactors, 2021, 47(2): 181-189.
[8] NABAVI S F, BRAIDY N, GORTZI O, et al. Luteolin as an anti-inflammatory and neuroprotective agent: a brief review[J]. Brain Res Bull, 2015, 119(Pt A): 1-11.
[9] RAKOCZY K, KACZOR J, SOŁTYK A, et al. Application of luteolin in neoplasms and nonneoplastic diseases[J]. Int J Mol Sci, 2023, 24(21): 15995.
[10] CHEN Y H, WU J X, YANG S F, et al. Synergistic combination of luteolin and Asiatic acid on cervical cancer in vitro and in vivo[J]. Cancers, 2023, 15(2): 548.
[11] DING L L, CHEN H, BI G L, et al. Improved anti-cancer effects of luteolin@ZIF-8 in cervical and prostate cancer cell lines[J]. Heliyon, 2024, 10(6): e28232.
[12] LI X, WEI S Z, NIU S Q, et al. Network pharmacology prediction and molecular docking-based strategy to explore the potential mechanism of Huanglian Jiedu Decoction against sepsis[J]. Comput Biol Med, 2022, 144: 105389.
[13] LIU X F, OUYANG S S, YU B, et al. PharmMapper server: a web server for potential drug target identification using pharmacophore mapping approach[J]. Nucleic Acids Res, 2010, 38(Web Server issue): W609-W614.
[14] GALLO K, GOEDE A, PREISSNER R, et al. SuperPred 3. 0: drug classification and target prediction-a machine learning approach[J]. Nucleic Acids Res, 2022, 50(W1): W726-W731.
[15] DAINA A, MICHIELIN O, ZOETE V. SwissTargetPrediction: updated data and new features for efficient prediction of protein targets of small molecules[J]. Nucleic Acids Res, 2019, 47(W1): W357-W364.
[16] DAINA A, ZOETE V. Application of the SwissDrugDesign online resources in virtual screening[J]. Int J Mol Sci, 2019, 20(18): 4612.
[17] STELZER G, ROSEN N, PLASCHKES I, et al. The GeneCards Suite: From Gene Data Mining to Disease Genome Sequence Analyses[J]. Curr Protoc Bioinformatics, 2016, 54: 30-33.
[18] AMBERGER J S, BOCCHINI C A, SCOTT A F, et al. OMIM. org: leveraging knowledge across phenotype-gene relationships[J]. Nucleic Acids Res, 2019, 47(D1): D1038-D1043.
[19] STEVENS T, SANGKUHL K, BROWN J T, et al. PharmGKB summary: methylphenidate pathway, pharmacokinetics/pharmacodynamics[J]. Pharmacogenet Genomics, 2019, 29(6): 136-154.
[20] DENNIS G, SHERMAN B T, HOSACK D A, et al. DAVID: database for annotation, visualization, and integrated discovery[J]. Genome Biol, 2003, 4(9): R60.
[21] MUEGGE I, HU Y. Recent advances in alchemical binding free energy calculations for drug discovery[J]. ACS Med Chem Lett, 2023, 14(3): 244-250.
[22] WANG X, WANG Z Y, ZHENG J H, et al. TCM network pharmacology: a new trend towards combining computational, experimental and clinical approaches[J]. Chin J Nat Med, 2021, 19(1): 1-11.
[23] NOGALES C, MAMDOUH Z M, LIST M, et al. Network pharmacology: curing causal mechanisms instead of treating symptoms[J]. Trends Pharmacol Sci, 2022, 43(2): 136-150. doi: 10.1016/j.tips.2021.11.004
[24] HAN X, WANG C, LI R, et al. Network target theory and network pharmacology: Next generation drug research in medicine using AI models[J]. Int J Clin Pharmacol Ther, 2024, 62(4): 151-154.
[25] 许继升, 宋爱莉, 王静, 等. 基于数据挖掘和网络药理学探讨宋爱莉教授治疗肉芽肿性小叶性乳腺炎的经验[J]. 实用临床医药杂志, 2023, 9(5): 49-54. doi: 10.7619/jcmp.20222860 [26] 金雪宁, 林飞, 冯心怡, 等. 基于网络药理学的多西他赛治疗绒毛膜癌的作用机制研究[J]. 实用临床医药杂志, 2022, 8(1): 18-21. doi: 10.7619/jcmp.20213494 [27] ZHANG Q, YANG M Y, QU Z, et al. Corrigendum to "Autophagy prevention sensitizes AKTi-1/2-induced anti-hepatocellular carcinoma cell activity in vitro and in vivo" [Biochem. Biophys. Res. Commun. (2016) 480(3) 334-340][J]. Biochem Biophys Res Commun, 2021, 565: 99.
[28] YANG Y F, HUANG L, ZHANG N, et al. SUMOylation of annexin A6 retards cell migration and tumor growth by suppressing RHOU/AKT1-involved EMT in hepatocellular carcinoma[J]. Cell Commun Signal, 2024, 22(1): 206.
[29] 金雪宁, 林飞, 冯心怡, 等. 基于网络药理学的多西他赛治疗绒毛膜癌的作用机制研究[J]. 实用临床医药杂志, 2022, 26(1): 18-21. doi: 10.7619/jcmp.20213494 [30] 罗字呈, 杨桃, 陈江, 等. 基于网络药理学及生物信息学探讨藤梨汤治疗结直肠癌的作用机制研究[J]. 空军军医大学学报, 2024(3): 311-318. [31] 曾炼, 杨桃, 陈江, 等. 基于网络药理学和分子对接探讨艾迪注射液治疗结直肠癌作用机制研究[J]. 空军军医大学学报, 2024, 45(03): 319-325. [32] 甘丽华, 李志敏, 何泉, 杨坤, 郭超峰. 基于分子对接技术与网络药理学分析方法的半夏-黄连药对治疗胃食管反流病的作用机制研究[J]. 实用临床医药杂志, 2021, 25(21): 1-6. doi: 10.7619/jcmp.20211655 [33] LI L, SHEN F R, CHENG Q X, et al. SLC5A3 is important for cervical cancer cell growth[J]. Int J Biol Sci, 2023, 19(9): 2787-2802.
[34] LI S, MA Y M, ZHENG P S, et al. GDF15 promotes the proliferation of cervical cancer cells by phosphorylating AKT1 and Erk1/2 through the receptor ErbB2[J]. J Exp Clin Cancer Res, 2018, 37(1): 80.
[35] LIU Z, LIU F, WANG F, et al. CircZNF609 promotes cell proliferation, migration, invasion, and glycolysis in nasopharyngeal carcinoma through regulating HRAS via miR-338-3p[J]. Mol Cell Biochem, 2021, 476(1): 175-186.
[36] PAN Y B, GU Y M, LIU T H, et al. Epitranscriptic regulation of HRAS by N6-methyladenosine drives tumor progression[J]. Proc Natl Acad Sci U S A, 2023, 120(14): e2302291120.
[37] RIEKE D T, SCHR?DER S, SCHAFHAUSEN P, et al. Targeted treatment in a case series of AR+, HRAS/PIK3CA co-mutated salivary duct carcinoma[J]. Front Oncol, 2023, 13: 1107134.
[38] BAI H, SONG M, JIAO R, et al. DUSP7 inhibits cervical cancer progression by inactivating the RAS pathway[J]. J Cell Mol Med, 2021, 25(19): 9306-9318.




 下载:
下载:





 苏公网安备 32100302010246号
苏公网安备 32100302010246号