Clinical characteristics and risk factors of borderline ovarian tumors
-
摘要:目的 分析卵巢交界性肿瘤(BOTs)的危险因素和临床特征。方法 选取275例经手术病理确诊BOTs患者作为研究对象, 另随机选取275例经手术病理确诊卵巢良性上皮性肿瘤(BETs)患者进行病例对照研究。收集并比较患者的年龄、生育情况、症状体征、超声影像学检查结果、血清肿瘤标志物水平、手术记录及病理结果等临床资料,分析BOTs的危险因素。根据术后病理类型将部分BOTs患者分为卵巢交界性黏液性肿瘤(MBOTs)组和卵巢交界性浆液性肿瘤(SBOTs)组,比较2组患者的临床特征。结果 超声显示成分以实性为主、囊壁有乳头、有血流信号、糖类抗原125(CA125)及糖类抗原199(CA199)升高均为BOTs的独立危险因素(P < 0.05); BOTs与BETs在肿瘤最大径、肿瘤位置、是否多房和血清癌胚抗原水平方面比较,差异无统计学意义(P > 0.05)。MBOTs组超声显示肿瘤最大径≥10 cm、多房、有血流信号和CA199升高者占比均高于SBOTs组,超声显示肿瘤位于双侧、有乳头和CA125升高者占比均低于SBOTs组,差异有统计学意义(P < 0.05)。结论 BOTs患者超声检查显示以实性成分为主、多房、有乳头、有血流信号且血清CA125、CA199水平升高,临床可据此与BETs相鉴别。肿瘤最大径≥10 cm、多房、有血流信号提示MBOTs可能性大; MBOTs更易出现CA199升高, SBOTs更易出现CA125升高。
-
关键词:
- 卵巢交界性肿瘤 /
- 超声检查 /
- 肿瘤标志物 /
- 卵巢交界性黏液性肿瘤 /
- 卵巢交界性浆液性肿瘤
Abstract:Objective To analyze the risk factors and the clinical characteristics of borderline ovarian tumors(BOTs).Methods A total of 275 patients who were diagnosed as BOTs were selected as study objects. Another 275 patients diagnosed as ovarian benign epithelial tumor (BETs) by surgical pathology were selected as controls. The clinical data such as age, fertility, symptoms and signs, results of ultrasonography, serum tumor markers, surgical and pathological results were collected and compared. The risk factors of BOTs were analyzed. According to postoperative pathological types, some BOTs patients were divided into mucinous borderline ovarian tumors (MBOTs) group and serous borderline ovarian tumors (SBOTs) group, and the clinical characteristics of the two groups were compared.Results Ultrasonographic findings showed that solid tumor, papilla-shaped protuberance on the cystic wall, blood flow signals and elevated carbohydrate antigen 125 (CA125) and carbohydrate antigen 199(CA199) were independent risk factors for BOTs. Compared with BETs, there were no significant differences in tumor maximum diameter, location of tumors, multilocular tumors, and serum carcinoembryonic antigen level in BOTs(P > 0.05). The proportions of the maximal diameter ≥10 cm, multilocular tumors, blood flow signal and the increased CA199 in patients of the MBOTs group were higher than those in the SBOTs group, while the proportions of bilateral tumor, papilla-shaped protuberance on the cystic wall and elevated CA125 were lower than those in the SBOTs group(P < 0.05).Conclusion The ultrasonographic findings show that solid components, multilocular tumors, papilla-shaped protuberance, blood flow signal and elevated serum levels of CA125 and CA199 occur in BOTs patients, and they are helpful to distinguish BOTs from BETs. The maximum diameter of the tumor ≥10 cm, multilocular tumors and blood flow signal suggest higher possibility of MBOTs. MBOTs patients are more likely to have elevated CA199, while those with SBOTs are more likely to have elevated CA125. -
肺癌目前是中国发病率、死亡率最高的恶性肿瘤, 5年生存率低于18%[1]。非小细胞肺癌(NSCLC)在肺癌中占比为85%, 其治疗方式主要有手术、化放疗、靶向药物治疗等[2]。研究[3]发现,多数NSCLC患者存在表皮生长因子受体(EGFR)基因突变,且EGFR合并肿瘤抑制基因共同突变的患者往往预后不良。EGFR酪氨酸激酶抑制剂(EGFR-TKI)是EGFR突变NSCLC患者的首选治疗方案,但治疗一段时间后会出现耐药现象,影响预后[4]。
微小RNA(miRNA)是广泛参与机体各种生命活动的单链小分子非编码RNA, 其在肿瘤中的差异表达及在肿瘤细胞增殖、凋亡、侵袭、化疗抵抗、耐药等方面的调控作用已被广泛报道[5-7]。研究[8-9]发现, miR-338-3p在肺癌等多种肿瘤中表达下调,有望成为NSCLC治疗的潜在靶点。研究[10]显示, miR-338-3p可通过EGFR信号通路抑制NSCLC细胞增殖、迁移及侵袭,但对NSCLC细胞出现EGFR-TKI耐药的作用研究较少。本研究探讨miR-338-3p对EGFR-TKI吉非替尼耐药的肺癌细胞株PC-9/GR凋亡及程序性死亡配体1(pPD-L1)表达的影响,并初步分析其作用机制。
1. 材料与方法
1.1 试剂与仪器
人肺腺癌细胞株PC-9及其吉非替尼耐药细胞株PC-9/GR(货号YS2301C、YS3629C)购自美国ATCC; RPMI-1640培养液(货号CP680110A)购自上海冠导生物工程有限公司; 吉非替尼、Annexin V-FITC/PI凋亡检测试剂盒、信号转导和转录激活因子1(STAT1)抑制剂Fludarabine(货号JKLN007404a、JKMK1417B、JKLN020840)购自上海经科化学科技有限公司; MTT溶液(货号JK3297)购自上海晶抗生物工程有限公司; miR-338-3p NC、miR-338-3p模拟物及miR-338-3p、U6引物购自柏业贸易(上海)有限公司; 兔抗p-STAT1、兔抗STAT1、兔抗PD-L1、兔抗Bcl-2、兔抗Bax、兔抗GAPDH、羊抗兔二抗(货号ab109461、ab210524、ab243877、ab196495、ab232479、ab181603、ab133470)购自美国abcam。NAPCO-8800型培养箱购自美国Shellab; MODEL550型酶标仪、GS-800型凝胶扫描成像系统购自美国Bio-Rad; Lightcycler 480II型荧光定量PCR仪购自德国Roche; CytoFLEX型流式细胞仪购自美国Beckman coulter。
1.2 方法
1.2.1 细胞培养与分组
PC-9细胞、PC-9/GR细胞复苏后接种于含10%胎牛血清的RPMI-1640培养液,放入37 ℃、5% CO2细胞培养箱中,生长至覆盖培养瓶80%面积,弃培养液,用0.25%胰蛋白酶消化,显微镜下观察到细胞回缩变圆后终止消化,吹打为单细胞并更换新鲜培养液重悬,按1∶2比例分瓶传代。
取传代3次的对数生长期PC-9、PC-9/GR细胞,按2×104个/mL接种于细胞培养板,分别加0、0.25、0.5、1、2、4、8 μmol/L吉非替尼,检测细胞增殖情况,以确定吉非替尼用量。此外,传代3次的对数生长期PC-9、PC-9/GR细胞按2×104个/mL接种于细胞培养板培养后,检测细胞中miR-338-3p表达。
将PC-9/GR细胞分为对照组、miR-338-3p NC组、miR-338-3p组和STAT1抑制剂组。其中miR-338-3p NC组、miR-338-3p组、STAT1抑制剂组细胞贴壁后,分别转染miR-338-3p NC、miR-338-3p模拟物和miR-338-3p模拟物,培养48 h后采用实时荧光定量聚合酶链反应(qRT-PCR)检测转染效果,之后4组均在培养液中加1 μmol/L吉非替尼, STAT1抑制剂组同时加100 μmol/L的STAT1抑制剂Fludarabine,细胞继续培养,进行后续实验。
1.2.2 qRT-PCR检测细胞中miR-338-3p表达
细胞培养48 h, 使用TRIzol提取细胞总RNA并检测其浓度、纯度,以RNA为模板行逆转录合成cDNA后进行qRT-PCR反应,用荧光定量PCR仪检测,U6为内参基因, miR-338-3p表达结果以2-△△Ct法表示。miR-338-3p上游引物: 5′-GTCAGTTCCAGCATCAGTGATT-3′, 下游引物: 5′-GTGCAGGGTCCGAGGT-3′; U6上游引物: 5′-GCTCGCTTCGGCAGCACA-3′, 下游引物: 5′-GAGGTATTCGCA CCAGAGGA-3′。
1.2.3 MTT法检测细胞增殖
细胞培养48 h, 每孔加10 μL MTT溶液,培养4 h, 弃上清,每孔加150 μL DMSO, 震荡5 min, 用酶标仪检测490 nm波长处吸光度(OD)值,计算增殖率(%)=OD实验组/OD对照组×100%。
1.2.4 流式细胞仪检测细胞凋亡
细胞培养48 h, 收集后按照Annexin V-FITC/PI凋亡试剂盒说明书进行处理,避光孵育15 min, 使用流式细胞仪进行检测。
1.2.5 蛋白印迹(WB)法检测细胞中p-STAT1、STAT1、PD-L1、Bcl-2、Bax蛋白表达情况
细胞培养48 h, 收集细胞,使用RIPA裂解液提取总蛋白,BCA法定量。取20 μg蛋白样本, 95 ℃水浴5 min使蛋白变性,上样,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,转移目的蛋白至聚偏二氟乙烯(PVDF)膜,用封闭液封闭1.5 h, 放入一抗(兔抗p-STAT1、兔抗STAT1、兔抗PD-L1、兔抗Bcl-2、兔抗Bax、兔抗GAPDH)稀释液(均1∶1 500)中孵育过夜,放入羊抗兔二抗(辣根过氧化物酶标记)稀释液(1∶2 000)中室温孵育1 h, 化学发光法显色,凝胶扫描成像系统扫描图像,分析条带灰度值。目的蛋白表达量以目的蛋白与GAPDH灰度值的比值表示。
1.3 统计学分析
采用SPSS 21.0软件进行数据分析。数据以(x±s)表示,多组间比较采用单因素方差分析,两两比较进行SNK-q检验。P < 0.05表示差异有统计学意义。
2. 结果
2.1 PC-9细胞、PC-9/GR细胞在不同浓度吉非替尼作用下的增殖率
随着吉非替尼浓度逐渐升高, PC-9细胞、PC-9/GR细胞的增殖率呈逐渐降低趋势(P < 0.05); 当吉非替尼浓度升高至1.00 μmol/L时, PC-9细胞与PC-9/GR细胞增殖率比较,差异有统计学意义(P < 0.05)。故后续实验均采用1.00 μmol/L作为吉非替尼的处理浓度。见表 1。
表 1 不同浓度吉非替尼作用下PC-9细胞、PC-9/GR细胞的增殖率比较(n=6)(x±s)吉非替尼浓度/(μmol/L) 增殖率/% PC-9细胞 PC-9/GR细胞 0 100.00±0 100.00±0 0.25 92.53±4.48* 94.12±4.79 0.50 82.74±4.16* 86.23±4.38* 1.00 70.80±4.05* 76.72±4.16*# 2.00 58.16±4.25* 65.02±4.14*# 4.00 49.89±4.50* 57.64±4.42*# 8.00 40.06±3.88* 49.22±3.95*# 与0 μmol/L比较, *P < 0.05; 与PC-9细胞比较, #P < 0.05。 2.2 PC-9细胞、PC-9/GR细胞中miR-338-3p表达情况
与PC-9细胞miR-338-3p表达水平(1.00±0)相比, PC-9/GR细胞中miR-338-3p表达水平(0.84±0.12)降低,差异有统计学意义(t=3.266, P=0.008)。
2.3 转染后PC-9/GR细胞miR-338-3p表达情况
对照组与miR-338-3p NC组的miR-338-3p表达水平比较,差异无统计学意义(P > 0.05); 与对照组、miR-338-3p NC组相比, miR-338-3p组、STAT1抑制剂组的miR-338-3p表达水平均升高,差异有统计学意义(P < 0.05); miR-338-3p组与STAT1抑制剂组的miR-338-3p表达水平比较,差异无统计学意义(P > 0.05)。见表 2。
表 2 转染后PC-9/GR细胞miR-338-3p表达水平比较(n=6)(x±s)组别 miR-338-3p 对照组 1.00±0 miR-338-3p NC组 1.12±0.15 miR-338-3p组 2.20±0.17*# STAT1抑制剂组 2.16±0.18*# 与对照组比较, *P < 0.05;
与miR-338-3p NC组比较, #P < 0.05。2.4 各组PC-9/GR细胞增殖情况
对照组与miR-338-3p NC组的PC-9/GR细胞增殖率比较,差异无统计学意义(P > 0.05); 与miR-338-3p NC组相比, miR-338-3p组PC-9/GR细胞增殖率降低,差异有统计学意义(P < 0.05); 与miR-338-3p组相比, STAT1抑制剂组PC-9/GR细胞增殖率升高,差异有统计学意义(P < 0.05)。见表 3。
表 3 各组PC-9/GR细胞增殖率比较(n=6)(x±s)组别 增殖率/% 对照组 100.00±0 miR-338-3p NC组 98.63±5.65 miR-338-3p组 52.35±5.02* STAT1抑制剂组 82.68±5.46# 与miR-338-3p NC组比较, *P < 0.05;
与miR-338-3p组比较, #P < 0.05。2.5 各组PC-9/GR细胞凋亡情况
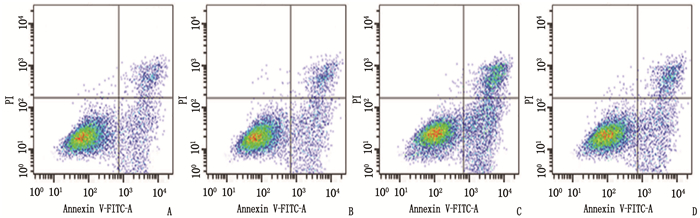
对照组与miR-338-3p NC组的PC-9/GR细胞凋亡率比较,差异无统计学意义(P > 0.05); 与miR-338-3p NC组相比, miR-338-3p组PC-9/GR细胞凋亡率升高,差异有统计学意义(P < 0.05); 与miR-338-3p组相比, STAT1抑制剂组PC-9/GR细胞凋亡率降低,差异有统计学意义(P < 0.05)。见图 1、表 4。
表 4 各组PC-9/GR细胞凋亡率比较(n=6)(x±s)组别 凋亡率/% 对照组 18.56±1.55 miR-338-3p NC组 18.04±1.60 miR-338-3p组 35.92±2.69* STAT1抑制剂组 22.83±2.15# 与miR-338-3p NC组比较, *P < 0.05;
与miR-338-3p组比较, #P < 0.05。2.6 各组PC-9/GR细胞中p-STAT1、STAT1、PD-L1、Bcl-2、Bax蛋白表达情况
对照组与miR-338-3p NC组的PC-9/GR细胞中p-STAT1/STAT1、PD-L1、Bcl-2、Bax蛋白表达水平比较,差异无统计学意义(P > 0.05); 与miR-338-3p NC组相比, miR-338-3p组PC-9/GR细胞中p-STAT1/STAT1、Bax蛋白表达水平升高, PD-L1、Bcl-2蛋白表达水平降低,差异有统计学意义(P < 0.05); 与miR-338-3p组相比, STAT1抑制剂组PC-9/GR细胞中p-STAT1/STAT1、Bax蛋白表达水平降低, PD-L1、Bcl-2蛋白水平升高,差异有统计学意义(P < 0.05)。见图 2、表 5。
表 5 各组PC-9/GR细胞中p-STAT1、STAT1、PD-L1、Bcl-2、Bax蛋白表达水平比较(n=6)(x±s)组别 p-STAT1/STAT1 PD-L1/GAPDH Bcl-2/GAPDH Bax/GAPDH 对照组 0.45±0.06 0.72±0.06 0.80±0.07 0.43±0.05 miR-338-3p NC组 0.47±0.07 0.71±0.07 0.83±0.07 0.40±0.05 miR-338-3p组 0.83±0.07* 0.39±0.05* 0.40±0.04* 0.88±0.06* STAT1抑制剂组 0.60±0.06# 0.58±0.06# 0.65±0.05# 0.57±0.06# 与miR-338-3p NC组比较, *P < 0.05; 与miR-338-3p组比较, #P < 0.05。 3. 讨论
肺癌是全球肿瘤相关死亡的主要原因,近年来其发病率不断升高。EGFR是原癌基因c-erb B1的表达产物,属于酪氨酸激酶受体,在多种肿瘤中高表达[11]。研究[12-13]发现,存在EGFR突变的亚洲肺癌患者占50%, 这部分人群体内肺癌细胞增殖、生长依赖于突变的EGFR, 用EGFR-TKI对其进行治疗,临床疗效较好,但治疗1年内均会出现获得性耐药。故解决EGFR-TKI耐药问题是肺癌治疗方面比较棘手的问题。吉非替尼是第一代EGFR-TKI, 本研究通过设置吉非替尼浓度梯度,检测PC-9细胞、PC-9/GR细胞的增殖率,最终选择1.00 μmol/L作为后续实验中PC-9/GR细胞的吉非替尼用药浓度。
研究[14-15]表明, miRNA在肿瘤组织中异常表达,发挥促癌或抑癌基因的作用,参与肿瘤发生及进展。由于miRNA具有肿瘤病理的特异性,常被认为可作为一种新型靶点用于肿瘤的靶向治疗。研究[16]显示, miRNA不仅可介导肿瘤细胞增殖、凋亡、迁移等生物学行为,在肿瘤发生放化疗抵抗、耐药等过程中亦发挥重要作用。miR-338-3p是miR-338家族成员,在食道癌、头颈部鳞状细胞癌、肾嫌色细胞癌、肾乳头状肾细胞癌、肺鳞癌及甲状腺癌中表达显著下调,而在肝细胞癌、结肠腺癌及肾透明细胞癌中表达显著上调[17-18]。本研究发现, PC-9/GR细胞中miR-338-3p表达水平较PC-9细胞显著降低,提示miR-338-3p在EGFR-TKI耐药的PC-9细胞中差异表达,其低表达可能参与PC-9细胞发生EGFR-TKI耐药的机制。通过转染miR-338-3p模拟物,上调miR-338-3p在PC-9/GR细胞中的表达水平后, PC-9/GR细胞增殖率显著降低,凋亡率显著升高,细胞中Bcl-2家族促凋亡成员Bax蛋白表达水平显著升高,抑凋亡成员Bcl-2蛋白水平[19]显著降低,提示上调miR-338-3p可一定程度逆转PC-9/GR细胞的EGFR-TKI耐药,抑制细胞增殖,并诱导细胞凋亡。PD-L1是在多种肿瘤细胞表面高表达的因子,可帮助肿瘤细胞发生免疫逃逸,其高表达往往与肿瘤预后不良呈正相关[20-22]。上调miR-338-3p表达后, PC-9/GR细胞中PD-L1表达水平显著降低,提示miR-338-3p可能抑制PC-9/GR细胞发生免疫逃逸,进而促进细胞凋亡。
STAT1是一种信号传导与转录活化因子蛋白,能从各个角度参与对细胞生长、分化、存活及凋亡的调控,目前多被认为是肿瘤抑制因子[23-24]。孙思博等[25]研究表明, STAT家族成员在NSCLC获得性耐药过程中发挥重要作用。本研究显示, miR-338-3p表达上调后, PC-9/GR细胞中p-STAT1/STAT1蛋白表达水平显著升高,提示STAT1激活参与miR-338-3p逆转PC-9/GR细胞的EGFR-TKI耐药过程。在miR-338-3p表达上调基础上,加入STAT1抑制剂抑制STAT1激活后, miR-338-3p表达无显著变化,细胞增殖率显著升高,凋亡率显著降低,细胞中Bax蛋白表达水平显著降低, PD-L1、Bcl-2蛋白表达水平显著升高,进一步提示miR-338-3p逆转PC-9/GR细胞的EGFR-TKI耐药过程可能与激活STAT1有关。
综上所述, miR-338-3p表达上调可激活STAT1, 抑制EGFR-TKI耐药肺癌细胞株PC-9/GR细胞中PD-L1表达,并诱导细胞凋亡,这可能为临床解决EGFR-TKI耐药问题提供理论依据。
-
表 1 BOTs患者与BETs患者资料的单因素分析[n(%)]
因素 BOTs(n=275) BETs(n=275) χ2 P OR 95%CI 肿瘤最大径 ≥10 cm 114(41.45) 67(24.36) 17.425 < 0.001 2.198 1.526~3.167 < 10 cm 161(58.55) 208(75.64) 肿瘤位置 双侧 38(13.82) 19(6.91) 6.341 0.011 2.160 1.212~3.852 单侧 237(86.18) 256(93.09) 成分以实性为主 是 120(43.64) 12(4.36) 114.125 < 0.001 16.968 9.076~31.723 否 155(56.36) 263(95.64) 乳头 有 135(49.09) 36(13.09) 81.504 < 0.001 6.402 4.195~9.770 无 140(50.91) 239(86.91) 多房 是 100(36.36) 36(13.09) 38.771 < 0.001 3.794 2.473~5.820 否 175(63.64) 239(86.91) 血流信号 有 125(45.45) 27(9.82) 85.542 < 0.001 7.654 4.819~12.158 无 150(54.55) 248(90.18) CA125 升高 110(40.00) 14(5.09) 93.968 < 0.001 12.429 6.894~22.406 不升高 165(60.00) 261(94.91) CA199 升高 52(18.91) 12(4.36) 26.895 < 0.001 5.111 2.661~9.815 不升高 223(81.09) 263(95.64) CEA 升高 6(2.18) 4(1.45) 0.102 0.752 1.511 0.422~5.415 不升高 269(97.82) 271(98.55) BOTs: 卵巢交界性肿瘤; BETs: 卵巢良性上皮性肿瘤; CA125: 糖类抗原125; CA199: 糖类抗原199; CEA: 癌胚抗原。 表 2 MBOTs组与SBOTs组资料的单因素分析结果
因素 MBOTs(n=112) SBOTs(n=131) χ2 P OR 95%CI 肿瘤最大径 ≥10 cm 81(72.32) 26(19.85) 65.305 < 0.001 10.552 5.812~19.158 < 10 cm 31(27.68) 105(80.15) 肿瘤位置 双侧 3(2.68) 29(22.14) 18.328 < 0.001 0.097 0.029~0.328 单侧 109(97.32) 102(77.86) 成分以实性为主 是 48(42.86) 73(55.73) 3.501 0.054 0.596 0.358~0.991 否 64(57.14) 58(44.27) 乳头 有 46(41.07) 75(57.25) 5.692 0.014 0.520 0.312~0.868 无 66(58.93) 56(42.75) 多房 是 67(59.82) 25(19.08) 40.877 < 0.001 6.313 3.546~11.238 否 45(40.18) 106(80.92) 血流信号 有 65(58.04) 53(40.46) 6.781 0.007 2.035 1.219~3.398 无 47(41.96) 78(59.54) CA125 升高 33(29.46) 63(48.09) 8.004 0.004 0.451 0.265~0.767 不升高 79(70.54) 68(51.91) CA199 升高 28(25.00) 13(9.92) 8.739 0.002 3.026 1.480~6.184 不升高 84(75.00) 118(90.08) CEA 升高 6(5.36) 1(0.76) 3.060 0.051 7.358 0.872~62.075 不升高 106(94.64) 130(99.24) MBOTs: 卵巢交界性黏液性肿瘤; SBOTs: 卵巢交界性浆液性肿瘤; CA125: 糖类抗原125; CA199: 糖类抗原199; CEA: 癌胚抗原。 表 3 BOTs危险因素的多因素Logistic回归分析
因素 P OR 95%CI 肿瘤最大径≥10 cm 0.138 1.495 0.879~2.544 双侧 0.894 1.062 0.436~2.590 成分以实性为主 < 0.001 10.848 5.291~22.243 有乳头 < 0.001 6.962 4.134~11.722 多房 0.164 1.468 0.855~2.519 有血流信号 < 0.001 3.202 1.792~5.704 CA125升高 < 0.001 6.165 3.022~12.578 CA199升高 0.031 2.537 1.090~5.904 BOTs: 卵巢交界性肿瘤; CA125: 糖类抗原125;
CA199: 糖类抗原199。表 4 MBOTs影响因素的多因素Logistic回归分析
因素 P OR 95%CI 肿瘤最大径≥10 cm < 0.001 8.358 3.897~17.926 双侧 0.008 0.145 0.035~0.610 成分以实性为主 0.309 1.471 0.700~3.090 有乳头 0.021 0.438 0.218~0.881 多房 < 0.001 4.045 1.953~8.380 有血流信号 0.031 2.145 1.070~4.298 CA125升高 < 0.001 0.169 0.072~0.395 CA199升高 0.013 3.582 1.308~9.807 MBOTs: 卵巢交界性黏液性肿瘤; CA125: 糖类抗原125;
CA199: 糖类抗原199。 -
[1] HAUPTMANN S, FRIEDRICH K, REDLINE R, et al. Ovarian borderline tumors in the 2014 WHO classification: evolving concepts and diagnostic criteria[J]. Virchows Arch, 2017, 470(2): 125-142. doi: 10.1007/s00428-016-2040-8
[2] FISCHEROVA D, ZIKAN M, DUNDR P, et al. Diagnosis, treatment, and follow-up of borderline ovarian tumors[J]. Oncol, 2012, 17(12): 1515-1533. doi: 10.1634/theoncologist.2012-0139
[3] ZHANG W, JIA S Z, XIANG Y, et al. Factors associated with misdiagnosis of frozen section of mucinous borderline ovarian tumor[J]. J Int Med Res, 2019, 47(1): 96-104. doi: 10.1177/0300060518795582
[4] GUILLAUME A, PIRRELLO O. Preservation of fertility in surgery of benign and borderline malignant ovarian tumors[J]. J Visc Surg, 2018, 155: S17-S21. doi: 10.1016/j.jviscsurg.2018.04.001
[5] SKÍRNISDÓTTIR I, GARMO H, WILANDER E, et al. Borderline ovarian tumors in Sweden 1960-2005: trends in incidence and age at diagnosis compared to ovarian cancer[J]. Int J Cancer, 2008, 123(8): 1897-1901. doi: 10.1002/ijc.23724
[6] SOBICZEWSKI P, DANSKA-BIDZINSKA A, RZEPKA J, et al. Evaluation of selected ultrasonographic parameters and marker levels in the preoperative differentiation of borderline ovarian tumors and ovarian cancers[J]. Arch Gynecol Obstet, 2012, 286(6): 1513-1519. doi: 10.1007/s00404-012-2453-9
[7] TAL O, GANER HERMAN H, GLUCK O, et al. Characteristics and prognosis of borderline ovarian tumors in pre and postmenopausal patients[J]. Arch Gynecol Obstet, 2020, 302(3): 693-698. doi: 10.1007/s00404-020-05652-w
[8] 甘雅端, 吕国荣, 杨舒萍, 等. 卵巢上皮性肿瘤超声鉴别特征及预测模型[J]. 中华超声影像学杂志, 2020, 29(6): 534-539. doi: 10.3760/cma.j.cn131148-20191111-00694 [9] ALCÁZAR J L, ROYO P, JURADO M, et al. Triage for surgical management of ovarian tumors in asymptomatic women: assessment of an ultrasound-based scoring system[J]. Ultrasound Obstet Gynecol, 2008, 32(2): 220-225. doi: 10.1002/uog.5401
[10] LERTKHACHONSUK A A, BURANAWONGTRAKOON S, LEKSKUL N, et al. Serum CA19-9, CA-125 and CEA as tumor markers for mucinous ovarian tumors[J]. J Obstet Gynaecol Res, 2020, 46(11): 2287-2291. doi: 10.1111/jog.14427
[11] 傅晓明, 高波, 周科峰, 等. 多层螺旋CT对卵巢囊腺瘤及囊腺癌的鉴别诊断及其影像学特点[J]. 医学影像学杂志, 2019, 29(7): 1181-1184. https://www.cnki.com.cn/Article/CJFDTOTAL-XYXZ201907035.htm [12] GOTLIEB W H, SORIANO D, ACHIRON R, et al. CA 125 measurement and ultrasonography in borderline tumors of the ovary[J]. Am J Obstet Gynecol, 2000, 183(3): 541-546. doi: 10.1067/mob.2000.105940
[13] 朱峰. CT检查在卵巢交界性浆液性肿瘤与黏液性肿瘤鉴别中的效果[J]. 中国当代医药, 2020, 27(33): 158-160. doi: 10.3969/j.issn.1674-4721.2020.33.046 [14] YILMAZ E, SAHIN N, KOLELI I, et al. Retrospective analysis of borderline ovarian tumors: outcomes at a single center[J]. Acta Clin Croat, 2019, 58(1): 29-36. http://www.ncbi.nlm.nih.gov/pubmed/31363322
[15] 谢燕, 周园红, 金红梅, 等. 卵巢恶性混合型生殖细胞肿瘤的发病机制及诊疗进展[J]. 巴楚医学, 2019, 2(2): 118-121. https://www.cnki.com.cn/Article/CJFDTOTAL-BMJJ201902027.htm [16] MOROTTI M, MENADA M V, GILLOTT D J, et al. The preoperative diagnosis of borderline ovarian tumors: a review of current literature[J]. Arch Gynecol Obstet, 2012, 285(4): 1103-1112. doi: 10.1007/s00404-011-2194-1
[17] 章萍, 陈春. 循证护理在腹腔镜手术治疗卵巢肿瘤患者中的应用效果[J]. 实用临床医药杂志, 2017, 21(10): 105-108. doi: 10.7619/jcmp.201710032 -
期刊类型引用(2)
1. 王亚菲,杨英捷,孙清华,田琴,任婕. HPV16阳性宫颈癌细胞株中miR-497-5p靶向PD-L1的免疫调控作用. 肿瘤预防与治疗. 2023(03): 200-207 .  百度学术
百度学术
2. 刘银凤,袁关利,刘佳妮,韩猛,吕骥,吴梓政. 趋化因子配体13在三阴性乳腺癌中的表达及临床意义. 实用临床医药杂志. 2022(18): 57-62 .  本站查看
本站查看
其他类型引用(2)
计量
- 文章访问数: 248
- HTML全文浏览量: 172
- PDF下载量: 10
- 被引次数: 4




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号
