Study on total flavonoids from Selaginella uncinata in inhibiting malignant behavior of colorectal cancer cells through circular RNA circ_0006528 pathway
-
摘要:目的 探讨翠云草总黄酮对结直肠癌细胞恶性生物学行为的影响及可能机制。方法 体外培养结直肠癌细胞Caco-2, 用不同剂量(10、20、40 μg/mL)翠云草总黄酮干预24 h、或转染环状RNA circ_0006528小干扰RNA至Caco-2细胞后培养24 h、或用40 μg/mL的翠云草总黄酮干预转染circ_0006528过表达载体的Caco-2细胞24 h, 然后用检测细胞存活与生长比色法(MTT)、克隆形成实验、划痕实验和流式细胞术分别检测细胞活性、克隆形成数、迁移和凋亡。Western Blot检测Bax和Bcl-2蛋白表达,实时荧光定量聚合酶链反应(qRT-PCR)检测circ_0006528和miR-330-3p表达。双荧光素酶报告基因实验验证circ_0006528和miR-330-3p调控关系。结果 Caco-2细胞经翠云草总黄酮干预后,细胞活性、克隆形成数、迁移距离和细胞中Bcl-2蛋白、circ_0006528的表达均降低,而凋亡率和Bax蛋白、miR-330-3p的表达升高,差异有统计学意义(P < 0.05), 且呈剂量依赖性。干扰circ_0006528后, Caco-2细胞活性、克隆形成数、迁移距离和Bcl-2蛋白表达降低,细胞凋亡率和Bax蛋白表达升高,差异有统计学意义(P < 0.05)。circ_0006528靶向负调控miR-330-3p。过表达circ_0006528逆转了翠云草总黄酮对Caco-2细胞增殖、迁移和凋亡及miR-330-3p表达的影响。结论 翠云草总黄酮可能通过调控circ_0006528/miR-330-3p轴,抑制结直肠癌细胞增殖和迁移,并促进细胞凋亡。Abstract:Objective To investigate the effect of total flavonoids from Selaginella uncinata on malignant biological behavior of colorectal cancer cells and its possible mechanism.Methods Colorectal cancer cells Caco-2 were cultured in vitro. After Caco-2 cells were treated with different concentrations (10, 20 and 40 μg/mL) of total flavonoids from Selaginella uncinata for 24 hours, or Caco-2 cells were transfected with circ_0006528 small interfering RNA, or Caco-2 cells that transfected with circ_0006528 overexpression vector were treated with 40 μg/mL total flavonoids from Selaginella uncinata for 24 hours, methyl thiazolyl tetrazolium (MTT) assay, clone formation assay, scratch assay and flow cytometry were used to detect cell proliferation viability, the number of colony formation, migration and apoptosis, respectively. The expressions of Bax and Bcl-2 proteins were detected by western blot, and the expressions of circ_0006528 and miR-330-3p were detected by quantitative real-time polymerase chain reaction (qRT-PCR). The regulatory relationship between circ_0006528 and miR-330-3p was verified by dual luciferase reporter gene assay.Results After Caco-2 cells were intervened with total flavonoids from Selaginella uncinata, cell viability, the number of clone formation, migration distance and the expression of Bcl-2 protein as well as circ_0006528 in Caco-2 cells were significantly decreased, but apoptosis rate and the expression of Bax protein and miR-330-3p were significantly increased (P < 0.05), and they were dose-dependent. After circ_0006528 interference, Caco-2 cell activity, the number of clone formation, migration distance and Bcl-2 protein expression were significantly decreased, while apoptosis rate and Bax protein expression were significantly increased (P < 0.05). The circ_0006528 negatively regulated miR-330-3p by targeting. Overexpression of circ_0006528 reversed the effects of total flavonoids from Selaginella uncinata on proliferation, migration and apoptosis of Caco-2 cells and expression of miR-330-3p.Conclusion The total flavonoids from Selaginella uncinata may inhibit the proliferation and migration of colorectal cancer cells and promote cells apoptosis by regulating the circ_0006528/miR-330-3p axis.
-
结直肠癌是威胁人类生命健康的消化系统恶性肿瘤,其治疗缺乏有效药物[1]。翠云草属于卷柏科卷柏属植物,主要分布在中国广东、云南和贵州等省份,具有清热解毒、止血、利湿等作用。近年来,研究[2]发现,翠云草富含黄酮类物质,尤其是双黄酮,例如穗花杉双黄酮、罗波斯塔双黄酮。研究[3]显示,翠云草总黄酮可能通过降低ERK通路的活性抑制肺癌细胞增殖,并阻碍细胞周期进程。但目前,翠云草总黄酮影响结直肠癌细胞恶性生物学行为的机制还未明确。环状RNA(circRNA)和微小RNA(miRNA)是真核生物中广泛存在的非编码RNA, 与肿瘤细胞的发生发展密切相关[4-5]。研究[6]显示, circ_0006528在人乳腺癌组织中的表达明显上调,其可通过靶向miR-7-5p/Raf1轴,增强乳腺癌细胞的恶性行为,可作为乳腺癌的潜在治疗靶点。然而,circ_0006528对结直肠癌发生发展的影响和调控机制还未阐明。预测显示, circ_0006528可能发挥miR-330-3p分子海绵作用。研究[7]显示, miR-330-3p在结直肠癌中表达下调,下调miR-330-3p可促进结直肠癌细胞增殖、迁移和侵袭,并阻碍细胞凋亡, miR-330-3p对结直肠癌发展起抑制作用。本研究探讨翠云草总黄酮能否调控circ_0006528/miR-330-3p轴,影响结直肠癌Caco-2细胞增殖、迁移及凋亡,现报告如下。
1. 材料与方法
1.1 细胞和试剂
Caco-2细胞系(中国科学院上海细胞库); 翠云草(四川省荷花池中药材市场); 胎牛血清(杭州四季青); RPMI 1640培养基、MTT、BCA蛋白检测试剂盒和双荧光素酶活性检测试剂盒(北京索莱宝); LipofectamineTM 2000试剂盒(美国Invitrogen公司); si-circ_0006528、si-NC、pcDNA、pcDNA-circ_0006528、circ_0006528野生型荧光素酶载体(wt-circ_0006528)和突变型荧光素酶载体(mut-circ_0006528)、miR-330-3p mimcs、miR-NC及引物序列(上海吉玛制药技术); 兔抗人Bax和Bcl-2抗体(美国Santa Cruz公司); RNA抽提试剂盒、逆转录试剂盒和PCR试剂盒(大连宝生物)。
1.2 方法
1.2.1 制备翠云草总黄酮
参照文献方法[3]制备翠云草总黄酮。将0.5 kg干燥翠云草粉碎,过60目筛,加2.0 L 60%乙醇,加热回流,提取时间为2 h, 提取3次。合并滤液,旋转蒸发、浓缩、干燥至恒重。用AB-8大孔吸附树脂纯化, 70%乙醇洗脱,浓缩干燥得到翠云草提取物。以芦丁为标准品,翠云草提取物中总黄酮含量为2.53 mg/g。将翠云草提取物配置为浓度为1.0 mg/mL的母液, 4 ℃保存,使用时用培养基稀释。
1.2.2 细胞培养和转染
用含10%胎牛血清(FBS)的RPMI 1640培养基培养Caco-2细胞。接种2.5 mL对数期Caco-2细胞悬液(2.5×104个/mL)于6孔板中,培养12 h后,取LipofectamineTM 2000试剂和si-NC、si-circ_0006528、pcDNA或pcDNA-circ_0006528等体积混合后,缓慢加至6孔板中。转染12 h后,更换为完全培养基。再培养24 h, 检测细胞中circ_0006528表达验证转染效果。
1.2.3 细胞分组处理
未转染的Caco-2细胞分为对照组、翠云草总黄酮-低剂量(L)组、翠云草总黄酮-中剂量(M)组、翠云草总黄酮-高剂量(H)组,其中对照组细胞用常规培养基培养,翠云草总黄酮-L组、翠云草总黄酮-M组、翠云草总黄酮-H组细胞分别用含翠云草总黄酮总浓度为10、20、40 μg/mL[3]的培养基培养。转染si-NC、si-circ_0006528的Caco-2细胞,处理同对照组,记为si-NC组、si-circ_0006528组。转染pcDNA、pcDNA-circ_0006528的Caco-2细胞,处理同翠云草总黄酮-H组,记为翠云草总黄酮+pcDNA组,翠云草总黄酮+pcDNA-circ_0006528组。
1.2.4 检测细胞存活与生长比色法(MTT)实验
接种200 μL未转染、转染后的细胞(2.5×104个/mL)于96孔板中,培养4 h, 弃培养基,按1.2.3标题分组处理,分别培养24 h、48 h、72 h后,加20 μL MTT孵育细胞4 h。弃培养基,加150 μL二甲基亚砜,振荡混匀,用酶标仪(490 nm)测光密度(OD)值。
1.2.5 克隆形成实验
接种2.5 mL未转染、转染后的细胞(2.5×104个/mL)于6孔板中,培养4 h, 弃培养基,按1.2.3标题分组处理。每2 d换液1次,培养14 d后,弃培养基。用多聚甲醛固定、结晶紫染色后,显微镜观察,统计克隆形成数。
1.2.6 划痕实验
接种2.5 mL未转染、转染后的细胞(2.5×104个/mL)于6孔板中,培养4 h, 弃培养基。用200 μL移液器枪头划2条平行线,并用磷酸盐缓冲液(PBS)清洗掉划痕间细胞,测量划痕间距(d), 记为d 0 h。然后按1.2.3标题分组处理细胞24 h, 再次测量划痕间距d,记为d 24 h。迁移距离=d 0 h-d 24 h。
1.2.7 流式细胞术检测细胞凋亡
接种2.5 mL未转染、转染后的细胞(2.5×104个/mL)于6孔板中,培养4 h, 弃培养基,按1.2.3标题分组处理,培养24 h后,收集细胞。利用Annexin V-FITC/PI试剂盒,上流式细胞仪检测细胞凋亡。
1.2.8 Western Blot实验检测Bax和Bcl-2蛋白表达
细胞接种和处理同1.2.7。用RIPA试剂提取细胞中总蛋白,蛋白浓度检测(BCA)定量后,行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)。经转膜和封闭后,于4 ℃冰箱中分别用Bax(1∶500)、Bcl-2(1∶500)和GAPDH(1∶1 000)一抗孵育过夜,洗膜后,再用山羊抗兔二抗(1∶2 000)37℃孵育1 h。加显影液,避光显影,曝光拍照。
1.2.9 实时荧光定量聚合酶链反应(qRT-PCR)检测circ_0006528、miR-330-3p表达
细胞接种和处理同1.2.7。用RNA提取试剂盒提取细胞中总RNA,逆转录后,行PCR反应。引物序列: circ_0006528上游5′-CGTAGGCTAGGAGAGCTAG-3′, 下游5′-CGCGTGACGATAGAAGGCCG-3′; miR-330-3p上游5′-CTATATGCTGCGAGGACGT-3′, 下游5′-CGTGGAATCCTGCTCGAGAC-3′; GAPDH上游5′-CGATAGACAACGCGACGCG-3′, 下游5′-CGATAGTCTCGAGGCTCCGA-3′; U6上游5′-CGTGCTTCATCGTAGATGTG-3′, 下游5′-CGATAGAGAATAGCCAACGAC-3′。2-△△Ct法计算circ_0006528相对GAPDH、miR-330-3p相对U6的表达量。
1.2.10 双荧光素酶报告基因实验
接种2.5 mL Caco-2细胞(2.5×104个/mL)于6孔板中。用LipofectamineTM 2000脂质体法,将wt-circ_0006528与miR-330-3p mimics(或miR-NC)、mut-circ_0006528与miR-330-3p mimics(或miR-NC)共转染至Caco-2细胞。转染6 h后,更换培养基。培养24 h后,弃培养基,裂解细胞。离心(3 500转/min, 10 min)后,取上清,检测荧光素酶活性。
1.3 统计学分析
采用SPSS 22.0软件进行统计分析。以(x±s)表示计量资料,经正态性检验和方差齐性检验后, 2组间比较行独立样本t检验; 多组间比较用单因素方差分析,组间两两比较用LSD-t检验。P < 0.05表示差异有统计学意义。
2. 结果
2.1 翠云草总黄酮对结直肠癌Caco-2细胞增殖和迁移
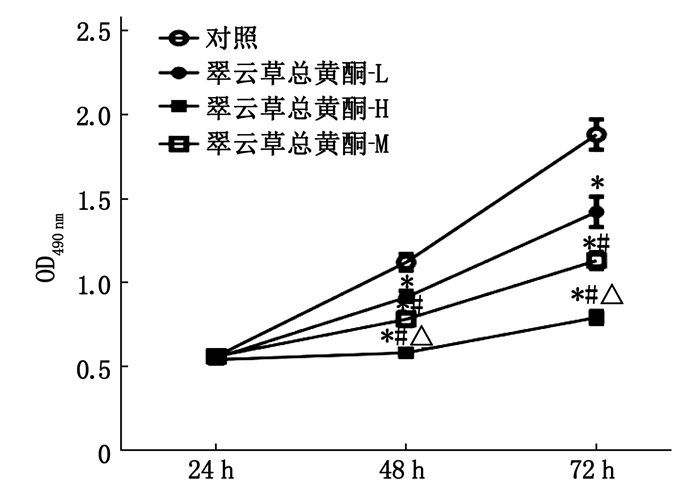
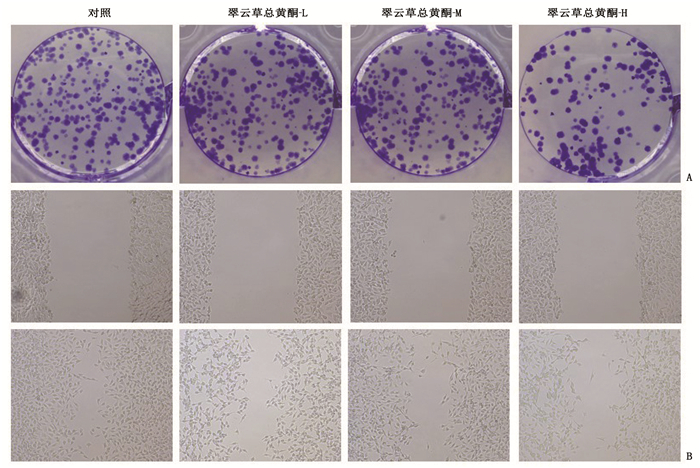
与对照组比较, Caco-2细胞经翠云草总黄酮干预后,细胞活性、集落形成数和迁移距离均降低,差异有统计学意义(P < 0.05), 且呈剂量依赖性,说明翠云草总黄酮可抑制Caco-2细胞增殖和迁移。见图 1、图 2、表 1。
表 1 翠云草总黄酮对Caco-2细胞集落形成和迁移距离的影响(n=3)(x±s)组别 集落形成数/个 迁移距离/μm 对照组 115.00±5.35 166.42±8.94 翠云草总黄酮-L组 91.67±4.99* 132.25±6.44* 翠云草总黄酮-M组 71.67±2.62*# 97.89±3.24*# 翠云草总黄酮-H组 48.00±1.63*#△ 73.39±1.60*#△ 与对照组比较, *P < 0.05;
与翠云草总黄酮-L组比较, #P < 0.05;
与翠云草总黄酮-M组比较, △P < 0.05。2.2 翠云草总黄酮促进Caco-2细胞凋亡
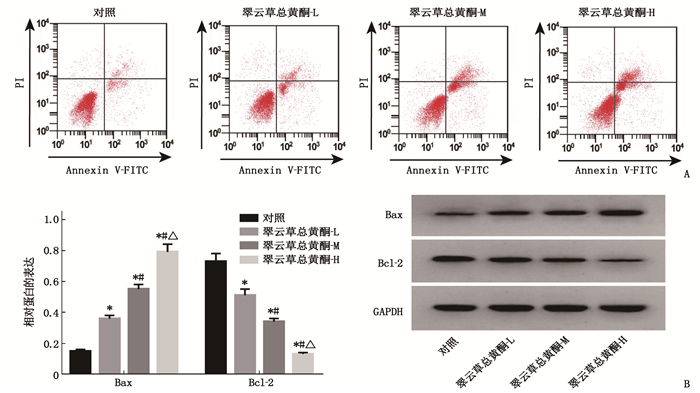
Caco-2细胞经翠云草总黄酮干预后,凋亡率和Bax蛋白表达高于对照组,而Bcl-2蛋白表达低于对照组,差异有统计学意义(P < 0.05), 且呈剂量依赖性,说明翠云草总黄酮可诱导Caco-2细胞凋亡。见图 3、表 2。
表 2 翠云草总黄酮诱导Caco-2细胞凋亡(n=3)(x±s)组别 凋亡率/% Bax Bcl-2 对照组 7.40±0.31 0.15±0.01 0.73±0.05 翠云草总黄酮-L组 13.01±0.54* 0.36±0.02* 0.51±0.04* 翠云草总黄酮-M组 17.73±0.76*# 0.55±0.03*# 0.34±0.02*# 翠云草总黄酮-H组 22.42±1.04*#△ 0.79±0.05*#△ 0.13±0.01*#△ 与对照组比较, *P < 0.05; 与翠云草总黄酮-L组比较, #P < 0.05; 与翠云草总黄酮-M组比较, △P < 0.05。 2.3 翠云草总黄酮对Caco-2细胞中circ_0006528和miR-330-3p表达的影响
Caco-2细胞经翠云草总黄酮干预后,细胞中circ_0006528表达降低,而miR-330-3p表达升高,差异有统计学意义(P < 0.05), 且呈剂量依赖性,说明翠云草总黄酮可抑制Caco-2细胞中circ_0006528的表达,而促进miR-330-3p表达。见图 4。
2.4 干扰circ_0006528抑制Caco-2细胞增殖和迁移并诱导其凋亡
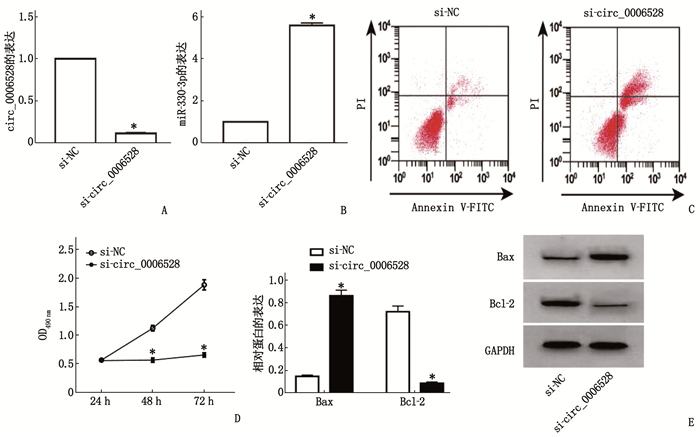
si-circ_0006528组Caco-2细胞中circ_0006528表达为(0.11±0.01), 低于si-NC组的(1.00±0)(t=154.153, P < 0.05); miR-330-3p表达为(5.56±0.12), 高于si-NC组的(1.00±0)(t=65.818, P < 0.05), 说明干扰circ_0006528表达的Caco-2细胞构建成功,且干扰circ_0006528促进Caco-2细胞中miR-330-3p的表达。si-circ_0006528组Caco-2细胞活性、克隆形成数、迁移距离及Bcl-2蛋白表达均低于si-NC组,凋亡率和Bax蛋白表达高于si-NC组,差异有统计学意义(P < 0.05), 说明干扰circ_0006528抑制Caco-2细胞增殖和迁移,并诱导细胞凋亡。见图 5、表 3。
![]() 图 5 干扰circ_0006528对Caco-2细胞活性、凋亡和Bax、Bcl-2蛋白表达的影响A: qRT-PCR实验检测转染si-circ_0006528的Caco-2细胞中circ_0006528表达; B: qRT-PCR实验检测干扰circ_0006528对Caco-2细胞中miR-330-3p表达的影响; C: 流式细胞术检测干扰circ_0006528对Caco-2细胞凋亡的影响; D: MTT实验检测干扰circ_0006528对Caco-2细胞活性的影响; E: Western Blot检测干扰circ_0006528对Caco-2细胞中Bax和Bcl-2蛋白表达的影响。与si-NC组比较, *P < 0.05。表 3 干扰circ_0006528对Caco-2细胞集落形成、迁移和凋亡的影响(n=3)(x±s)
图 5 干扰circ_0006528对Caco-2细胞活性、凋亡和Bax、Bcl-2蛋白表达的影响A: qRT-PCR实验检测转染si-circ_0006528的Caco-2细胞中circ_0006528表达; B: qRT-PCR实验检测干扰circ_0006528对Caco-2细胞中miR-330-3p表达的影响; C: 流式细胞术检测干扰circ_0006528对Caco-2细胞凋亡的影响; D: MTT实验检测干扰circ_0006528对Caco-2细胞活性的影响; E: Western Blot检测干扰circ_0006528对Caco-2细胞中Bax和Bcl-2蛋白表达的影响。与si-NC组比较, *P < 0.05。表 3 干扰circ_0006528对Caco-2细胞集落形成、迁移和凋亡的影响(n=3)(x±s)组别 集落形成数/个 迁移距离/μm 凋亡率/% Bax Bcl-2 si-NC组 115.00±7.48 167.04±9.48 7.84±0.67 0.15±0.01 0.72±0.05 si-circ_0006528组 41.00±0.82* 62.30±2.85* 24.46±0.85* 0.86±0.05* 0.09±0.01* 与si-NC组比较, *P < 0.05。 2.5 circ_0006528和miR-330-3p靶向关系
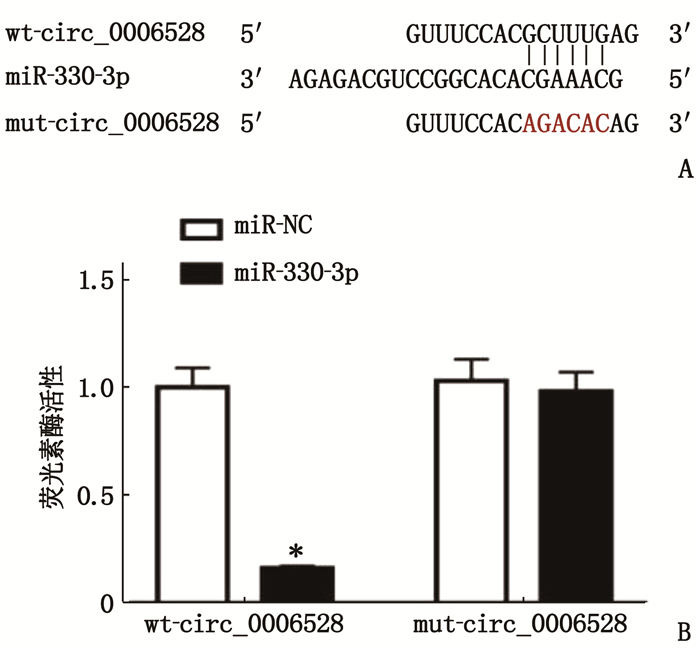
Circular RNA Interactome靶基因软件预测显示的circ_0006528和miR-330-3p的互补核苷酸序列见图 6A。miR-330-3p mimics降低了wt-circ_000652荧光素酶活性(P < 0.05), 而对mut-circ_000652荧光素酶活性无显著影响(P > 0.05), 说明circ_000652可靶向结合miR-330-3p, 见图 6B。
2.6 过表达circ_0006528逆转翠云草总黄酮对Caco-2细胞增殖、迁移和凋亡的影响
翠云草总黄酮+pcDNA-circ_0006528组Caco-2细胞中circ_0006528表达、细胞活性、克隆形成数、迁移距离和Bcl-2蛋白表达均高于翠云草总黄酮组, miR-330-3p表达、细胞凋亡率和Bax蛋白表达均低于翠云草总黄酮组,差异有统计学意义(P < 0.05), 说明过表达circ_0006528逆转翠云草总黄酮对Caco-2细胞增殖、凋亡和迁移的影响。见图 7、表 4。
![]() 图 7 过表达circ_0006528逆转翠云草总黄酮对Caco-2细胞增殖、凋亡和及Bax、Bcl-2蛋白表达的影响A: qRT-PCR验检测翠云草总黄酮对转染pcDNA-circ_0006528的Caco-2细胞中circ_0006528表达的影响;
图 7 过表达circ_0006528逆转翠云草总黄酮对Caco-2细胞增殖、凋亡和及Bax、Bcl-2蛋白表达的影响A: qRT-PCR验检测翠云草总黄酮对转染pcDNA-circ_0006528的Caco-2细胞中circ_0006528表达的影响;
B: qRT-PCR检测翠云草总黄酮对转染pcDNA-circ_0006528的Caco-2细胞中miR-330-3p表达的影响;
C: 流式细胞术检测翠云草总黄酮对转染pcDNA-circ_0006528的Caco-2细胞凋亡的影响;
D: MTT实验检测翠云草总黄酮对转染pcDNA-circ_0006528的Caco-2细胞活性的影响;
E: Western Blot检测翠云草总黄酮对转染pcDNA-circ_0006528的Caco-2细胞中Bax和Bcl-2蛋白表达的影响。
与翠云草总黄酮组比较, *P < 0.05。表 4 过表达circ_0006528逆转翠云草总黄酮对Caco-2细胞增殖、迁移和凋亡的影响(n=3)(x±s)组别 circ_0006528 miR-330-3p 集落形成数/个 迁移距离/μm 凋亡率/% Bax Bcl-2 翠云草总黄酮 0.20±0.01 4.31±0.10 47.33±2.62 73.56±1.90 22.54±1.09 0.78±0.06 0.14±0.01 翠云草总黄酮+pcDNA-circ_0006528 0.83±0.06* 1.22±0.06* 103.33±3.86* 144.84±5.69* 8.63±0.54* 0.19±0.01* 0.64±0.05* 与翠云草总黄酮组比较, *P < 0.05。 3. 讨论
近年来,中草药及其活性成分因具有作用靶点多、药效高、毒副作用低等优点,在肿瘤治疗中发挥重要作用[8]。多种中草药成分具有抗结直肠癌作用[9-10]。例如,中药龙葵的正丁醇提取物可能通过上调Caspase-3蛋白表达,抑制人结直肠癌SW480细胞增殖[11-12]; 桂枝水提取可有效阻碍结直肠癌细胞的增殖及细胞周期进程,并诱导细胞凋亡[13]; 中药白头翁皂苷可通过干预糖酵解途径,抑制人结直肠癌细胞增殖[14]。翠云草总黄酮是常用中药翠云草的主要活性成分之一。本研究主要观察了翠云草总黄酮对结直肠癌Caco-2细胞恶性行为的影响,结果显示,翠云草总黄酮可抑制结直肠癌细胞增殖和迁移,并通过调控Bax/Bcl-2诱导Caco-2细胞凋亡,提示翠云草总黄酮具有治疗结直肠癌的潜在价值。
circRNA参与调控肿瘤发生发展,可作为肿瘤治疗的分子靶点[15-17]。有报道[18]表明, circ_0006528在紫杉醇耐药乳腺癌组织和细胞中的表达明显上调,敲低circ_0006528可靶向miR-1299抑制紫杉醇耐药乳腺癌细胞的恶性行为,提高乳腺癌细胞对紫杉醇敏感性。本研究显示,干扰circ_0006528可阻碍结直肠癌细胞增殖和迁移,并加剧细胞凋亡, circ_0006528可作为结直肠癌治疗的分子靶点。本研究还显示,翠云草总黄酮对结直肠癌细胞中circ_0006528表达起抑制作用,过表达circ_0006528可逆转其对结直肠癌细胞增殖、迁移的抑制作用及凋亡促进作用,提示其可能通过下调circ_0006528来影响结直肠癌细胞的恶性生物学行为。
此外,本研究证实了circ_0006528靶向结合并负调控miR-330-3p。研究[19-24]显示, miR-330-3p在乳腺癌、胶质瘤和胃癌等肿瘤中表达下调,起抑癌基因作用; 而miR-330-3p在非小细胞肺癌、肝细胞癌和胰腺癌等肿瘤中呈高表达,促进这些肿瘤的发展进程。这提示miR-330-3p可能在不同肿瘤中发挥的作用不同。黄开禹等[25]研究显示, miR-330-3p可能通过靶向抑制RUVBL1表达促进结直肠癌细胞凋亡。本研究显示,翠云草总黄酮促进结直肠癌细胞中miR-330-3p的表达,而过表达circ_0006528可逆转起对结直肠癌细胞中miR-330-3p表达的促进作用,进一步提示其可能通过靶向circ_0006528/miR-330-3p轴来影响结直肠癌细胞增殖、迁移及凋亡。
综上所述,翠云草总黄酮可呈剂量依赖性阻碍结直肠癌细胞增殖和迁移,并促进细胞凋亡,其作用机制可能与靶向下调circ_0006528, 进而促进miR-330-3p的表达有关,其可能成为治疗结直肠癌的药物。但本研究仅进行了体外细胞实验,尚未在体内研究翠云草总黄酮的抗结直肠癌作用,尚需要进一步深入探究。
-
图 5 干扰circ_0006528对Caco-2细胞活性、凋亡和Bax、Bcl-2蛋白表达的影响
A: qRT-PCR实验检测转染si-circ_0006528的Caco-2细胞中circ_0006528表达; B: qRT-PCR实验检测干扰circ_0006528对Caco-2细胞中miR-330-3p表达的影响; C: 流式细胞术检测干扰circ_0006528对Caco-2细胞凋亡的影响; D: MTT实验检测干扰circ_0006528对Caco-2细胞活性的影响; E: Western Blot检测干扰circ_0006528对Caco-2细胞中Bax和Bcl-2蛋白表达的影响。与si-NC组比较, *P < 0.05。
图 7 过表达circ_0006528逆转翠云草总黄酮对Caco-2细胞增殖、凋亡和及Bax、Bcl-2蛋白表达的影响
A: qRT-PCR验检测翠云草总黄酮对转染pcDNA-circ_0006528的Caco-2细胞中circ_0006528表达的影响;
B: qRT-PCR检测翠云草总黄酮对转染pcDNA-circ_0006528的Caco-2细胞中miR-330-3p表达的影响;
C: 流式细胞术检测翠云草总黄酮对转染pcDNA-circ_0006528的Caco-2细胞凋亡的影响;
D: MTT实验检测翠云草总黄酮对转染pcDNA-circ_0006528的Caco-2细胞活性的影响;
E: Western Blot检测翠云草总黄酮对转染pcDNA-circ_0006528的Caco-2细胞中Bax和Bcl-2蛋白表达的影响。
与翠云草总黄酮组比较, *P < 0.05。表 1 翠云草总黄酮对Caco-2细胞集落形成和迁移距离的影响(n=3)(x±s)
组别 集落形成数/个 迁移距离/μm 对照组 115.00±5.35 166.42±8.94 翠云草总黄酮-L组 91.67±4.99* 132.25±6.44* 翠云草总黄酮-M组 71.67±2.62*# 97.89±3.24*# 翠云草总黄酮-H组 48.00±1.63*#△ 73.39±1.60*#△ 与对照组比较, *P < 0.05;
与翠云草总黄酮-L组比较, #P < 0.05;
与翠云草总黄酮-M组比较, △P < 0.05。表 2 翠云草总黄酮诱导Caco-2细胞凋亡(n=3)(x±s)
组别 凋亡率/% Bax Bcl-2 对照组 7.40±0.31 0.15±0.01 0.73±0.05 翠云草总黄酮-L组 13.01±0.54* 0.36±0.02* 0.51±0.04* 翠云草总黄酮-M组 17.73±0.76*# 0.55±0.03*# 0.34±0.02*# 翠云草总黄酮-H组 22.42±1.04*#△ 0.79±0.05*#△ 0.13±0.01*#△ 与对照组比较, *P < 0.05; 与翠云草总黄酮-L组比较, #P < 0.05; 与翠云草总黄酮-M组比较, △P < 0.05。 表 3 干扰circ_0006528对Caco-2细胞集落形成、迁移和凋亡的影响(n=3)(x±s)
组别 集落形成数/个 迁移距离/μm 凋亡率/% Bax Bcl-2 si-NC组 115.00±7.48 167.04±9.48 7.84±0.67 0.15±0.01 0.72±0.05 si-circ_0006528组 41.00±0.82* 62.30±2.85* 24.46±0.85* 0.86±0.05* 0.09±0.01* 与si-NC组比较, *P < 0.05。 表 4 过表达circ_0006528逆转翠云草总黄酮对Caco-2细胞增殖、迁移和凋亡的影响(n=3)(x±s)
组别 circ_0006528 miR-330-3p 集落形成数/个 迁移距离/μm 凋亡率/% Bax Bcl-2 翠云草总黄酮 0.20±0.01 4.31±0.10 47.33±2.62 73.56±1.90 22.54±1.09 0.78±0.06 0.14±0.01 翠云草总黄酮+pcDNA-circ_0006528 0.83±0.06* 1.22±0.06* 103.33±3.86* 144.84±5.69* 8.63±0.54* 0.19±0.01* 0.64±0.05* 与翠云草总黄酮组比较, *P < 0.05。 -
[1] HAO L F, YUN Y F, LIANG R, et al. Long non-coding RNA TUSC7 suppressed colorectal cancer progression via regulation of miR-23b/PDE7A Axis[J]. Clin Invest Med, 2020, 43(4): E35-E43. doi: 10.25011/cim.v43i4.34703
[2] 邱宏聪, 刘布鸣, 陈小刚. 翠云草的研究进展[J]. 中医药导报, 2015, 21(21): 89-92. https://www.cnki.com.cn/Article/CJFDTOTAL-HNZB201521039.htm [3] 舒姮, 毛知娟, 杨勇, 等. 翠云草总黄酮对肺癌细胞生长的抑制作用[J]. 中药与临床, 2019, 10(1): 27-29. https://www.cnki.com.cn/Article/CJFDTOTAL-LCZY201901009.htm [4] CHEN L, ZHOU H, GUAN Z. CircRNA_000543 knockdown sensitizes nasopharyngeal carcinoma to irradiation by targeting miR-9/platelet-derived growth factor receptor B axis[J]. Biochem Biophys Res Commun, 2019, 512(4): 786-792. doi: 10.1016/j.bbrc.2019.03.126
[5] 陈明成, 贾洪涛. 肾透明细胞癌患者外周血中微小RNA-223的表达及临床意义[J]. 实用临床医药杂志, 2020, 24(6): 54-56, 60. https://www.cnki.com.cn/Article/CJFDTOTAL-XYZL202006015.htm [6] GAO D F, QI X W, ZHANG X F, et al. hsa_circRNA_0006528 as a competing endogenous RNA promotes human breast cancer progression by sponging miR-7-5p and activating the MAPK/ERK signaling pathway[J]. Mol Carcinog, 2019, 58(4): 554-564. doi: 10.1002/mc.22950
[7] HUANG Y G, SUN H, MA X, et al. HLA-F-AS1/miR-330-3p/PFN1 axis promotes colorectal cancer progression[J]. Life Sci, 2020, 254: 117180. doi: 10.1016/j.lfs.2019.117180
[8] 韩芳芳, 董昀, 朱渊, 等. 黄柏红花散对抗肿瘤药物相关静脉炎的预防效果[J]. 实用临床医药杂志, 2021, 25(13): 102-105. doi: 10.7619/jcmp.20211669 [9] 唐末, 杨宇飞, 宋卓, 等. 基于网络药理学探讨四君子汤治疗结直肠癌靶点及通路研究[J]. 国际中医中药杂志, 2022, 44(2): 206-211. doi: 10.3760/cma.j.cn115398-20200803-00017 [10] 程小伟, 吴锐荣, 张振勇, 等. 中药熏洗治疗结直肠癌患者化疗后手足综合征的疗效观察[J]. 实用临床医药杂志, 2020, 24(21): 32-35. doi: 10.7619/jcmp.202021010 [11] 叶丽芳, 高卓维. 龙葵正丁醇提取物抗人结直肠癌SW480细胞增殖及其作用机制研究[J]. 世界中西医结合杂志, 2019, 14(3): 356-358, 363. https://www.cnki.com.cn/Article/CJFDTOTAL-SJZX201903018.htm [12] 钟妙文, 叶慧青, 黎群足, 等. 芪附龙葵汤联合化疗对转移性结直肠癌患者生存质量的影响[J]. 现代中西医结合杂志, 2016, 25(18): 1980-1982. doi: 10.3969/j.issn.1008-8849.2016.18.014 [13] 孙鹏达, 孙冬. 桂枝水提物诱导人结直肠癌SW480细胞周期进程及其凋亡机制[J]. 中国老年学杂志, 2020, 40(20): 4396-4399. doi: 10.3969/j.issn.1005-9202.2020.20.042 [14] 陈兰英, 周朦静, 崔亚茹, 等. 白头翁皂苷干预糖酵解途径抑制SW480人结直肠癌细胞增殖作用研究[J]. 中药材, 2019, 42(3): 652-656. https://www.cnki.com.cn/Article/CJFDTOTAL-ZYCA201903038.htm [15] ZHANG C C, LI Y H, FENG X Z, et al. Circular RNA circ_0001287 inhibits the proliferation, metastasis, and radiosensitivity of non-small cell lung cancer cells by sponging microRNA miR-21 and up-regulating phosphatase and tensin homolog expression[J]. Bioengineered, 2021, 12(1): 414-425. doi: 10.1080/21655979.2021.1872191
[16] LI M, CHI C, ZHOU L Q, et al. Circular PVT1 regulates cell proliferation and invasion via miR-149-5p/FOXM1 axis in ovarian cancer[J]. J Cancer, 2021, 12(2): 611-621. doi: 10.7150/jca.52234
[17] LIU J Q, XUE N N, GUO Y X, et al. CircRNA_100367 regulated the radiation sensitivity of esophageal squamous cell carcinomas through miR-217/Wnt3 pathway[J]. Aging (Albany NY), 2019, 11(24): 12412-12427. http://www.ncbi.nlm.nih.gov/pubmed/31851619
[18] LIU G Q, ZHANG Z X, SONG Q, et al. Circ_0006528 contributes to paclitaxel resistance of breast cancer cells by regulating miR-1299/CDK8 axis[J]. Onco Targets Ther, 2020, 13: 9497-9511. doi: 10.2147/OTT.S252886
[19] HU C X, FANG K, ZHANG X F, et al. Dyregulation of the lncRNA TPT1-AS1 positively regulates QKI expression and predicts a poor prognosis for patients with breast cancer[J]. Pathol Res Pract, 2020, 216(11): 153216. doi: 10.1016/j.prp.2020.153216
[20] WANG H B, LIU G J, LI T, et al. miR-330-3p functions as a tumor suppressor that regulates glioma cell proliferation and migration by targeting CELF1[J]. Arch Med Sci, 2020, 16(5): 1166-1175. doi: 10.5114/aoms.2020.95027
[21] WANG Z H, QU H J, GONG W J, et al. Up-regulation and tumor-promoting role of SPHK1 were attenuated by miR-330-3p in gastric cancer[J]. IUBMB Life, 2018, 70(11): 1164-1176. doi: 10.1002/iub.1934
[22] WEI C H, ZHANG R G, CAI Q, et al. microRNA-330-3p promotes brain metastasis and epithelial-mesenchymal transition via GRIA3 in non-small cell lung cancer[J]. Aging (Albany NY), 2019, 11(17): 6734-6761. http://www.ncbi.nlm.nih.gov/pubmed/31498117/
[23] ZHAO X, CHEN G Q, CAO G M. Abnormal expression and mechanism of miR-330-3p/BTG1 axis in hepatocellular carcinoma[J]. Eur Rev Med Pharmacol Sci, 2019, 23(16): 6888-6898. http://www.ncbi.nlm.nih.gov/pubmed/31486488
[24] XIONG X C, SHI Q, YANG X J, et al. LINC00052 functions as a tumor suppressor through negatively modulating miR-330-3p in pancreatic cancer[J]. J Cell Physiol, 2019, 234(9): 15619-15626. doi: 10.1002/jcp.28209
[25] 黄开禹, 穆磊, 王向阳, 等. 结直肠癌中miR-330-3p-RUVBL1信号轴对肿瘤细胞增殖、凋亡的影响[J]. 华中科技大学学报: 医学版, 2020, 49(5): 517-523. doi: 10.3870/j.issn.1672-0741.2020.05.002 -
期刊类型引用(2)
1. 张丽亚,朱攀,金夏敏,揭青青,崔英波,陈黎丽. 环状RNA在早产儿视网膜病变患儿血浆中的表达变化. 中华全科医学. 2025(03): 383-387 .  百度学术
百度学术
2. 胡学会,闫红,吴计划,赵忠礼,汪晓翠,杨斌. 儿童脊髓性肌萎缩症2型患者血浆中环状RNA的表达谱分析. 实用临床医药杂志. 2023(02): 22-27+34 .  本站查看
本站查看
其他类型引用(0)




 下载:
下载:


 苏公网安备 32100302010246号
苏公网安备 32100302010246号