Effects of miR-338-3p regulating signal transducer and activator of transcription 1 on programmed death ligand 1 expression and apoptosis of epidermal growth factor receptor-tyrosine kinase inhibitor-resistant lung cancer cell line PC-9/GR cells
-
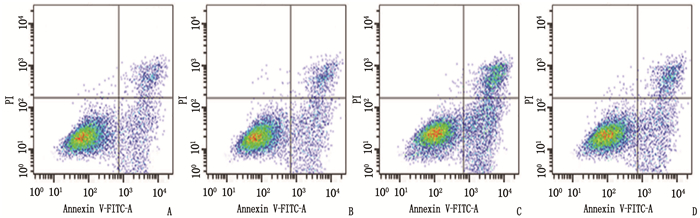
摘要:目的 探讨微小RNA-338-3p(miR-338-3p)对表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)耐药肺癌细胞株PC-9/GR中程序性死亡配体1(PD-L1)表达和细胞凋亡的影响及相关机制。方法 体外培养PC-9细胞、PC-9/GR细胞,采用0、0.25、0.50、1.00、2.00、4.00、8.00 μmol/L吉非替尼处理确定用药浓度; 实时荧光定量聚合酶链反应(qRT-PCR)检测细胞中miR-338-3p表达。将PC-9/GR细胞分为对照组、miR-338-3p NC组(转染miR-338-3p NC)、miR-338-3p组(转染miR-338-3p模拟物)和信号转导和转录激活因子1(STAT1)抑制剂组(转染miR-338-3p模拟物+100 μmol/L氟达拉滨)。4组均添加1.00 μmol/L吉非替尼,转染后qRT-PCR检测细胞中miR-338-3p表达; MTT法检测细胞增殖; 流式细胞仪检测细胞凋亡; 蛋白印迹(WB)法STAT1、p-STAT1、PD-L1、Bcl-2、Bax蛋白表达。结果 当吉非替尼浓度升高至1.00 μmol/L时, PC-9细胞与PC-9/GR细胞增殖率比较,差异有统计学意义(P < 0.05)。与PC-9细胞相比, PC-9/GR细胞中miR-338-3p表达水平降低,差异有统计学意义(P < 0.05)。转染后, qRT-PCR结果显示, miR-338-3p组、STAT1抑制剂组的miR-338-3p表达水平均高于miR-338-3p NC组、对照组,差异有统计学意义(P > 0.05)。与miR-338-3p NC组相比, miR-338-3p组PC-9/GR细胞增殖率及细胞中PD-L1、Bcl-2蛋白表达水平降低,凋亡率及细胞中p-STAT1/STAT1、Bax蛋白表达水平升高,差异有统计学意义(P < 0.05); 与miR-338-3p组相比, STAT1抑制剂组PC-9/GR细胞增殖率及细胞中PD-L1、Bcl-2蛋白表达水平升高,凋亡率及细胞中p-STAT1/STAT1、Bax蛋白表达水平降低,差异有统计学意义(P < 0.05)。结论 miR-338-3p可抑制EGFR-TKI耐药肺癌细胞株PC-9/GR细胞中PD-L1表达,并诱导细胞凋亡,其作用机制可能与激活STAT1有关。
-
关键词:
- 微小RNA-338-3p /
- 信号转导和转录激活因子1 /
- 表皮生长因子受体酪氨酸激酶抑制剂 /
- 耐药 /
- 肺癌细胞PC-9 /
- 程序性死亡配体1 /
- 凋亡
Abstract:Objective To investigate the effects and related mechanisms of miR-338-3p on the expression of programmed death ligand 1 (PD-L1) and apoptosis of epidermal growth factor receptor-tyrosine kinase inhibitor (EGFR-TKI)-resistant lung cancer cell line PC-9/GR cells.Methods PC-9 cells and PC-9/GR cells were cultured in vitro, and treated with 0, 0.25, 0.50, 1.00, 2.00, 4.00 and 8.00 μmol/L gefitinib to determine the drug concentration; quantitative real-time polymerase chain reaction (qRT-PCR) method was used to detect the expression of miR-338-3p in cells. PC-9/GR cells were divided into control group, miR-338-3p NC group (transfected with miR-338-3p NC), miR-338-3p group (transfected with miR-338-3p mimic) and signal transducer and activator of transcription 1 (STAT1) inhibitor group (transfected miR-338-3p mimic +100 μmol/L fludarabine). All four groups were added with 1.00 μmol/L gefitinib, and qRT-PCR method was used to detect the expression of miR-338-3p in the cells after transfection; MTT method was used to detect cell proliferation; flow cytometry was used to detect cell apoptosis; western blot (WB) method was used to detect the expression of STAT1, p-STAT1, PD-L1, Bcl-2 and Bax proteins.Results When the concentration of gefitinib was increased to 1.00 μmol/L, the differences in the proliferation rates of PC-9 cells and PC-9/GR cells were statistically significant (P < 0.05). Compared with PC-9 cells, the expression level of miR-338-3p in PC-9/GR cells was significantly reduced (P < 0.05). The results of qRT-PCR after transfection showed that the expression levels of miR-338-3p in the miR-338-3p group and the STAT1 inhibitor group were significantly higher than those in the miR-338-3p NC group and the control group(P > 0.05). Compared with the miR-338-3p NC group, the PC-9/GR cell proliferation rate, the expression levels of PD-L1 and Bcl-2 proteins in the miR-338-3p group were significantly reduced, the apoptosis rate and expression levels of p-STAT1/STAT1 and Bax proteins in cells were significantly increased (P < 0.05); compared with the miR-338-3p group, the PC-9/GR cell proliferation rate and the expression levels of PD-L1 and Bcl-2 proteins in the STAT1 inhibitor group were significantly increased, the apoptosis rate and the expression levels of p-STAT1/STAT1 and Bax proteins in the cells were significantly reduced (P < 0.05).Conclusion MiR-338-3p can inhibit the expression of PD-L1 in EGFR-TKI-resistant lung cancer cell line PC-9/GR cells and induce cell apoptosis. Its mechanism may be related to the activation of STAT1. -
鲍曼不动杆菌(Ab)是一种革兰阴性、非发酵、过氧化氢酶阳性和氧化酶阴性的芽孢杆菌[1]。鲍曼不动杆菌是一种机会致病菌,是引起医院感染的重要病原菌之一,主要发生在免疫功能低下的患者中,具有很高的发病率和死亡率[2]。此外,鲍曼不动杆菌极易形成生物被膜,而抗生素的滥用又会导致多种菌株对多类抗生素产生耐药性[3]。
抗菌肽(AMPs)是一种短肽,结构繁多,长度一般小于100个氨基酸,是由核糖体合成的天然抗生素,具有分子量小、水溶性好、热稳定性等优点,可发挥抗菌活性、抗癌活性、免疫调节等作用。与常用抗生素相比, AMPs对多种耐药菌株表现出较低的耐药性、快速杀伤作用、广谱活性和显著的临床疗效[4]。
抗菌肽的类别主要包括动物来源抗菌肽、微生物来源抗菌肽和植物来源抗菌肽。动物抗菌肽主要包括哺乳动物源抗菌肽、两栖动物源抗菌肽和昆虫源抗菌肽。人源抗菌肽作为哺乳动物源抗菌肽的成员,因其物种特点,在临床使用中不容易产生细胞毒性以及排异反应,更具备优先发展成为新型抗菌药物的潜力。两栖类动物中的组织蛋白酶抑制素(Cathelicidins)家族抗菌肽具有高效广谱的抗菌活性,相比其他动物源抗菌肽而言,这一类抗菌肽更具独特性,比如特殊的酶作用、强修复活性等[5]。因此,研究两栖类动物中的Cathelicidins家族抗菌肽对动物免疫学和新药研发都具有重要意义。昆虫源抗菌肽在治疗哺乳动物疾病的过程中具有极大潜能[6]。本文对人源抗菌肽、两栖动物源抗菌肽和昆虫源抗菌肽结构特点以及治疗鲍曼不动杆菌感染的研究进展进行综述。
1. 人源抗菌肽
人源抗菌肽主要由Cathelicidins、防御素(Defensins)和富组蛋白(Histains)组成。
1.1 Cathelicidins
LL-37是人体内抗菌肽Cathelicidins家族的唯一成员, LL-37是目前被研究最多的一种抗菌肽。LL-37是Cathelicdin肽Hcap-18的C末端切割产物,该抗菌肽包含37个氨基酸[7], LL-37与LPS的相互作用是其抗菌作用的主要机制。LPS的结构重塑可增加革兰阴性菌(如肠道沙门氏菌)对LL-37的耐药性[8]。
最低抑菌浓度和最低生物膜根除浓度试验[9]表明LL-37可降低鲍曼不动杆菌的生物膜形成能力,或可成为治疗鲍曼不动杆菌感染的潜在治疗方法。在最低抑菌浓度的测定过程中,LL-37对鲍曼不动杆菌的最低抑制浓度(MIC)为16~32 μg/mL。最低生物膜根除浓度(MBEC)实验[10]表明,LL-37在32 μg/mL对鲍曼不动杆菌生物膜不仅有抑制作用,也有分散作用。LL-37截短片段在浓度为64~128 μg/mL时对生物膜有抑制作用。KS-30是LL-37的截短片段,能在64 μg/mL的浓度下有效分散生物膜。因此,该类抗菌肽对鲍曼不动杆菌具有显著的抗菌和抗生物膜活性,并且无细胞毒性[10]。
鲍曼不动杆菌外膜蛋白A (OmpA)通过OmpA样结构域参与鲍曼不动杆菌的耐药性[11]。相关实验[12]表明,LL-37除了可以对鲍曼不动杆菌的生物膜有抑制和分散作用之外,还可以结合鲍曼不动杆菌的OmpA蛋白。以BA-LL37为探针,在野生型菌株中检测到OmpA信号,但OmpA缺失菌株中未发现该蛋白,验证了二者的相互作用。因此, LL-37也可以通过与OmpA蛋白结合来拮抗鲍曼不动杆菌感染。
1.2 Defensins
Defensins是先天免疫系统的一个效应成分,具有广泛的抗菌活性,是哺乳动物防御系统中具有杀菌能力的组分。Defensins和带负电荷的细胞膜之间的静电相互作用是杀死细菌的主要机制[13]。人类有2种防御素,即α-防御素和β-防御素(hBDs)。根据表达模式和遗传结构,α-防御素可进一步细分为髓系(HNP1-4)和肠系(HD5和HD6)。α-防御素是一种丰富的抗菌肽,具有广泛、强效的抗细菌、抗真菌和抗病毒活性[14]。HNP1-4主要由中性粒细胞表达,但也可在单核/巨噬细胞、自然杀伤细胞、部分T细胞、B细胞和未成熟树突状细胞(DCs)中表达[15]。人防御素5 (HD5)是一种α-亚家族肽,能够在体内灭活致病菌,是一种潜在的能够消除多重耐药鲍曼不动杆菌的杀菌剂。HD5是一种32位残基阳离子肽,由3个二硫键提供特定的构象[16], 主要在肠帕内特细胞中检测到,因其已经进化出了抑制病原体的能力,因此是拮抗MDR Ab的潜在候选者。HD5d5是由二硫键还原和引入精氨酸构建的HD5的简化衍生物,能够结合并穿透MDR Ab膜,通过灾难性的崩溃和代谢中断导致细菌死亡。HD5d5对MDR Ab具有强大的抗菌活性,因此是一种有希望在临床环境中拮抗MDR Ab的候选药物[16]。
人hBDs是上皮细胞来源的阳离子AMPs, 在先天免疫系统和适应性免疫系统之间起桥梁作用。通过检测鲍曼不动杆菌对原代口腔和皮肤上皮细胞hBD-2和hBD-3的诱导作用,发现鲍曼不动杆菌对hBD-3的诱导作用大于对hBD-2的诱导作用。研究[17]显示, hBDs可以通过辅助和化学吸引T细胞、未成熟树突状细胞、B细胞、中性粒细胞和巨噬细胞来增强适应性免疫。鲍曼不动杆菌感染气道上皮细胞可诱导hBD-2的产生。通过研究2株鲍曼不动杆菌对原代口腔和皮肤上皮细胞hBD-2和hBD-3的诱导作用,发现hBD-3优先以表皮生长因子受体(EGFR)依赖的方式诱导。虽然这两种抗菌肽对鲍曼不动杆菌都有抗菌活性,但hBD-3更有效,可能是因为其净阳离子电荷高于hBD-2。对鲍曼不动杆菌AB0057和ATCC 17978进行药敏试验, hBD-2和hBD-3对鲍曼不动杆菌均表现出浓度依赖性的杀灭作用, hBD-3在0.062 5 μmol/L浓度下几乎完全杀灭了这2株鲍曼不动杆菌[18]。
2. 两栖动物源抗菌肽
两栖动物源抗菌肽是指来源于蛙类皮肤的抗菌肽,这些肽构成了先天免疫系统的组成部分以抵抗微生物的入侵,也可以在阻止捕食者捕猎的方面发挥作用。该种抗菌肽具有多样性,表现在不同种类的两栖动物皮肤中有不同种类的抗菌肽。两栖动物源抗菌肽在医药、食品工业和农业等领域有着广阔的应用,尤其在临床上的应用越来越受到关注。
2.1 马盖宁(Magainin)及其类似物培西加南(Pexiganan)
马盖宁(Magainin)是由非洲爪蟾的皮肤中分离出来的抗肽素,有Magainin-1和Magainin-2, 都具有抗不动杆菌活性,但Magainin-2抗菌活性更强。研究[19]报道Magainin-2在4.9~64 μg/mL的浓度下抑制鲍曼不动杆菌敏感菌株和耐药菌株的生长,而Magainin-1需要达到256 μg/mL才能发挥相同效果。Magainin- 2对人角质细胞(HaCaT)无细胞毒性及溶血活性,对鲍曼不动杆菌的生物膜有明显的抑制和消除作用。上述结果表明, Magainin-2是一种有效的抗鲍曼不动杆菌的抗菌和抗生物膜制剂。
在发现Magainin-2后,研究者试图通过改变氨基酸序列来提高肽的抗菌活性和稳定性,此后Pexiganan和MSI-78被研发出来[20]。Pexiganan具有很高的抗鲍曼不动杆菌活性,在1~8 μg/mL浓度下能抑制鲍曼不动杆菌的敏感和耐药临床分离株的生长[21]。Pexiganan对人红细胞的溶血活性表明诱导100%溶血的最低浓度为250 μg/mL[22], 远低于许多菌株的MIC。这说明Pexiganan对红细胞具有高选择性,因此毒性较低。MSI-78已完成了临床试验Ⅲ期阶段,虽然美国食品药品监督局(FDA)还没有批准MSI-78的临床使用,但其仍然是迄今为止最好的用于治疗的AMPs。临床试验设计以及肽生产的改进都将大大增加FDA批准Pexiganan进入临床使用的可能性[23]。
2.2 布莱温素-2(B2RP)相关肽
B2RP是从水貂蛙和匠蛙的皮肤分泌物中分离出来的,具有广谱抗菌活性,但其治疗潜力受到中度溶血活性的限制。B2RP具有抗病毒活性,特别是保护细胞免受HIV-1感染。B2RP能在29.0 μg/mL浓度下抑制鲍曼不动杆菌的生长,但在7.0~13.9 μg/mL浓度下对鲍曼不动杆菌的抑制效果更好[24]。该肽导致细菌生长抑制或细菌死亡的机制可能是在目标细胞附近形成α-螺旋结构,导致磷脂双分子层的扰动。由于这种肽对人红细胞有着中等毒性,所以其应用受到了极大的限制。为了解决这一局限性,科学家想出了氨基酸替代的方法。目前研究人员已经制造了一种类似于这种肽的物质,替代位置为4、16和18 (D4K, K16A, L18K), 结果是抗鲍曼不动杆菌活性提高了2倍且溶血活性降低。研究[25]称替代模式D4K的B2RP类似物可以抑制敏感的和黏菌素耐药菌株,也可以抑制鲍曼不动杆菌的XDR分离株。
3. 昆虫源抗菌肽
昆虫源抗菌肽主要包含蜂毒肽(Melittin)、天蚕素(Cecropins)、昆虫类防御素、富含脯氨酸的抗菌肽等,这类抗菌肽主要针对革兰阴性细菌。将这些分子引入市场是一个较大的挑战,例如作为药物将会是一种具有成本效益的大规模生产工艺。昆虫源性肽主要有免疫活性肽、肽激素和毒液中的肽[26], 其中蜂毒肽属于毒液中的肽,天蚕素属于免疫活性肽。
3.1 Melittin
Melittin是蜜蜂毒液的主要成分[26], 具有10~14个氨基酸,其中包括独特的疏水氨基酸和两亲α-螺旋构象,其是一种多功能肽,具有抗细菌、抗真菌、抗寄生虫、抗病毒和抗癌特性[27]。蜂毒肽具有较强的抗不动杆菌活性,在0.125~2.000 μg/mL浓度下可以抑制鲍曼不动杆菌的MDR和XDR临床分离株[28]。蜂毒肽对鲍曼不动杆菌有一定的杀菌活性,且细胞黏附分子的杀菌活性不受荚膜存在的影响。采用扫描电镜观察分析[29]发现,蜂毒肽和黏菌素在0.125~0.250 μg时的协同作用完全抑制了生物膜的形成,对耐黏菌素鲍曼不动杆菌分离株具有快速的杀菌作用,因此蜂毒肽可以作为克服鲍曼不动杆菌多黏菌素耐药性的有前途的替代方案。研究[30]表明,蜂毒肽在无毒剂量下与多酚青霉烯、头孢他啶协同作用,可作为外用药物治疗MDR细菌引起的烧伤感染。
3.2 天蚕素
Cecropins最初是从巨型蚕蛾的血淋巴中分离出来的[31], 其主要是由鳞翅目和双翅目昆虫中分离到的大量抗菌和有毒肽组成,构成了昆虫无细胞免疫的主要组成部分。Cecropins是一种小蛋白质,约有35个氨基酸残基,对革兰阳性菌和革兰阴性菌都有活性。天蚕素可以溶解细菌细胞膜,也可以抑制脯氨酸的摄取,并导致细胞膜渗漏[32]。
3.2.1 天蚕素A(Cecropin A)
Cecropin A是一种具有稳定α-螺旋结构的抗菌肽。天蚕素A可显著降低还原型辅酶Ⅱ(NADPH)和谷胱甘肽水平,通过形成活性氧簇(ROS)进一步诱导氧化应激[33]。临床研究[34]表明, Cecropin A能在0.5~32.0 μg/mL时抑制鲍曼不动杆菌活性。研究[35]还表明, Cecropin A能分别在32 μg/mL和256 μg/mL浓度下抑制鲍曼不动杆菌敏感株和黏菌素耐药株的生长。
从埃及伊蚊中分离到的抗菌肽BR003-天蚕素A(BR003-Cecropin A)对鲍曼不动杆菌的抑制活性高于其他抗菌肽,在4.5 μg/mL浓度下对鲍曼不动杆菌的敏感和耐多药菌株具有抑制作用,其对鲍曼不动杆菌细胞膜的通透性可能是其杀菌的潜在机制[36]。
Cec是家蝇产生的天蚕素家族基因,其中Cec4的抑菌活性更为广谱,对鲍曼不动杆菌的抑菌效果非常强[37]。Cec4能在24 h内快速、浓度依赖性地杀灭鲍曼不动杆菌。此外,扫描电镜分析[37]表明Cec4通过破坏细胞膜完整性来杀菌。
3.2.2 Mdc
Mdc是一种从家蝇幼虫中提取的新型天蚕素抗菌肽,对革兰阳性菌和革兰阴性菌标准株均有较强的抑制活性[38]。Mdc的MIC为4 μg/mL, 其杀菌动力学显示对鲍曼不动杆菌快速灭活需30 min。流式细胞术检测结果[38]表明, Mdc诱导鲍曼不动杆菌细胞膜通透,且其作用时间与浓度有关。透射电镜检查显示, Mdc能够破坏细菌细胞膜,导致必要的细胞质成分外排。本研究中抗菌肽及其氨基酸序列见表 1。
表 1 本研究中抗菌肽及其氨基酸序列抗菌肽名称 氨基酸序列 LL-37 LLGDFFRKSKEKIGKEFKRIVQRIKDFLRNLVPRTES HD5 ATCYCRTGRCARESLSGVCEISGRLYRLCCR HD5d5 ARARCRRGRAARRRRLRGVCRIRGRLRRLAAR hBD-2 GIGDPVTCLKSGAICHPVFCPRRYKQIGTCGLPGTKCCKKP hBD-3 GIINTLQKYYCRVRGGRCAVLSCLPKEEQIGKCSTRGRKCCRRKK Magainin-1 GIGlLPLHSAGLPGLAPVGGIMLS Magainin-2 GIGKFLHSAKKFGKAFVGEIMNS Pexiganan GIGKFLKKAKKFGKAFVKILKK‐NH2 B2RP GIGKFLKKAKKFGKAFVKILKK‐NH2 Melittin GIGAVLKVLTTGLPALISWIKRKRQQ Cecropin A KWKLFKKIEKVGQNIRDGIIKAGPAVAVVGQATQIAK BR003-Cecropin A GGLKKLGKKLEGAGKRVFNAAEKALPVVAGAKALRK Mdc GWLKKIGKKIERVGQHTRDATIQTIGVAQQAANVAATLKG 4. 总结与展望
本文主要阐述了人源抗菌肽、两栖动物源抗菌肽和昆虫源抗菌肽在治疗鲍曼不动杆菌引起的感染中的作用及其机制。目前有关抗菌肽药动学、药效学方面的研究还比较少,大多数的抗菌肽试验只适用于局部治疗,比如LL-37的应用[39]。目前,已经进入临床试验阶段的抗菌肽有乳链菌肽、源于Magainin的MSI-78及源于protegin的IB-367, 用于治疗局部感染。因此,要在临床上更多地使用抗菌肽时,还要解决好它的毒性、免疫原性、应用方法、药物制剂等方面的问题。
抗菌肽的另一种潜在的应用是与抗生素共同给药。抗菌肽联合抗生素治疗可减少抗生素耐药性的发生。此外,许多研究已观察到抗菌肽和抗生素之间的体外协同作用[40]。当药物联合使用时,以更低的剂量可以减少毒性或不良副作用。本文可指导抗菌肽在控制临床感染中的应用,并为新型抗菌肽的研发提供思路。
-
表 1 不同浓度吉非替尼作用下PC-9细胞、PC-9/GR细胞的增殖率比较(n=6)(x±s)
吉非替尼浓度/(μmol/L) 增殖率/% PC-9细胞 PC-9/GR细胞 0 100.00±0 100.00±0 0.25 92.53±4.48* 94.12±4.79 0.50 82.74±4.16* 86.23±4.38* 1.00 70.80±4.05* 76.72±4.16*# 2.00 58.16±4.25* 65.02±4.14*# 4.00 49.89±4.50* 57.64±4.42*# 8.00 40.06±3.88* 49.22±3.95*# 与0 μmol/L比较, *P < 0.05; 与PC-9细胞比较, #P < 0.05。 表 2 转染后PC-9/GR细胞miR-338-3p表达水平比较(n=6)(x±s)
组别 miR-338-3p 对照组 1.00±0 miR-338-3p NC组 1.12±0.15 miR-338-3p组 2.20±0.17*# STAT1抑制剂组 2.16±0.18*# 与对照组比较, *P < 0.05;
与miR-338-3p NC组比较, #P < 0.05。表 3 各组PC-9/GR细胞增殖率比较(n=6)(x±s)
组别 增殖率/% 对照组 100.00±0 miR-338-3p NC组 98.63±5.65 miR-338-3p组 52.35±5.02* STAT1抑制剂组 82.68±5.46# 与miR-338-3p NC组比较, *P < 0.05;
与miR-338-3p组比较, #P < 0.05。表 4 各组PC-9/GR细胞凋亡率比较(n=6)(x±s)
组别 凋亡率/% 对照组 18.56±1.55 miR-338-3p NC组 18.04±1.60 miR-338-3p组 35.92±2.69* STAT1抑制剂组 22.83±2.15# 与miR-338-3p NC组比较, *P < 0.05;
与miR-338-3p组比较, #P < 0.05。表 5 各组PC-9/GR细胞中p-STAT1、STAT1、PD-L1、Bcl-2、Bax蛋白表达水平比较(n=6)(x±s)
组别 p-STAT1/STAT1 PD-L1/GAPDH Bcl-2/GAPDH Bax/GAPDH 对照组 0.45±0.06 0.72±0.06 0.80±0.07 0.43±0.05 miR-338-3p NC组 0.47±0.07 0.71±0.07 0.83±0.07 0.40±0.05 miR-338-3p组 0.83±0.07* 0.39±0.05* 0.40±0.04* 0.88±0.06* STAT1抑制剂组 0.60±0.06# 0.58±0.06# 0.65±0.05# 0.57±0.06# 与miR-338-3p NC组比较, *P < 0.05; 与miR-338-3p组比较, #P < 0.05。 -
[1] 刘威, 胡轶. 肺癌的诊断[J]. 临床内科杂志, 2020, 37(2): 73-77. doi: 10.3969/j.issn.1001-9057.2020.02.001 [2] 玄香兰, 安昌善. c-MET抑制剂联合EGFR-TKI对耐药肺癌细胞增殖、凋亡的影响及其机制[J]. 山东医药, 2017, 57(39): 15-18. doi: 10.3969/j.issn.1002-266X.2017.39.004 [3] ZHAO Y, PAN Y J, CHENG C, et al. EGFR-mutant lung adenocarcinoma harboring co-mutational tumor suppressor genes predicts poor prognosis[J]. J Cancer Res Clin Oncol, 2020, 146(7): 1781-1789. doi: 10.1007/s00432-020-03237-3
[4] XIA X H, LIU Y, LIAO Y N, et al. Synergistic effects of gefitinib and thalidomide treatment on EGFR-TKI-sensitive and-resistant NSCLC[J]. Eur J Pharmacol, 2019, 856: 172409. doi: 10.1016/j.ejphar.2019.172409
[5] LIU L B, JIANG Z J, JIANG X L, et al. Up-regulation of SNHG15 facilitates cell proliferation, migration, invasion and suppresses cell apoptosis in breast cancer by regulating miR-411-5p/VASP axis[J]. Eur Rev Med Pharmacol Sci, 2020, 24(4): 1899-1912.
[6] SEIDL C, PANZITT K, BERTSCH A, et al. microRNA-182-5p regulates hedgehog signaling pathway and chemosensitivity of cisplatin-resistant lung adenocarcinoma cells via targeting GLI2[J]. Cancer Lett, 2020, 469: 266-276. doi: 10.1016/j.canlet.2019.10.044
[7] HAQUE I, KAWSAR H I, MOTES H, et al. Downregulation of miR-506-3p facilitates EGFR-TKI resistance through induction of sonic hedgehog signaling in non-small-cell lung cancer cell lines[J]. Int J Mol Sci, 2020, 21(23): 9307. doi: 10.3390/ijms21239307
[8] DUAN X, GUO G C, PEI X H, et al. Baicalin inhibits cell viability, migration and invasion in breast cancer by regulating miR-338-3p and MORC4[J]. Onco Targets Ther, 2019, 12: 11183-11193. doi: 10.2147/OTT.S217101
[9] 张伟, 彭燕琪, 费思佳, 等. miR-338通过靶向GPX4抑制非小细胞肺癌细胞增殖[J]. 现代肿瘤医学, 2020, 28(23): 4041-4045. doi: 10.3969/j.issn.1672-4992.2020.23.005 [10] DING Z L, ZHU J J, ZENG Y Y, et al. The regulation of Neuropilin 1 expression by miR-338-3p promotes non-small cell lung cancer via changes in EGFR signaling[J]. Mol Carcinog, 2019, 58(6): 1019-1032. doi: 10.1002/mc.22990
[11] LU W J, DU F F, ZHAO X W, et al. Sulforaphane-conjugated carbon dots: a versatile nanosystem for targeted imaging and inhibition of EGFR-overexpressing cancer cells[J]. ACS Biomater Sci Eng, 2019, 5(9): 4692-4699. doi: 10.1021/acsbiomaterials.9b00690
[12] 高艳, 郭婵娟, 张银, 等. 非小细胞肺癌EGFR基因检测的临床意义[J]. 中外医学研究, 2017, 15(14): 17-18. https://www.cnki.com.cn/Article/CJFDTOTAL-YJZY201714009.htm [13] 刘红柳, 杨家梅. 培美曲塞单药或联合吉非替尼治疗EGFR-TKI耐药后晚期非小细胞肺癌临床观察[J]. 中国癌症杂志, 2017, 27(2): 135-139. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGAZ201702011.htm [14] XU G F, ZHANG B, YE J H, et al. Exosomal miRNA-139 in cancer-associated fibroblasts inhibits gastric cancer progression by repressing MMP11 expression[J]. Int J Biol Sci, 2019, 15(11): 2320-2329. doi: 10.7150/ijbs.33750
[15] YUAN L Y, ZHOU M, LV H B, et al. Involvement of NEAT1/miR-133a axis in promoting cervical cancer progression via targeting SOX4[J]. J Cell Physiol, 2019, 234(10): 18985-18993. doi: 10.1002/jcp.28538
[16] LUO W G, ZHANG H H, LIANG X, et al. DNA methylation regulated miR-155-5p depresses sensitivity of esophageal carcinoma cells to radiation and multiple chemotherapeutic drugs via suppression of MAP3K10[J]. Oncol Rep, 2020, 43(5): 1692-1704.
[17] 王文静, 王晓霏, 刘利英, 等. miR-338-3p在恶性肿瘤中的表达异常及其表观遗传组蛋白的修饰位点[J]. 西安交通大学学报: 医学版, 2019, 40(5): 706-710, 721. https://www.cnki.com.cn/Article/CJFDTOTAL-XAYX201905009.htm [18] VAN DER SIJDE F, VIETSCH E E, MUSTAFA D A M, et al. Serum miR-338-3p and miR-199b-5p are associated with the absolute neutrophil count in patients with resectable pancreatic cancer[J]. Clin Chim Acta, 2020, 505: 183-189. doi: 10.1016/j.cca.2020.03.005
[19] 潘彩彬, 王武炼, 吴广文, 等. 独活寄生汤含药血清对大鼠退变软骨细胞Bcl-2、Bax表达的影响[J]. 风湿病与关节炎, 2014, 3(12): 30-33. https://www.cnki.com.cn/Article/CJFDTOTAL-FSBG201412009.htm [20] DALLOS M C, DRAKE C G. Blocking PD-1/PD-L1 in genitourinary malignancies: to immunity and beyond[J]. Cancer J, 2018, 24(1): 20-30. doi: 10.1097/PPO.0000000000000302
[21] 陈秀红, 李坤, 靳爽, 等. 非小细胞肺癌中卵巢肿瘤泛素异肽酶1与程序性死亡受体-1配体的表达相关性[J]. 实用临床医药杂志, 2021, 25(23): 31-36. doi: 10.7619/jcmp.20213152 [22] HSU M M, BALAR A V. PD-1/PD-L1 combinations in advanced urothelial cancer: rationale and current clinical trials[J]. Clin Genitourin Cancer, 2019, 17(3): e618-e626. doi: 10.1016/j.clgc.2019.03.009
[23] 胡新龙, 林超, 鞠海涛, 等. STAT1和STAT3在脑胶质瘤中作用的研究进展与展望[J]. 现代肿瘤医学, 2019, 27(23): 4315-4319. https://www.cnki.com.cn/Article/CJFDTOTAL-SXZL201923048.htm [24] 汤小龙, 陈旭峰, 郑杨, 等. miR-125a-5p和信号传导与转录激活因子3在胃癌中的表达及其生物学功能[J]. 实用临床医药杂志, 2021, 25(20): 61-67. doi: 10.7619/jcmp.20212363 [25] 孙思博, 金时代, 郭人花. STAT3在非小细胞肺癌耐药中的研究进展[J]. 中国肺癌杂志, 2019, 22(7): 457-463. https://www.cnki.com.cn/Article/CJFDTOTAL-FAIZ201907009.htm




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号
