The uc.339 promotes the growth of renal cell carcinoma through miR-95/K-RAS signaling pathway
-
摘要:目的 探讨uc.339经miR-95/K-RAS促进肾癌细胞增殖、凋亡和迁移的机制。方法 收集76例肾透明细胞癌组织及癌旁正常组织,应用RNA原位杂交技术检测uc.339表达情况,并分析其与肾透明细胞癌患者病理参数的相关性。CCK-8法检测肾癌细胞增殖活性; Annexin V/PI法检测细胞凋亡; Transwell小室检测肾癌细胞的迁移能力; 双荧光素酶报告实验验证miR-95对靶基因K-RAS的调控; Western blot方法分析uc.339下游基因蛋白的表达。结果 uc.339在肾透明细胞癌组织中呈阳性表达,占77.63%(59/76), 其阳性表达与肿瘤大小、肿瘤TNM分期均密切相关(P < 0.05)。uc.339对肾癌细胞迁移能力无影响。过表达uc.339促进肾癌增殖活性、抑制细胞凋亡,而降低uc.339表达则抑制肾癌增殖活性、促进细胞凋亡(P < 0.05)。实时荧光定量聚合酶链反应(qRT-PCR)验证uc.339下游靶基因是微小RNA-95(miR-95); 双荧光素酶报告基因实验表明miR-95与K-RAS的结合具有特异性, K-RAS是miR-95的直接靶基因。Western blot和Rescue实验表明无论uc.339和miR-95如何变化, K-RAS都能受到uc.339的调控。结论 在肾癌中, uc.339抑制了miR-95的表达,进而升高K-RAS蛋白水平,促进肾癌生长。本研究为今后诊断和治疗肾癌提供有力的理论依据。Abstract:Objective To investigate the mechanism of uc.339 in promoting proliferation, apoptosis and migration of renal cell carcinoma cells by miR-95/K-RAS.Method Renal clear cell carcinoma and adjacent normal tissues of 76 cases were collected. The expression of uc.339 was detected by RNA in situ hybridization, and its correlation with pathological parameters of patients with ccRCC was analyzed. The proliferative activity of renal clear cell carcinoma cells was detected by CCK-8; Annexin V/PI was used to detect apoptosis; Transwell chamber was used to detect the migration ability of renal cancer cells; the regulation of miR-95 on the target gene K-RAS was verified by the double luciferase report experiment. Western blot was used to analyze the expression of the downstream gene protein of uc.339.Results The uc.339 was positive in renal clear cell carcinoma, accounting for 77.63%(59/76); the positive expression was closely related to tumor size and TNM stage (P < 0.05). Uc.339 had no effect on the migration ability of renal cell carcinoma cells. Overexpression of uc.339 promoted the proliferative activity and inhibited apoptosis of renal cell carcinoma, while reduced the expression of uc.339 inhibited the proliferative activity and promoted apoptosis of renal cell carcinoma (P < 0.05). Quantitative real-time polymerase chain reaction (qRT-PCR) confirmed that the downstream target gene of uc.339 was miR-95; the double luciferase reporter gene experiment showed that the binding-site between miR-95 and K-RAS was specific, and K-RAS was the direct target gene of miR-95. The results of Western blot and rescue showed that K-RAS could be regulated by uc.339 regardless of the changes of uc.339 and miR-95.Conclusion In renal cell carcinoma, uc.339 inhibits the expression of miR-95 and increases the level of K-RAS protein, and promotes the growth of renal cell carcinoma. This study provides a strong theoretical basis for the diagnosis and treatment of renal cell carcinoma in the future.
-
Keywords:
- clear cell renal cell carcinoma /
- uc.339 /
- miR-95 /
- K-RAS /
- proliferation /
- apoptosis /
- migration /
- target gene
-
肾细胞癌(RCC)是起源于肾单位中肾小管上皮细胞的恶性肿瘤,是泌尿系统最常见的肿瘤之一,占成人恶性肿瘤的2%~3%[1]。透明细胞肾细胞癌(ccRCC)是RCC最常见的病理学亚型,约占RCC的80%[2]。局限性ccRCC可以通过部分或全部手术切除肾脏来治疗,但找到ccRCC早期诊断、治疗的靶目标仍然是一个临床难题。癌症是一种复杂的遗传疾病,其不仅由蛋白质编码基因的失调引起,还且由非编码RNA (ncRNA)的失调引起。研究[3-4]表明,长链非编码RNA影响肿瘤的发生发展。uc.339作为一种长链非编码RNA, 也参与了肿瘤的微环境,促进了肿瘤细胞的转化过程[5]。目前, uc.339在肾癌中的功能和发生机理的文献报道较少,故本研究重点关注uc.339对肾细胞癌的影响及其可能的分子机制。
1. 资料与方法
1.1 临床标本
76例新鲜的肾透明细胞癌组织和邻近正常组织来源于扬州大学附属医院泌尿外科手术患者,手术时间为2019年1月—2021年1月,年龄31~75岁,中位年龄为53岁; 男48例,女28例。透明细胞癌的诊断由病理科医师负责。所有患者手术前未经过放疗和化疗处理。标本使用及临床资料的收集均经扬州大学附属医院伦理委员会批准,并与患者签署知情同意书。新鲜标本采集后立即放入液氮罐里,于-80 ℃冰箱内长期保存,以备后期实验所用。
1.2 材料和细胞
人肾透明细胞癌细胞株786-O细胞株购自于中国科学院上海细胞生物研究所。肾癌细胞系在RPMI-1640培养基(US)中培养,并添加青霉素G(100 U/mL)、链霉素(100 mg/mL)和10%胎牛血清(FBS)。所有细胞系均在37 ℃、含5% CO2的增湿空气中培养。K-RAS抗体购自美国Abcam。过表达/敲低uc.339载体质粒购买于上海生工生物工程公司。
1.3 RNA原位分子杂交实验(RISH)
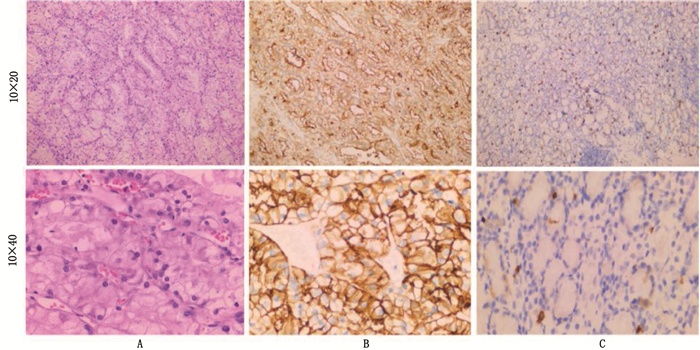
uc.339 RNA探针和原位杂交试剂盒购于武汉BOSTER生物工程有限公司,探针序列5′-GGATCGGTGTGAAATAACGGGCCCATATAAATCCC-3′。主要实验步骤如下: 将厚度5 μm切片用胃蛋白酶消化RNA核酸片段。先是预杂交,然后使用uc.339 RNA探针进行杂交, H2O2封闭液后滴加抗地高辛, 1 h后滴加链霉亲和素-生物素复合物,最后滴加生物素化过氧化物酶。使用DAB将阳性物质染成棕黄色颗粒或团块,用苏木素将胞核染成蓝色进行对比,封片后光镜观察。结果判定: 细胞中出现棕黄色物质为uc.339阳性细胞; 光镜下随机选择5个高倍视野,计算阳性细胞与总细胞数的百分率, < 1%为阴性, 1%~100%为阳性。根据试剂说明书推荐设置阳性对照组,不加探针的染色组织为空白对照组。
1.4 CCK8实验检测细胞增殖活性
将培养至对数生长期的肿瘤细胞(实验组和对照组)按照每个孔内添加4 000个细胞,接种到96孔细胞培养板中。每个孔内添加100 μL的细胞培养液,细胞培养24 h后,按1∶10的比例混合CCK8培养液与相应培养液,备用。弃去96孔板中的培养液,每孔加入100 μL CCK-8溶液。置于恒温培养箱中孵育30~60 min。使用酶标仪测定每孔液体在450 nm波长下的吸光度(OD)变化。
1.5 Transwell侵袭迁移实验
用无血清细胞培养液制备成单细胞悬浮液(2×105/mL); 若进行侵袭实验,将Matrigel胶用无血清培养基稀释至300 μL/mL, 取100 μL均匀涂抹PET膜上表面,然后将小室轻轻放入24孔板孔内, 37 ℃放置3 h左右,取出于超净工作台过夜干燥(如进行迁移实验,则跳过此步骤)。在下室加入600 μL含10%血清的培养基,上室加入150 μL细胞悬液,继续孵化24 h; 用磷酸盐缓冲液(PBS)洗涤,添加95%的乙醇固定15 min, 用结晶紫染色。随机选5个视野,在光镜下统计侵袭迁移数量。
1.6 生物信息学预测下游靶基因及验证
uc.339的靶基因微小RNA(miRNA)预测见先前的文献[6]。miR-95-5p (miR-95)下游靶基因预测网站为www.targetscan.org和mirtarbase.mbc.nctu.edu.tw/php/index.php。miR-95下游靶基因的有效验证通过双荧光素酶报告基因实验。
1.7 Western blot检测蛋白的表达
实验组和对照组细胞培养24 h以后,在细胞中加入RIPA液[含1% 苯甲磺酰氟(PMSF)], 冰上裂解30 min, 然后4 ℃、12 000 g离心15 min, 吸取上清并分装,以BCA方法测定蛋白浓度。十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)采用10%分离胶、5%浓缩胶。把2×Loading Buffer添加到蛋白溶液中,在100 ℃前提下孵化5 min。每个上样孔中分别加入30 μg蛋白样品,电泳使用70 V的电压,观察染料到达分离胶时,调整电压为100 V继续电泳,观察溴酚蓝到达凝胶的下端时,终止电泳。把凝胶取出,裁剪合适大小的NC膜,放在转移缓冲液中浸泡备用。设置200 mA恒流、冰上转膜50 min。把NC膜置于5%牛血清白蛋白内,于室温环境孵育2 h。将一抗(1∶1 000)溶液稀释后放入NC膜,放在4 ℃孵化12 h。最后用二抗工作液浸泡NC膜, 37 ℃结合2 h。按照显色后分析条带的灰度值计算蛋白表达水平。将GAPDH设置为内参。
1.8 Annexin V/PI法检测细胞凋亡
收集细胞4×106/mL, 缓冲液洗涤,用100 μL的标记溶液重悬细胞,室温下避光孵育15 min。离心、缓冲液洗涤后,加入荧光SA-FLOUS溶液。4 ℃下孵育20 min, 避光并不时振动。然后使用流式细胞仪检测FITC荧光和PI染料。结果判断: 在散点图上,左下象限显示活细胞,为(FITC-/PI-); 右上象限是非活细胞,即坏死细胞,为(FITC+/PI+); 而右下象限为凋亡细胞,显现(FITC+/PI-)。
1.9 统计学分析
所有数据均采用SPSS 16.0软件进行统计。计量数据用(x±s)表示, 2组数据间比较用t检验, 3组数据间比较用方差分析; 计数资料比较采用χ2检验, P < 0.05为差异有统计学意义。
2. 结果
2.1 uc.339在ccRCC组织中的表达情况
ccRCC常规HE染色显示,癌细胞排列腺泡状或管状似肾小管,癌细胞大小不一,胞浆透明(图 1A)。RISH结果表明, 76例ccRCC组织中uc.339阳性染色为深浅不一的棕黄色颗粒,主要定位于细胞质和胞核(图 1B); 癌旁正常肾小管组织中为阴性表达,偶有棕黄色颗粒(图 1C)。uc.339在ccRCC组织中的阳性百分比值为(0.814±0.126), 高于癌旁正常组织(0.081±0.023), 差异有统计学意义(t=14.268, P < 0.05); 阳性百分比 < 1%为阴性病例(17例), 1%~100%为阳性病例(59例)。
2.2 uc.339的阳性表达与患者临床病理参数的相关性
在76例ccRCC组织中,根据阳性细胞百分比, uc.339阳性例数为59例,阴性例数17例。统计结果显示, uc.339的阳性表达与肿瘤的大小、TNM分期密切相关(P < 0.05), 但是与患者年龄、性别、淋巴结转移均无关联(P>0.05)。见表 1。
表 1 uc.339的阳性表达及其临床病理意义临床病理参数 uc.339阳性(n=59) uc.339阴性(n=17) χ2 P值 患者年龄 0.901 0.342 <50岁 27 10 ≥50岁 32 7 患者性别 0.048 0.827 男 40 12 女 19 5 肿瘤大小 8.920 0.003 <3 cm 21 13 ≥3 cm 38 4 淋巴结转移 0.273 0.601 阳性 32 8 阴性 27 9 TNM分期 4.038 0.044 Ⅰ、Ⅱ期 22 11 Ⅲ、Ⅳ期 37 6 2.3 uc.339促进肾癌细胞增殖活性
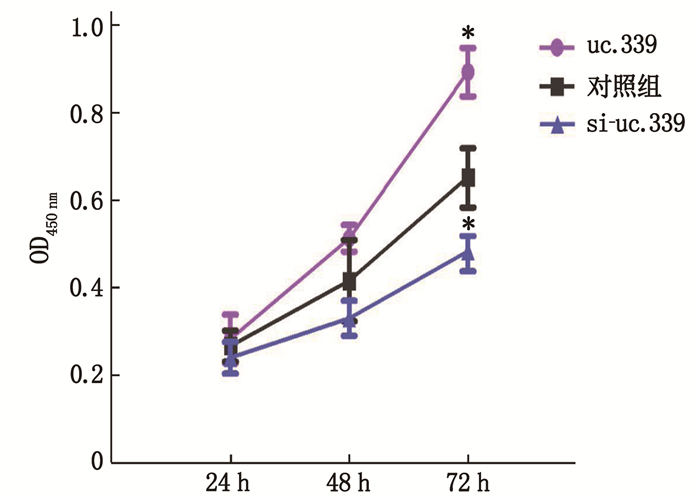
过表达uc.339后,肾癌细胞的增殖活性升高(P < 0.05); 敲低uc.339表达后,肾癌细胞的增殖活性降低(P < 0.05)。说明uc.339能增加肾癌细胞的增殖活性,促进肾癌细胞的生长。见表 2、图 2。
表 2 uc.339对肾癌细胞增殖活性(OD值)影响(x±s)时点 OD值 uc.339过表达 对照组 敲低uc.339表达 24 h 0.283±0.03* 0.267±0.04 0.240±0.02* 48 h 0.514±0.05* 0.417±0.06 0.330±0.03* 72 h 0.893±0.07* 0.653±0.08 0.483±0.05* 与对照组比较, *P < 0.05。 2.4 uc.339抑制肾癌细胞的凋亡
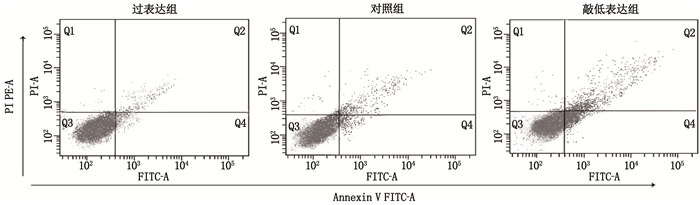
在786-O细胞中,对照组细胞凋亡的数目为13.9%, 细胞坏死的数目为12.6%; 过表达uc.339后,细胞凋亡数目(7.8%, Q4)和细胞坏死数目(7.2%, Q2)减少,差异有统计学意义(P < 0.05); 降低uc.339表达后,细胞凋亡数目(21.8%, Q4)和细胞坏死数目(20.4%, Q2)增多,差异有统计学意义(P < 0.05)。说明uc.339在抑制细胞凋亡和细胞坏死的同时促进了细胞的生长。见图 3。
2.5 uc.339对肾癌细胞迁移的影响不大
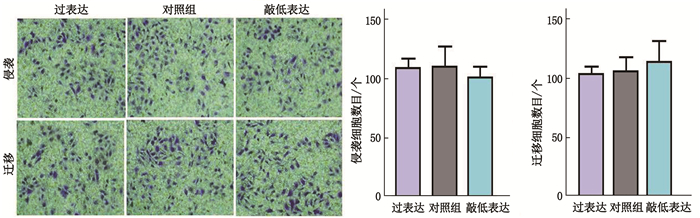
Transwell结果表明,与对照组相比,过表达uc.339后肾癌细胞的侵袭和迁移数目无增多,敲低uc.339表达后的肾癌细胞的侵袭和迁移数目也未减少,差异无统计学意义(P>0.05)。见图 4。
2.6 uc.339的下游靶基因的预测及验证
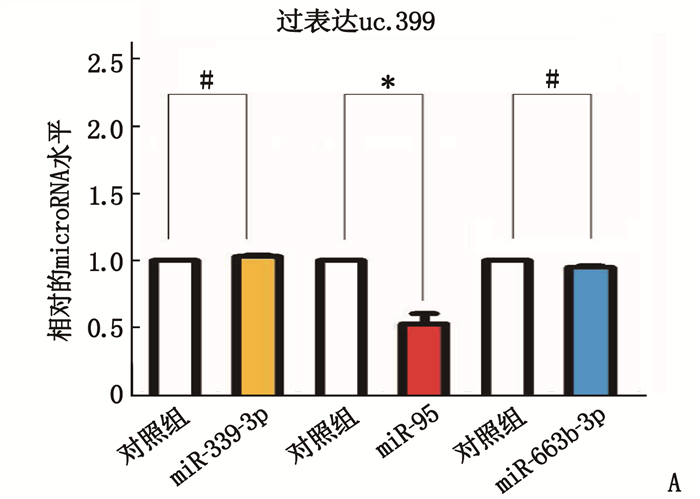
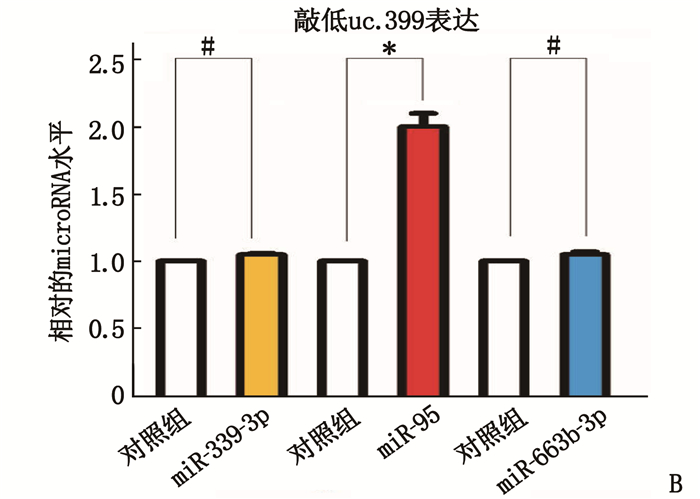
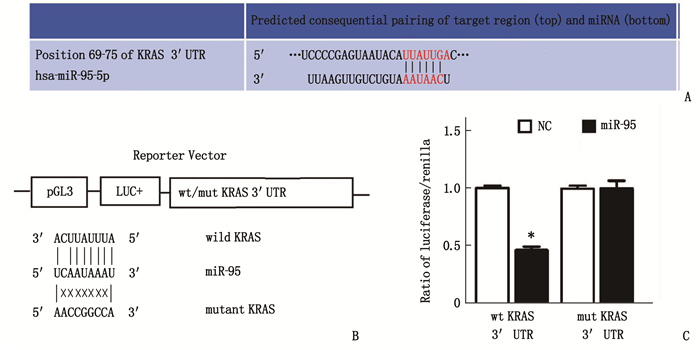
uc.339预测的下游miRNA[6], 包括miR-339-3P、miR-95和miR-663b-3P。在肾癌细胞中改变uc.339的表达后仅仅miR-95随之变化(图 5), 因此得出miR-95是uc.339的下游靶基因。同时根据miRNA网站预测出miR-95的靶基因,再结合双荧光素酶报告实验验证(图 6)得出K-RAS是miR-95的靶基因。在转染K-RAS 3′UTR野生型后, miR-95高表达可抑制相应的荧光活性,而在转染突变型后miR-95则无这种抑制作用。因此miR-95与K-RAS的结合是特异性的。K-RAS 3′UTR是miR-95的直接结合位点, K-RAS是miR-95的直接靶基因。
2.7 uc.339对miR-95/K-RAS信号通路和增殖的影响
改变uc.339和miR-95表达后,观察K-RAS蛋白的变化。实验组包括: 过表达uc.339组、敲低uc.339表达组、过表达uc.339组+过表达miR-95组、敲低uc.339表达组+敲低miR-95表达组、过表达uc.339组+敲低miR-95表达组和敲低uc.339表达组+过表达miR-95组。另设立对照组(未转染任何质粒)。结果显示, uc.339能促进肾癌细胞的K-RAS蛋白表达; 功能研究证实,过度表达miR-95可以消除uc.339对肾癌增殖的促进作用,而降低miR-95的表达可进一步激发肾癌细胞的增殖能力,因而促进肾癌细胞的生长。见图 7、表 3。
表 3 Rescue回复实验对肾癌细胞增殖活性(OD值)影响(x±s)组别 24 h 48 h 72 h 对照组 0.253±0.02 0.385±0.04 0.703±0.06 过表达uc.339组 0.286±0.02* 0.567±0.04* 0.853±0.05* 敲低uc.339表达组 0.240±0.02* 0.330±0.03* 0.582±0.05* 过表达uc.339组+过表达miR-95组 0.261±0.03 0.394±0.03 0.693±0.06 敲低uc.339表达组+敲低miR-95表达组 0.258±0.03 0.387±0.04 0.689±0.05 过表达uc.339组+敲低miR-95表达组 0.306±0.04* 0.614±0.05* 0.968±0.07* 敲低uc.339表达组+过表达miR-95组 0.212±0.03* 0.305±0.02* 0.419±0.03* 与对照组比较, *P < 0.05。 3. 讨论
肾癌是最常见的恶性肿瘤之一,在所有新发癌症病例中占4.2%[7]。肾癌最常见的病理类型是肾透明细胞癌(ccRCC),其发病率和死亡率逐年上升[8]。虽然局部ccRCC可以通过肾脏手术消融治疗,使得患者病情有所好转,但最终晚期患者的预后较差, 5年总生存率(OS)低于20%[9], 主要是因为用于ccRCC早期检测和预后预测的生物标志物有限[10]。因此寻找新的生物标志物就变得尤其迫切。通过ncRNA的测序[11]和生物信息学[12]挖掘可以快速选择可能的靶点,为治疗和干预肾透明细胞癌患者提供理论基础。本研究通过预测uc.339的下游靶基因,为研究uc.339在肾癌中的作用提供了依据。
uc.339定位于12号染色体52357363~52357614区间,全长252 nt, 是超保守RNA(UCR)中的一员,属于长链非编码RNA, 但也有其独自的特点,主要表现为其在远亲哺乳动物物种(如人类、小鼠、大鼠)的同源区域具有100%的相似性[13]。在人类基因组中共有483个UCR, 一些UCR在癌症中异常表达,与肿瘤细胞的发生发展相关联[14]。例如, uc.339的高表达与210例非小细胞肺癌患者的低生存率相关。uc.339作为miR-339、miR-663b和miR-95的内源性竞争RNA(ceRNA), 通过海绵作用抑制这些miRNAs, 使得靶基因cyclin E2具有更高的表达水平,引起肺癌细胞生长加速和迁移能力增加[6]。SANA J等[15]发现54例大肠癌和15例邻近正常组织中uc.339、uc. 43、uc. 73、uc. 134、uc. 230、uc. 399和uc. 388的表达水平与大肠癌临床病理特征相关。MORANDI L等[16]研究结果表明, 7个UCRs(uc.339,uc. 160, uc. 283, uc. 416, uc. 270, uc. 299和uc. 328)在人类和其他哺乳动物鳞状细胞癌中高度甲基化。这些结论阐明了uc.339在人类肿瘤中的作用,也为uc.339在肾癌中研究提供了依据。本研究结果显示, uc.339在ccRCC组织中呈阳性表达,并与肿瘤大小、肿瘤TNM分期密切相关。过表达uc.339能促进肾癌细胞的增殖并能抑制细胞凋亡。这就说明uc.339在肾癌细胞中也是一个促癌基因,能促进肿瘤细胞的生长,进一步证实了uc.339能在不同肿瘤中起到重要的作用。VANNINI I等[6]结果还表明uc.339能促进肺癌细胞的迁移能力,但本研究未发现uc.339在肾癌细胞中有促进迁移的能力,究其原因可能是uc.339在不同肿瘤中的作用具有差异。
在肾癌机制方面的研究中,本研究表明uc.339仅作为miR-95的海绵体,吸引并抑制其对下游靶基因K-RAS的调控。K-RAS基因在多种肿瘤中容易出现基因突变,是一种常见的致癌基因。在非小细胞肺癌中K-RAS突变后抑制AKT1表达,激活MARCKS-LAMC2复合体促进肺癌细胞侵袭转移[17]。在胰腺癌中K-RAS基因突变后蛋白活化,从而导致激活Hedgehog通路和NF-κB蛋白表达,参与胰腺癌的发生[18]。K-RAS表达增高和Smad4表达降低,相互作用影响表皮生长因子受体(EGFR)的表达,导致p65的表达升高,激活基质金属蛋白酶-9(MMP-9)和uPA表达上调,引起癌细胞的侵袭转移[19]。K-RAS是RASSF1A下游信号转导中的一个效应物, RASSF1A基因可能因甲基化等因素,导致其表达缺失,对K-RAS的抑制作用解除, K-RAS更多地发挥促进生长效应,而最终导致大肠癌和非小细胞肺癌的发生发展[20-21]。本研究并未去检验K-RAS基因有无突变位点,而是发现其在肾癌中表达水平升高, miR-95被uc.339大量的内源性竞争,解除了miR-95对K-RAS的转录后抑制,导致其高水平表达; 亦不排除uc.339直接促进K-RAS的表达。在功能性研究中, uc.339能促进肾癌细胞的增殖活性并抑制细胞凋亡,可以理解为uc.339能缩短细胞的生长周期时间,且成熟的肾癌细胞也不会轻易凋亡死掉,从而使得肿瘤瘤体不断增大,为后续的肿瘤发生发展做准备。
综上所述, uc.339通过下调miR-95表达后,升高K-RAS的蛋白表达水平,从而促进肾癌细胞的生长,减少肿瘤细胞的凋亡。这一研究为丰富肾癌发生发展的机制提供了新的内容,也为今后在ccRCC研究中,开发基于uc.339的诊断指标和治疗靶点提供一定的理论依据。
-
表 1 uc.339的阳性表达及其临床病理意义
临床病理参数 uc.339阳性(n=59) uc.339阴性(n=17) χ2 P值 患者年龄 0.901 0.342 <50岁 27 10 ≥50岁 32 7 患者性别 0.048 0.827 男 40 12 女 19 5 肿瘤大小 8.920 0.003 <3 cm 21 13 ≥3 cm 38 4 淋巴结转移 0.273 0.601 阳性 32 8 阴性 27 9 TNM分期 4.038 0.044 Ⅰ、Ⅱ期 22 11 Ⅲ、Ⅳ期 37 6 表 2 uc.339对肾癌细胞增殖活性(OD值)影响(x±s)
时点 OD值 uc.339过表达 对照组 敲低uc.339表达 24 h 0.283±0.03* 0.267±0.04 0.240±0.02* 48 h 0.514±0.05* 0.417±0.06 0.330±0.03* 72 h 0.893±0.07* 0.653±0.08 0.483±0.05* 与对照组比较, *P < 0.05。 表 3 Rescue回复实验对肾癌细胞增殖活性(OD值)影响(x±s)
组别 24 h 48 h 72 h 对照组 0.253±0.02 0.385±0.04 0.703±0.06 过表达uc.339组 0.286±0.02* 0.567±0.04* 0.853±0.05* 敲低uc.339表达组 0.240±0.02* 0.330±0.03* 0.582±0.05* 过表达uc.339组+过表达miR-95组 0.261±0.03 0.394±0.03 0.693±0.06 敲低uc.339表达组+敲低miR-95表达组 0.258±0.03 0.387±0.04 0.689±0.05 过表达uc.339组+敲低miR-95表达组 0.306±0.04* 0.614±0.05* 0.968±0.07* 敲低uc.339表达组+过表达miR-95组 0.212±0.03* 0.305±0.02* 0.419±0.03* 与对照组比较, *P < 0.05。 -
[1] ARABSALMANI M, MOHAMMADIAN-HAFSHEJANI A, GHONCHEH M, et al. Incidence and mortality of kidney cancers, and human development index in Asia; a matter of concern[J]. J Nephropathol, 2017, 6(1): 30-42.
[2] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1): 7-30. doi: 10.3322/caac.21590
[3] XING C, SUN S G, YUE Z Q, et al. Role of lncRNA LUCAT1 in cancer[J]. Biomed Pharmacother, 2021, 134: 111158. doi: 10.1016/j.biopha.2020.111158
[4] STATELLO L, GUO C J, CHEN L L, et al. Gene regulation by long non-coding RNAs and its biological functions[J]. Nat Rev Mol Cell Biol, 2021, 22(2): 96-118.
[5] KOGURE T, YAN I K, LIN W L, et al. Extracellular vesicle-mediated transfer of a novel long noncoding RNA TUC339: a mechanism of intercellular signaling in human hepatocellular cancer[J]. Genes Cancer, 2013, 4(7/8): 261-272.
[6] VANNINI I, WISE P M, CHALLAGUNDLA K B, et al. Transcribed ultraconserved region 339 promotes carcinogenesis by modulating tumor suppressor microRNAs[J]. Nat Commun, 2017, 8(1): 1801. doi: 10.1038/s41467-017-01562-9
[7] PETITPREZ F, AYADI M, DE REYNI? S A, et al. Review of prognostic expression markers for clear cell renal cell carcinoma[J]. Front Oncol, 2021, 11: 643065. doi: 10.3389/fonc.2021.643065
[8] SATO Y, YOSHIZATO T, SHIRAISHI Y, et al. Integrated molecular analysis of clear-cell renal cell carcinoma[J]. Nat Genet, 2013, 45(8): 860-867. doi: 10.1038/ng.2699
[9] CASUSCELLI J, VANO Y A, FRIDMAN W H, et al. Molecular classification of renal cell carcinoma and its implication in future clinical practice[J]. Kidney Cancer, 2017, 1(1): 3-13. doi: 10.3233/KCA-170008
[10] CUI H, SHAN H J, MIAO M Z, et al. Identification of the key genes and pathways involved in the tumorigenesis and prognosis of kidney renal clear cell carcinoma[J]. Sci Rep, 2020, 10(1): 4271. doi: 10.1038/s41598-020-61162-4
[11] BRAGA E A, FRIDMAN M V, LOGINOV V I, et al. Molecular mechanisms in clear cell renal cell carcinoma: role of miRNAs and hypermethylated miRNA genes in crucial oncogenic pathways and processes[J]. Front Genet, 2019, 10: 320.
[12] QUE W C, QIU H Q, CHENG Y, et al. PTEN in kidney cancer: a review and meta-analysis[J]. Clin Chim Acta, 2018, 480: 92-98. doi: 10.1016/j.cca.2018.01.031
[13] PENG J C, SHEN J, RAN Z H. Transcribed ultraconserved region in human cancers[J]. RNA Biol, 2013, 10(12): 1771-1777. doi: 10.4161/rna.26995
[14] 周俊. 超保守RNA uc. 454抑制肺癌细胞侵袭转移的机制研究[D]. 苏州: 苏州大学, 2020. [15] SANA J, HANKEOVA S, SVOBODA M, et al. Expression levels of transcribed ultraconserved regions uc. 73 and uc. 388 are altered in colorectal cancer[J]. Oncology, 2012, 82(2): 114-118. doi: 10.1159/000336479
[16] MORANDI L, SABATTINI S, RENZI A, et al. An evolutionary cancer epigenetic approach revealed DNA hypermethylation of ultra-conserved non-coding elements in squamous cell carcinoma of different mammalian species[J]. Cells, 2020, 9(9): 2092. doi: 10.3390/cells9092092
[17] RAO G H, PIEROBON M, KIM I K, et al. Inhibition of AKT1 signaling promotes invasion and metastasis of non-small cell lung cancer cells with K-RAS or EGFR mutations[J]. Sci Rep, 2017, 7(1): 7066.
[18] VISANI M, DE BIASE D, BACCARINI P, et al. Multiple KRAS mutations in pancreatic adenocarcinoma: molecular features of neoplastic clones indicate the selection of divergent populations of tumor cells[J]. Int J Surg Pathol, 2013, 21(6): 546-552. doi: 10.1177/1066896912475073
[19] BERA A, ZHAO S J, CAO L, et al. Oncogenic K-Ras and loss of Smad4 mediate invasion by activating an EGFR/NF-κB Axis that induces expression of MMP9 and uPA in human pancreas progenitor cells[J]. PLoS One, 2013, 8(12): e82282. doi: 10.1371/journal.pone.0082282
[20] VAN ENGELAND M, ROEMEN G M J M, BRINK M, et al. K-ras mutations and RASSF1A promoter methylation in colorectal cancer[J]. Oncogene, 2002, 21(23): 3792-3795.
[21] WANG J, WANG B C, CHEN X, et al. The prognostic value of RASSF1A promoter hypermethylation in non-small cell lung carcinoma: a systematic review and meta-analysis[J]. Carcinogenesis, 2011, 32(3): 411-416.
-
期刊类型引用(2)
1. 仇姝,陆红梅,周洁. 子宫颈鳞状细胞癌中超保守核糖核酸339的表达及其临床病理意义. 实用临床医药杂志. 2023(11): 32-37+42 .  本站查看
本站查看
2. 王嫚,周洁,严雪冰,王成海. 长链非编码RNA-PVT1促进肾癌细胞的迁移和转移. 实用临床医药杂志. 2023(20): 39-47 .  本站查看
本站查看
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
