Concentration of amphotericin B in blood based on two-dimensional high performance liquid chromatography
-
摘要:目的
基于二维高效液相色谱法建立两性霉素B血药浓度的测定方法。
方法第一维色谱柱采用Aston SX1色谱柱(3.5 mm×25.0 mm, 5.0 μm), 流动相V甲醇∶V乙腈∶V水(25.0 mmoL/L磷酸铵盐水溶液)=1∶3∶3, 流速0.7 mL/min; 第二维色谱柱采用Aston SCB色谱柱(4.6 mm×125.0 mm, 5.0 μm), 流动相V水(25.0 mmol/L磷酸铵盐水溶液)∶V水(1.0 mmol/L磷酸氢二铵溶液)∶V甲醇∶V乙腈=10∶35∶10∶45, 流速1.0 mL/min; 中间柱采用Aston SCB色谱柱(4.6 mm×10.0 mm, 3.5 μm), 辅助流动相为纯水。检测波长380 nm, 柱温40 ℃, 进样体积300 μL。
结果两性霉素B在0.059~12.31 μg/mL与峰面积线性关系良好(r=0.999 9), 最低定量限为0.04 μg/mL, 检测限为0.01 μg/mL, 方法回收率为98.79%~99.39%, 提取回收率为98.50%~99.00%, 日内精密度、日间精密度的相对标准偏差(RSD)均小于3.00%。
结论基于二维高效液相色谱法的两性霉素B血药浓度测定法具有灵敏度高、重现性好、自动化程度高、样品处理简单等特点,符合血清样品的检测要求,可应用于临床患者的两性霉素B血药浓度监测。
Abstract:ObjectiveTo establish a method to determine concentration of amphotericin B in blood based on two-dimensional high performance liquid chromatography method.
MethodsAston SX1 (3.5 mm×25.0 mm, 5.0 μm) was used as the first-dimensional chromatographic column, mobile phase Vmethanol∶Vacetonitrile∶Vwater (25.0 mmoL/L ammonium phosphate salt solution)=1∶3∶3, flow rate was 0.7 mL/min. The second-dimensional column was used Aston SCB (4.6 mm×125.0 mm, 5.0 μm), mobile phase Vwater (25.0 mmol/L ammonium phosphate solution)∶Vwater (1.0 mmol/L diammonium hydrogen phosphate solution)∶Vmethanol∶VAcetonitrile=10∶35∶10∶45, flow rate was 1.0 mL/min. Aston SCB (4.6 mm×10.0 mm, 3.5 μm) was used in the middle column, and the auxiliary mobile phase was pure water. The detection wave length was 380 nm, the column temperature was 40 ℃, and the injection volume was 300 μL.
ResultsAmphotericin B had a good linear relationship with peak area in the range of 0.059 to 12.31 μg/mL (r=0.999 9), the lowest limit of quantification was 0.04 μg/mL, the detection limit was 0.01 μg/mL, and the recovery rate was 98.79% to 99.39%. The extraction recovery rate was 98.50% to 99.00%, and relative standard deviation (RSD) of the intra-day and inter-day precision was less than 3.00%.
ConclusionThe plasma concentration of amphotericin B based on two-dimensional high performance liquid chromatography has the characteristics of high sensitivity, good reproducibility, high degree of automation and simple sample processing. It meets the requirements of serum sample detection and can be used for clinical monitoring of amphotericin B plasma concentration.
-
两性霉素B是一种多烯类抗真菌药物,具有抗菌作用较强、抗菌谱较广及药物相互作用较少的优势,是艾滋病合并真菌感染的一线用药,也是危及生命的侵袭性真菌感染和出现三唑类、棘白菌素类药物耐药的重症复杂基础疾病患者的重要选择[1-3]。然而,两性霉素B具有肾毒性、肝毒性和血液系统毒性等[4], 使得其临床应用受到限制。治疗药物监测(TDM)可为临床抗真菌治疗方案的优化提供科学依据,从而改善药物治疗效果,预防与药物相关的毒性反应,并减少抗真菌药物耐药情况的发生[5]。因此,应用两性霉素B治疗真菌感染患者时,开展TDM是非常必要的。目前,两性霉素B的血药浓度监测方法主要为高效液相色谱法(HPLC)、液相色谱串联质谱法[6-7], 其中质谱法具有较高的灵敏度,但成本高,推广难度大,而传统HPLC样品前处理操作复杂,色谱柱容易被血浆内源性物质堵塞,内标物不易购买,检测时间较长,且易出现干扰峰和保留时间漂移情况,不利于临床常规开展两性霉素B的TDM[8-9]。随着检测技术的发展,二维高效液相色谱法(2D-HPLC)已被广泛应用于复杂样本的分离,并被逐渐应用于血药浓度的监测中[10]。本研究基于2D-HPLC建立两性霉素B的血药浓度测定方法,以期为临床常规开展两性霉素B血药浓度监测提供简便、快速、准确的方法。
1. 材料与方法
1.1 主要仪器
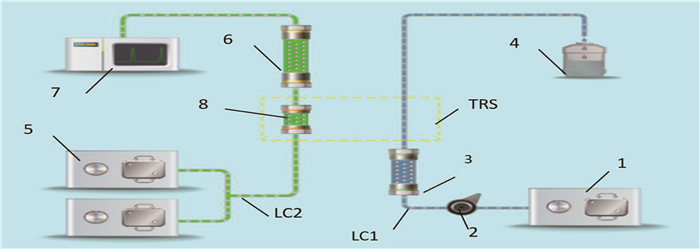
2D-HPLC系统由FLC2801全自动二维液相色谱耦合仪(湖南德米特仪器有限公司)和岛津LC-30A液相色谱部件构成。FLC2801全自动二维液相色谱耦合仪通过微流控系统将色谱泵、检测器、进样器等色谱部件耦合在一起,构成第一维液相色谱系统(LC1)与第二维液相色谱系统(LC2), 被分析物质通过FLC2801微流控系统从LC1转移至LC2, 完成待测样本的分析,工作站为LC Solution工作站,具体结构见图 1; HR-200电子分析天平(AND, 日本); MINI-15K高速离心机(奥盛,中国); XW-80A漩涡混合器(琪特,中国)。
1.2 药品与试剂
两性霉素B对照品(中国食品药品检定研究所,批号130628-201501); 甲醇、乙腈、异丙醇(色谱纯),磷酸、磷酸氢二铵、氨水、高氯酸、乙二醇(分析纯),水为双重蒸馏去离子水(纯水仪所制,不低于GB17323执行标准)。空白血浆和患者血浆均由云南省传染病医院临床科室提供。
1.3 方法
1.3.1 色谱条件
第一维色谱柱为Aston SX1色谱柱(3.5 mm×25.0 mm, 5.0 μm), 流动相V甲醇∶V乙腈∶V水(25 mmoL/L磷酸铵盐水溶液)=1∶3∶3, 流速0.7 mL/min; 第二维色谱柱为Aston SCB色谱柱(4.6 mm×125.0 mm, 5.0 μm), 流动相V水(25 mmol/L磷酸铵盐水溶液)∶V水(1.0 mmol/L磷酸氢二铵溶液)∶V甲醇∶V乙腈=10∶35∶10∶45, 流速1.0 mL/min; 中间柱为Aston SCB色谱柱(4.6 mm×10.0 mm, 3.5 μm), 辅助流动相为纯水。样本检测波长380 nm, 柱温40 ℃, 进样体积300 μL, 检测流程见表 1。
表 1 系统各工序的工作时间段与工作流程项目 工序1 工序2 工序3 工序4 工作时间段 第0~1.55分钟 第1.56~2.50分钟 第2.51~3.70分钟 第3.71~11.00分钟 系统工作流程 LC1色谱柱工作,进行样品初级分离 LC1与中间柱连通,样品中目标组分的捕获 LC2与中间柱连通,洗脱样品至LC2 样品中目标组分的分离检测 1.3.2 对照品溶液配制
精密称取两性霉素B对照品3.48 mg, 用水溶解并定容至25 mL, 配制成浓度为123.2 μg/mL的两性霉素B对照品溶液,置于-80 ℃冰箱保存备用。
1.3.3 血浆样品处理
将血浆样品以3 000转/min低速离心5 min, 精密吸取血浆样品400 μL至2 mL EP管中,加入乙腈去蛋白剂1 000 μL, 涡旋振荡1 min, 再以14 500转/min高速离心8 min, 然后取上层清液1 000 μL至进样瓶中待测,进样量为300 μL, 采用外标工作曲线法进行定量分析。
2. 结果
2.1 专属性考察
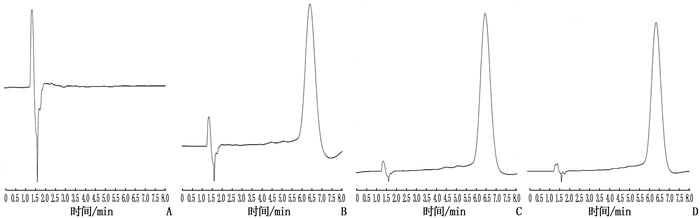
取人空白血浆、两性霉素B对照品加人空白血浆、患者血浆、两性霉素B对照品按“1.3.3 ”方法进行前处理后,按“1.3.1”色谱条件进行分析。色谱图结果显示,两性霉素B保留时间约为6.39 min, 人空白血浆色谱图在目标峰处未发现干扰,血浆内源性物质和及其他杂质已完全分离,不影响样本的含量测定,见图 2。
2.2 线性范围和定量限
取质量浓度为123.2 μg/mL的两性霉素B对照品溶液,分别用人空白血浆稀释成系列浓度(0.06、0.32、0.79、2.14、4.92、12.31 μg/mL), 按照“1.3.3 ”方法处理,并按照“1.3.1”色谱条件进行测定。以两性霉素B的峰面积(Y)对两性霉素B浓度(X)进行线性回归,结果显示,两性霉素B浓度为0.059~12.31 μg/mL时,与峰面积呈良好的线性关系,其回归方程为Y=683 050X+0(r=0.999 9)。两性霉素B的最低定量限为0.04 μg/mL[信噪比(S/N)>10, 相对标准偏差(RSD) < 5.00%], 检测限为0.01 μg/mL(S/N=3, RSD < 10.00%), 完全满足两性霉素B血药浓度临床检测要求,见表 2。
表 2 两性霉素B的最低定量限和检测限实验 浓度/(μg/mL) 峰面积/(mAU×min) 平均值 标准差 RSD/% 第1次 第2次 第3次 第4次 第5次 最低定量限(n=5) 0.04 33 236 31 438 33 038 31 449 31 239 32 080 971 3.03 检测限(n=5) 0.01 10 430 10 583 10 992 11 967 11 255 11 045 610 5.52 2.3 回收率和精密度
取两性霉素B标准溶液,用人空白血浆将其稀释成高、中、低浓度(0.40、2.00、8.00 μg/mL)的质控样品,进行方法学准确度和精密度检测。每个浓度梯度设置5个平行组,计算实际浓度,比较实际浓度与理论浓度后得出方法回收率和变异系数,检验准确度和日内精密度。连续3 d用同样的方法配制并检测质控样品,评估检测方法的日间精密度。结果显示,本研究建立的两性霉素B检测方法回收率为98.79%~99.39%(RSD < 3.00%), 提取回收率为98.50%~99.00%(RSD < 3.00%), 日内精密度、日间精密度RSD均 < 3.00%, 表明本法符合临床血药浓度监测的方法学要求,见表 3。
表 3 两性霉素B检测方法的回收率和精密度(x±s)理论浓度/(μg/mL) 方法回收率实验(n=5) 提取回收率实验(n=5) 日内精密度实验(n=5) 日间精密度实验(n=5) 回收率/% RSD/% 回收率/% RSD/% 测定值/(μg/mL) RSD/% 测定值/(μg/mL) RSD/% 0.40 98.79±0.01 2.82 98.50±0.01 2.89 0.39±0.01 2.10 0.40±0.01 2.50 2.00 99.26±1.32 1.61 99.00±0.02 1.18 1.98±0.02 1.21 2.00±0.05 2.43 8.00 99.39±0.81 1.06 98.92±0.15 2.09 7.96±0.06 0.90 8.22±0.10 1.21 2.4 转移稳定性试验
2D-HPLC系统将目标物从LC1转移至LC2的准确性和稳定性用转移回收率表示,将浓度为25 μg/mL的对照母液按照“1.3.1 ”色谱条件进行测定,进样体积为10 μL, 将得到的峰面积与LC2模式下单独通过分析柱所得峰面积进行比较,设置5个平行组,计算转移回收率为99.96%, RSD为0.33%, 说明2D-HPLC系统的转移回收率高且稳定。
2.5 稳定性试验
取高、中、低浓度的两性霉素B质控溶液各5份,不同处理(室温放置24 h, 按照“1.3.3 ”质控预处理后放置24 h, -80 ℃冷冻保存10 d, 反复冻融3次取出复温)后,按“1.3.1”色谱条件进行测定。结果显示,两性霉素B的RSD均 < 4.00%, 准确度为97.50%~103.50%, 表明室温放置24 h、预处理后室温放置24 h、冷冻10 d和反复冻融3次对两性霉素B的测定结果均无影响,满足临床血药浓度监测要求,见表 4、表 5。
表 4 室温放置24 h和预处理后室温放置24 h的稳定性试验结果(n=5)(x±s)理论浓度/(μg/mL) 质控预处理后室温放置24 h 质控样品室温放置24 h 实测浓度/(μg/mL) RSD/% 准确度/% 实测浓度/(μg/mL) RSD/% 准确度/% 0.40 0.39±0.04 3.31 97.50 0.39±0.01 1.14 97.50 2.00 1.98±0.07 2.06 99.00 1.98±0.03 1.27 99.00 8.00 7.86±0.11 1.23 98.25 7.85±0.17 2.08 98.13 表 5 反复冻融3次和-80 ℃保存10 d的稳定性试验结果(n=5)(x±s)理论浓度/(μg/mL) 质控样品反复冻融3次 质控样品-80 ℃保存10 d 实测浓度/(μg/mL) RSD/% 准确度/% 实测浓度/(μg/mL) RSD/% 准确度/% 0.40 0.41±0.02 2.68 102.50 0.40±0.02 2.82 100.00 2.00 2.07±0.06 2.34 103.50 1.97±0.02 0.83 98.50 8.00 7.97±0.14 1.56 99.63 7.80±0.09 0.92 97.50 2.6 临床样本检测
选取云南省传染病医院接受注射用两性霉素B治疗的真菌感染患者共计25例,给予维持剂量(15~30 mg/d)的两性霉素B治疗5 d后,于下次给药前半小时采集患者静脉血,按“1.3.3 ”方法处理样本,并按“1.3.1”色谱条件进行分析。结果显示,两性霉素B静脉维持剂量为15~30 mg/d时,患者血浆谷浓度范围为0.15~1.03 μg/mL, 见表 6。
表 6 25例真菌感染患者两性霉素B血药浓度监测结果样本编号 性别 年龄 检测日期 浓度/(μg/mL) 1 男 47 2020-04-20 0.55 2 男 38 2020-04-27 0.43 3 女 40 2020-05-01 0.39 4 男 23 2020-05-01 0.36 5 男 47 2020-05-18 0.98 6 男 38 2020-05-18 0.68 7 男 23 2020-05-23 0.15 8 女 19 2020-05-25 0.43 9 男 45 2020-05-25 0.15 10 男 18 2020-05-27 0.64 11 男 12 2020-05-28 0.70 12 男 28 2020-06-02 0.31 13 男 47 2020-06-03 0.54 14 男 43 2020-06-16 0.15 15 男 30 2020-06-23 0.29 16 男 18 2020-07-11 0.41 17 女 41 2020-07-17 0.56 18 男 57 2020-07-19 0.45 19 男 14 2020-07-20 0.41 20 男 17 2020-07-20 0.48 21 女 37 2020-07-24 1.03 22 男 40 2020-07-28 0.39 23 男 57 2020-08-02 0.58 24 男 67 2020-08-20 0.69 25 女 22 2020-08-21 0.81 3. 讨论
相关研究[7, 11]显示,两性霉素B在某些剂量下存在明显的变异性,具有不可预测的非线性药代动力学特点,因此有必要开展TDM。目前,两性霉素B的TDM多在特殊人群中开展,如免疫缺陷患者、重症感染患者、肾功能不全患者和儿童患者等[6-7], 同时也适用于对治疗剂量(已知病原体对抗菌药物的敏感性)反应不佳的患者[5]。对于选用两性霉素B治疗真菌感染的患者而言,开展TDM是非常必要的,可指导个性化给药,改善治疗效果。
2D-HPLC检测系统具有在线净化除杂功能,二维色谱柱可自动化完成样本的富集和净化,避免传统HPLC测定中因仪器灵敏度和色谱柱分离度的限制而需进行繁杂前处理辅助样本富集的操作,可提高样本检测的准确性和报告的及时性[12-14]。本研究建立的2D-HPLC两性霉素B测定方法是将分离机理不同且互相独立的两支色谱柱以串联方式组合,并以自动化的中间柱作为两支色谱柱的转移接口。与传统HPLC相比, 2D-HPLC能显著减少复杂样本基质效应和残留现象,大大提高样本分离效率,节省检测时间及监测成本等。本研究2D-HPLC系统的检测器为高灵敏度二极管阵列检测器,光程长达85 mm, 可得到任意波长的色谱图,与HPLC的单通道检测波长相比,本方法可通过双通道波长测定浓度的比值来判断干扰情况。
由于抗真菌药物种类有限和真菌耐药性的发展,目前,真菌感染仍是严重威胁公共健康的疾病之一[15]。两性霉素B是抗真菌治疗指南推荐的一线治疗药物[16], 开展TDM可优化两性霉素B治疗真菌感染的管理措施[17], 实现个体化给药,在最大程度提高抗真菌效力与最小化药物相关毒性方面达到平衡,从而提高临床治疗效果和药学服务质量。本研究建立的2D-HPLC两性霉素B血药浓度测定法具有灵敏度高、重现性好、自动化程度高、样品处理简单等特点,适用于临床患者的两性霉素B血药浓度检测,也为实验室开展相关的药物代谢动力学研究提供了一种稳定而可靠的方法。
-
表 1 系统各工序的工作时间段与工作流程
项目 工序1 工序2 工序3 工序4 工作时间段 第0~1.55分钟 第1.56~2.50分钟 第2.51~3.70分钟 第3.71~11.00分钟 系统工作流程 LC1色谱柱工作,进行样品初级分离 LC1与中间柱连通,样品中目标组分的捕获 LC2与中间柱连通,洗脱样品至LC2 样品中目标组分的分离检测 表 2 两性霉素B的最低定量限和检测限
实验 浓度/(μg/mL) 峰面积/(mAU×min) 平均值 标准差 RSD/% 第1次 第2次 第3次 第4次 第5次 最低定量限(n=5) 0.04 33 236 31 438 33 038 31 449 31 239 32 080 971 3.03 检测限(n=5) 0.01 10 430 10 583 10 992 11 967 11 255 11 045 610 5.52 表 3 两性霉素B检测方法的回收率和精密度(x±s)
理论浓度/(μg/mL) 方法回收率实验(n=5) 提取回收率实验(n=5) 日内精密度实验(n=5) 日间精密度实验(n=5) 回收率/% RSD/% 回收率/% RSD/% 测定值/(μg/mL) RSD/% 测定值/(μg/mL) RSD/% 0.40 98.79±0.01 2.82 98.50±0.01 2.89 0.39±0.01 2.10 0.40±0.01 2.50 2.00 99.26±1.32 1.61 99.00±0.02 1.18 1.98±0.02 1.21 2.00±0.05 2.43 8.00 99.39±0.81 1.06 98.92±0.15 2.09 7.96±0.06 0.90 8.22±0.10 1.21 表 4 室温放置24 h和预处理后室温放置24 h的稳定性试验结果(n=5)(x±s)
理论浓度/(μg/mL) 质控预处理后室温放置24 h 质控样品室温放置24 h 实测浓度/(μg/mL) RSD/% 准确度/% 实测浓度/(μg/mL) RSD/% 准确度/% 0.40 0.39±0.04 3.31 97.50 0.39±0.01 1.14 97.50 2.00 1.98±0.07 2.06 99.00 1.98±0.03 1.27 99.00 8.00 7.86±0.11 1.23 98.25 7.85±0.17 2.08 98.13 表 5 反复冻融3次和-80 ℃保存10 d的稳定性试验结果(n=5)(x±s)
理论浓度/(μg/mL) 质控样品反复冻融3次 质控样品-80 ℃保存10 d 实测浓度/(μg/mL) RSD/% 准确度/% 实测浓度/(μg/mL) RSD/% 准确度/% 0.40 0.41±0.02 2.68 102.50 0.40±0.02 2.82 100.00 2.00 2.07±0.06 2.34 103.50 1.97±0.02 0.83 98.50 8.00 7.97±0.14 1.56 99.63 7.80±0.09 0.92 97.50 表 6 25例真菌感染患者两性霉素B血药浓度监测结果
样本编号 性别 年龄 检测日期 浓度/(μg/mL) 1 男 47 2020-04-20 0.55 2 男 38 2020-04-27 0.43 3 女 40 2020-05-01 0.39 4 男 23 2020-05-01 0.36 5 男 47 2020-05-18 0.98 6 男 38 2020-05-18 0.68 7 男 23 2020-05-23 0.15 8 女 19 2020-05-25 0.43 9 男 45 2020-05-25 0.15 10 男 18 2020-05-27 0.64 11 男 12 2020-05-28 0.70 12 男 28 2020-06-02 0.31 13 男 47 2020-06-03 0.54 14 男 43 2020-06-16 0.15 15 男 30 2020-06-23 0.29 16 男 18 2020-07-11 0.41 17 女 41 2020-07-17 0.56 18 男 57 2020-07-19 0.45 19 男 14 2020-07-20 0.41 20 男 17 2020-07-20 0.48 21 女 37 2020-07-24 1.03 22 男 40 2020-07-28 0.39 23 男 57 2020-08-02 0.58 24 男 67 2020-08-20 0.69 25 女 22 2020-08-21 0.81 -
[1] SAID R, ARAFAT B, ARAFAT T. High performance liquid chromatography - Mass spectrometric bioanalytical method for the determination of dapoxetine in human plasma: application for bioequivalence study[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2020, 1149: 122154. doi: 10.1016/j.jchromb.2020.122154
[2] 中国医药教育协会感染疾病专业委员会. 抗菌药物药代动力学/药效学理论临床应用专家共识[J]. 中华结核和呼吸杂志, 2018, 41(6): 409-446. doi: 10.3760/cma.j.issn.1001-0939.2018.06.004 [3] GROLL A H, RIJNDERS B J A, WALSH T J, et al. Clinical pharmacokinetics, pharmacodynamics, safety and efficacy of liposomal amphotericin B[J]. Clin Infect Dis, 2019, 68(Suppl 4): S260-S274.
[4] LIU Y, HAN F L, LIU Y J, et al. Determination of biogenic amines in wine using modified liquid-liquid extraction with high performance liquid chromatography-fluorescence detector[J]. Food Anal Methods, 2020, 13(4): 911-922. doi: 10.1007/s12161-020-01710-w
[5] ASHBEE H R, BARNES R A, JOHNSON E M, et al. Therapeutic drug monitoring (TDM) of antifungal agents: guidelines from the British Society for Medical Mycology[J]. J Antimicrob Chemother, 2014, 69(5): 1162-1176. doi: 10.1093/jac/dkt508
[6] BARCO S, ZUNINO A, D'AVOLIO A, et al. A rapid and robust UHPLC-DAD method for the quantification of amphotericin B in human plasma[J]. J Pharm Biomed Anal, 2017, 138: 142-145. doi: 10.1016/j.jpba.2017.01.048
[7] LESTNER J M, GROLL A H, ALJAYYOUSSI G, et al. Population pharmacokinetics of liposomal amphotericin B in immunocompromised children[J]. Antimicrob Agents Chemother, 2016, 60(12): 7340-7346. doi: 10.1128/AAC.01427-16
[8] 叶珍洁, 胡盈莹. 高效液相色谱法测定人血浆中两性霉素B的浓度[J]. 中国医院用药评价与分析, 2018, 18(9): 1185-1187. https://www.cnki.com.cn/Article/CJFDTOTAL-YYPF201809008.htm [9] 孟现民, 张莉, 刘荣, 等. 高效液相色谱法测定人血浆和脑脊液中的两性霉素B[J]. 中国医院药学杂志, 2009, 29(19): 1617-1619. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGYZ200919008.htm [10] 张寒娟, 陈永妍, 王高彪, 等. 新型二维液相色谱快速测定丙戊酸血药浓度的研究[J]. 中国医院药学杂志, 2018, 38(13): 1394-1398. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGYZ201813012.htm [11] BEKERSKY I, FIELDING R M, DRESSLER D E, et al. Pharmacokinetics, excretion, and mass balance of liposomal amphotericin B (AmBisome) and amphotericin B deoxycholate in humans[J]. Antimicrob Agents Chemother, 2002, 46(3): 828-833. doi: 10.1128/AAC.46.3.828-833.2002
[12] 王峰, 朱运贵, 罗雪梅, 等. 新型二维液相色谱测定百草枯尿液浓度的研究[J]. 中国药学杂志, 2017, 52(10): 871-879. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGYX201710012.htm [13] 刘朝霞, 周亚楠, 何兰, 等. 二维液相色谱技术在药物分析中的应用[J]. 中国药学杂志, 2019, 54(12): 941-946. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGYX201912001.htm [14] 刘宇, 李林, 王锋. 新型二维液相色谱法测定人血浆中阿立哌唑的浓度[J]. 中国药物滥用防治杂志, 2018, 24(3): 150-153. https://www.cnki.com.cn/Article/CJFDTOTAL-ZYLF201803007.htm [15] CAO L D, ZHANG H, ZHANG H J, et al. Determination of propionylbrassinolide and its impurities by high-performance liquid chromatography with evaporative light scattering detection[J]. Molecules, 2018, 23(3): E531. doi: 10.3390/molecules23030531
[16] 王敏, 柳航, 金路, 等. 酶放大免疫分析法与二维高效液相色谱法监测万古霉素血药浓度的比较[J]. 药学与临床研究, 2018, 26(1): 26-29. https://www.cnki.com.cn/Article/CJFDTOTAL-YXLY201801008.htm [17] WANG X C, MOHAMMAD I S, FAN L F, et al. Delivery strategies of amphotericin B for invasive fungal infections[J]. Acta Pharm Sin B, 2021, 11(8): 2585-2604. doi: 10.1016/j.apsb.2021.04.010
-
期刊类型引用(5)
1. 陈丽云. 高效液相色谱串联质谱法检测精神病患者血清中的多种抗精神病类药物及代谢物的浓度. 北方药学. 2024(07): 4-8 .  百度学术
百度学术
2. 徐佳雯,高青,张斐,张雯,王逸. 高效液相色谱法测定地西泮直肠凝胶有关物质. 实用临床医药杂志. 2024(17): 92-98 .  本站查看
本站查看
3. 王本军,张寒娟,韩文超. 二维液相色谱法测定两性霉素B的血药浓度方法研究. 医药论坛杂志. 2024(20): 2213-2217 .  百度学术
百度学术
4. 陈明,刘真,黄晓舞. 液质联用方法测定抗真菌药物伏立康唑、泊沙康唑及两性霉素B的药物浓度. 武警医学. 2024(12): 1039-1045 .  百度学术
百度学术
5. 纪梅芳,卢桂清. 直接蛋白沉淀-超高效液相色谱法测定氟尿嘧啶血药浓度. 北方药学. 2023(08): 9-11+14 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号