Relationships of expression of uncoupling protein-2 with clinicopathological features and prognosis in patients with colorectal cancer
-
摘要:目的
探讨解偶联蛋白2(UCP2)在结直肠癌组织中的表达及其与临床病理特征和预后的关系, 明确患者预后的影响因素。
方法选取2018年1月—2020年1月160例采用根治性切除术治疗的结直肠癌患者为研究对象。取切除的癌组织及其癌旁组织,采用免疫组织化学法(SP)检测UCP2表达水平,比较癌组织、癌旁组织中UCP2表达的差异; 随访1年,比较UCP2不同表达的结直肠癌患者的总生存率和无病生存率; 采用单因素分析探讨UCP2蛋白的表达与患者预后的关系; 采用多因素Logistic回归分析模型分析结直肠癌患者预后的影响因素。
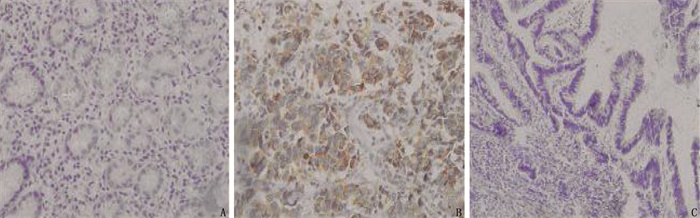
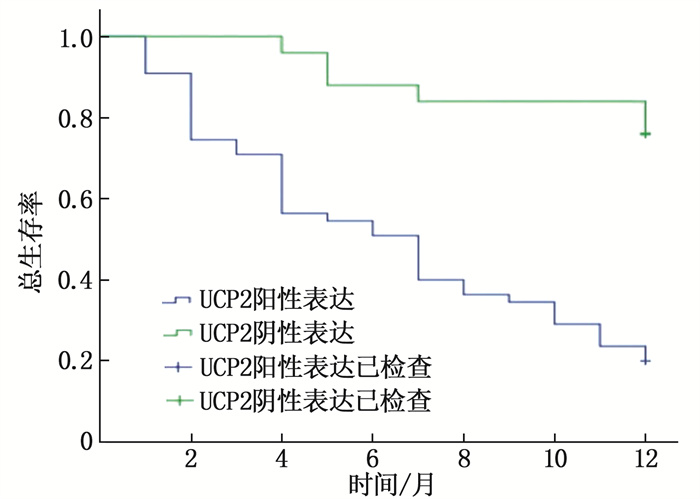
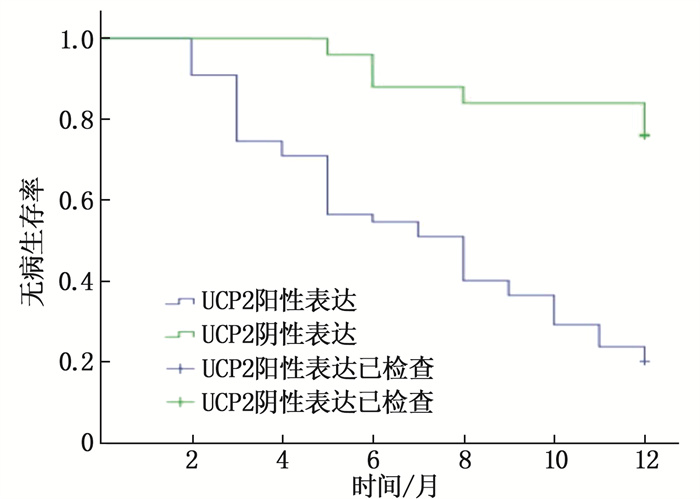
结果癌组织中的UCP2表达水平高于癌旁组织,差异有统计学意义(P < 0.01);TNM Ⅲ期、有淋巴结转移、低分化患者癌组织的UCP2阳性表达水平高于其他患者,差异有统计学意义(P < 0.01);UCP2阳性表达患者的1年总生存率、无病生存率低于阴性表达患者,差异有统计学意义(P < 0.05);单因素分析结果显示,不同肿瘤分化程度、TNM分期、淋巴结转移、UCP2表达的结直肠癌患者1年生存率比较,差异有统计学意义(P < 0.05);结直肠癌患者预后结局的独立危险因素包括肿瘤分化(低分化)、TNM分期(Ⅲ期)、UCP2阳性表达、淋巴结转移(P < 0.05)。
结论结直肠癌患者的UCP2高表达与患者的临床病理特征、预后均存在密切关系, UCP2的高表达提示结直肠癌患者的预后不佳。
Abstract:ObjectiveTo explore the expression of uncoupling protein-2 (UCP2) in colorectal cancer tissues and its relationships with clinicopathological features and prognosis, and to clarify the influencing factors of prognosis of patients.
MethodsA total of 160 patients with colorectal cancer who underwent radical resection from January 2018 to January 2020 were selected as study subjects. UCP2 expression levels were measured by immunohistochemistry (SP) in the excised and adjacent tissues, and the difference of UCP2 expression between the cancerous tissues and adjacent tissues was compared. The overall survival rate and disease-free survival rate of colorectal cancer patients with different UCP2 expressions were compared at 1-year follow-up. Univariate analysis was used to investigate the relationship between UCP2 protein expression and prognosis of patients. Multivariate Logistic regression model was used to analyze the influencing factors for prognosis of patients with colorectal cancer.
ResultsUCP2 expression level in cancer tissues was higher than that in adjacent tissues (P < 0.01); the UCP2 positive expression levels in cancer tissues of TNM stage Ⅲ, lymph node metastasis and poorly differentiated patients were higher than those of other patients (P < 0.01); the 1-year overall survival rate and disease-free survival rate of UCP2 positive expression patients were lower than those of negative expression patients (P < 0.05); univariate analysis showed that 1-year survival rates of colorectal cancer patients with different degrees of tumordifferentiation, TNM staging, lymph node metastasis and UCP2 expressions showed statistically significant differences(P < 0.05); the independent risk factors for patients with colorectal cancer included tumor differentiation (low differentiation), TNM staging (stage Ⅲ), UCP2 positive expression, lymph node metastasis (P < 0.05).
ConclusionHigh UCP2 expression of colorectal cancer patients is closely related to the clinicopathological characteristics and prognosis, and it also proves that the patients with colorectal cancer have poor prognosis.
-
甘露糖是一种蛋白质糖基化单糖,分子式为C6H12O6。然而,甘露糖是一种较低效的细胞能量来源,主要参与糖蛋白合成和免疫调节。在糖类代谢过程中,甘露糖可在己糖激酶(HK)作用下磷酸化为甘露糖-6-磷酸(M-6-P)。甘露糖与葡萄糖具有相同的转运体,并可在体内与葡萄糖进行相互转换[1]。甘露糖受体(MR)存在于许多细胞中,包括巨噬细胞和树突状细胞。MR可诱导这些细胞摄取和递呈抗原[2]。近年来,随着对甘露糖体内糖代谢途径和生物学效应研究的不断深入,发现甘露糖途径疗法对各类疾病均有显著疗效。本研究对近年来甘露糖在肿瘤、抗菌、肥胖、免疫调节等方面的研究进展及重大发现进行综述,分析甘露糖靶向治疗面临的机遇与挑战,以期为临床治疗提供新的思路与契机。
1. 甘露糖的抗肿瘤作用
1.1 肿瘤代谢特点
肿瘤细胞糖代谢方式与正常细胞有很大不同,即使在氧气充足的条件下,肿瘤细胞糖酵解的比率依然远高于正常细胞,糖代谢的异常可视为肿瘤发生的始动因素。正常细胞中90%的能量通过线粒体氧化磷酸化供给,而肿瘤细胞中约50%的三磷酸腺苷(ATP)由糖酵解途径提供,这种氧供充足状态下的糖酵解过程被称为有氧糖酵解[3]。然而,产生这种现象的原因尚不明确,主流观点认为一些糖酵解酶的活性或亚型的突变是肿瘤能量代谢异常的关键因素[4]。
由于肿瘤具有高糖吸收、高乳酸生成、有氧糖酵解等特点[5], 以糖代谢为治疗靶点成为肿瘤治疗的热点。很多研究[6-8]设计癌细胞葡萄糖转运蛋白1(GLUT1)特异性小分子阻断剂,以减少其摄入葡萄糖的量,从而抑制肿瘤生长。GONZALEZ P S等[9]研究发现甘露糖可干扰葡萄糖代谢,减少肿瘤细胞摄取葡萄糖的量,抑制肿瘤细胞的生长,并可显著提高化疗敏感性。该研究用5种高浓度的己糖(葡萄糖、甘露糖、岩藻糖、半乳糖、果糖)分别培养肿瘤细胞,结果发现25 mmol/L的甘露糖能显著抑制肿瘤细胞的生长。在肿瘤小鼠的饮水中加入质量分数为20%的甘露糖,并每周用200 μL质量分数为20%的甘露糖水溶液给小鼠灌胃3次,结果发现其体内肿瘤的生长和细胞的增殖均呈显著的抑制状态。甘露糖与顺铂或阿霉素联用时,能大幅增强化疗效果,延长小鼠生存期。因此,甘露糖疗法是一种简单、安全的抗癌新路径。
1.2 作用机制
1.2.1 干扰葡萄糖代谢
甘露糖是葡萄糖C-2位的同分异构体,均由相同的葡萄糖转运蛋白运输进细胞,因此有研究[9]提出甘露糖可能抑制葡萄糖摄取,但液相色谱-质谱和同位素标记结果显示,葡萄糖摄入水平并未下降,而乳酸水平则显著降低。研究[10]发现甘露糖被己糖激酶磷酸化为M-6-P, 甘露糖诱导的M-6-P较葡萄糖诱导的葡萄糖-6-磷酸(G-6-P)更多,而M-6-P、G-6-P、果糖-6-磷酸(F-6-P)等统称为磷酸己糖,作为一个整体参与代谢,任意一种磷酸己糖的增加势必会影响其他磷酸己糖的代谢。M-6-P的大量堆积抑制了葡萄糖代谢相关的酶如己糖激酶、磷酸葡萄糖异构酶(PGI)和葡萄糖-6-磷酸脱氢酶(G-6-PD), 从而影响糖酵解途径、三羧酸循环、戊糖磷酸途径和多糖合成。DALLE VEDOVE E等[11]设计出了甘露糖和甘露糖-6-磷酸靶向给药系统,具有高内吞效率和低突变倾向,可在常规化学疗法或基因疗法基础上直接治疗癌细胞。
1.2.2 增强化疗疗效
WOJTKOWIAK J W等[12]发现甘露糖具有显著降低乳酸生成水平、增高肿瘤细胞外pH值、减弱药物抵抗、增强化疗疗效的作用。更重要的是,甘露糖与化疗药物联用后,能增加多聚二磷酸腺苷核糖聚合酶(PARP)的水平,而PARP是半胱天冬酶-3的重要底物,会引发细胞凋亡[13]。目前,有研究[14]利用这一特点,将甲氨蝶呤(MTX)和甘露糖(MAN)共轭,合成一个分子的MTX-MAN共轭物,该分子可以直接与化疗药物偶联成无刺激反应的无载体纳米颗粒(MTX-MAN NPs), 成为肿瘤化疗的新型替代疗法。MR可诱导巨噬细胞和树突状细胞摄取和递呈抗原。研究[15]分析了胃癌患者MR表达与临床病理特征的关系,发现MR的高表达与胃癌大小、TMN分期及国际癌症控制联合(UICC)分期密切相关(P < 0.05), 高表达提示癌症患者预后不良。有多项研究[16-18]利用MR开发出了靶向给药系统,在纳米药物上进行甘露糖修饰,从而靶向激活巨噬细胞或树突状细胞免疫应答,可克服癌症治疗中对肿瘤细胞缺乏选择性和对健康组织的细胞毒性等问题,并实现对特定细胞群的靶向输送,以增强传统药物的药代动力学和药效学特征。
1.3 临床应用前景
目前研究发现,甘露糖对胰腺癌[19]、皮肤癌、肺癌[20]、结直肠癌[21]、胃癌等癌症治疗有效,但对甘露糖抗肿瘤的研究也仅停留在动物实验阶段,临床试验前仍需要在实验室中开展更多的研究,包括在其他癌症类型的小鼠中分析甘露糖的作用。对于患者而言,用甘露糖直接治疗肿瘤的可能性不大,更多的可能是将甘露糖作为现有疗法的补充,而甘露糖的有效剂量尚待进一步阐明。
2. 甘露糖的抗菌作用
2.1 应用范围
目前主要的研究方向是甘露糖预防尿路感染(UTIs)。大多数尿路感染是由尿路致病性大肠杆菌(UPEC)引起的, UPEC在尿路上皮细胞定植,导致UTIs[22]。即便UTIs的抗生素治疗效果肯定,但仍有30%~50%的患者出现复发性尿路感染。
2.2 作用机制
SPAULDING C N等[23]发现UPEC通过Ⅰ型菌毛黏附素FimH蛋白与膀胱上皮细胞表面甘露糖结合而不易被尿液冲走,他们改良甘露糖得到甘露糖苷(M4284), 其与FimH蛋白的亲和力比甘露糖高10万倍,但又不会附着于膀胱表面,可随尿液将大肠杆菌排出体外。RUSSO E等[24]将40例绝经后妇女随机平均分配到试验组和对照组,试验组阴道前壁缝合术后每日服用2次含有蔓越莓、D-甘露糖和抗炎因子的补品,持续2周,而对照组仅接受手术治疗。结果发现,口服补品改善了绝经后妇女阴道前壁缝合术后UTIs。MILANDRI R等[25]评价了甘露糖、木槿、植物乳杆菌对尿动力学检查后尿路感染的治疗作用,该研究给予100例尿路感染的成年妇女D-甘露糖、木槿花和植物乳杆菌治疗,治疗14 d后,只有13%的患者尿培养仍然能观察到尿路感染。GENOVESE C等[26]将72例患有单纯性膀胱炎的成年女性分为3组,接受了D-甘露糖联合3种植物提取物的组合治疗。12周后,通过尿液样品的微生物学评估与基线测量值比较,发现联合治疗组患者在治疗和随访期间复发性膀胱炎发生率较低。上述研究表明甘露糖联合其他药物可有效治疗尿路感染,能在清除致病菌的同时保持其他微生物群落的完整性。
2.3 临床应用前景
研究人员将甘露糖苷称为“分子手术刀”,其能够特异性地清除靶细菌,同时保持正常菌群的完好,与抗生素治疗后观察到的很多细菌物种丰度发生大规模变化形成鲜明的对比。鉴于甘露糖苷不是抗生素,其可以用于治疗抗生素耐药性菌株导致的UTIs。同时,根据其作用机制,甘露糖苷可治疗含有相同菌毛的不同种细菌菌株感染。目前,冯峰[27]研制出甘露糖类似物抗生素,以期用于临床治疗尿路感染。然而,小鼠和人类的尿路结构和生活方式存在差异,通过减少尿道中致病菌数量来降低尿路感染发生率这一想法是否可行仍需进一步的人体研究来验证。
3. 甘露糖与肥胖改善
3.1 作用机制
甘露糖是哺乳动物蛋白质糖基化的重要单糖,但其实是一种低效的细胞能量来源。SHARMA V等[28]通过C57BL6/J小鼠的饮食诱导应激模型证明了高脂饮食喂养的小鼠经补充甘露糖可防止体质量增加,减轻肥胖及肝脏脂肪变性,增加耐力和最大耗氧量,并改善葡萄糖耐量。补充甘露糖的小鼠粪便能量较高,表明宿主对热量的吸收减少,更倾向于将能量排泄。此外,甘露糖可增加肠道菌群中拟杆菌与硬壁菌的比率,这是与瘦型表型相关的特征。其他研究[29-31]也发现了肥胖小鼠或人类肠道中拟杆菌与硬壁菌比率存在类似的变化。YAN S K等[32]对3个月大的ICR雄性小鼠饲喂高脂和高果糖饮食8周,而后饮食诱导的肥胖小鼠口服甘露寡糖(MOS) 100、200 mg/(kg·d)4周。结果显示,MOS可显著减轻肥胖小鼠的体质量增加、胰岛素抵抗、脂肪肝和炎症反应。MOS还能刺激脂肪分解并抑制脂肪组织中的脂肪形成[33]。此外, MOS可通过增强双歧杆菌和乳杆菌的丰度来重组肠道微生物组[6]。
3.2 临床应用前景
甘露糖能防止体质量增加,改善肥胖,减轻肝脏脂肪变性,增加耐力和最大耗氧量,并改善葡萄糖耐量,是体质量管理和肠道健康改善的潜在营养保健品。肠道微生物参与甘露糖改善肥胖的过程,其在新陈代谢中起着重要的作用,但具体作用机制仍待进一步探讨。
4. 甘露糖与糖尿病治疗
4.1 应用范围
1型糖尿病(T1DM)是一种慢性器官特异性自身免疫疾病,通常认为T1DM是由多种原因导致胰岛β细胞破坏[34], 自身胰岛素分泌绝对缺乏,属于胰岛素依赖性糖尿病。ZHANG D F等[35]建立了调节性T细胞(Treg)缺陷的T1DM小鼠模型,在饮用水中加入甘露糖,发现小鼠血糖可控制在正常水平。研究[36-37]发现甘露糖能够通过调节肠道菌群、增强二甲双胍的降血糖作用来治疗2型糖尿病(T2DM)。
4.2 作用机制
ZHANG D F等[35]建立了Treg缺陷的T1DM小鼠模型,即青少年型糖尿病小鼠模型,这种小鼠自身不能产生足够的胰岛素,到一定年龄后就会因血糖过高而罹患T1DM; 当小鼠发育至7.5周龄时,在饮用水中添加质量分数为20%的甘露糖,此时小鼠血糖水平正常; 不补充甘露糖的对照组小鼠在23周后有80%~90%发展为糖尿病鼠,而实验组只有不到10%的小鼠罹患糖尿病。结果显示,实验组应用甘露糖激活了Treg细胞,抑制了小鼠体内胰岛炎症,但增加了胰岛细胞的数量。甘露糖诱导T细胞分化为Treg细胞,从而减少对免疫细胞的损害,为自身免疫性疾病的治疗提供了新的途径。马姝月[38]将非肥胖型糖尿病(NOD)小鼠分为2组,对照组正常饮水,实验组饮甘露糖溶液,结果发现实验组NOD小鼠胰腺组织胰岛淋巴细胞浸润明显减少,胰岛炎症明显减轻。史湘铃等[39]发现甘露糖可通过改善GLUT4 mRNA表达水平增加外周细胞对葡萄糖的摄取。
肥胖和高脂饮食诱发的T2DM与肠道菌群失调明显相关。由于二甲双胍的一线临床应用具有许多缺陷,因此ZHENG J L等[40]构思并实施了二甲双胍与MOS的组合使用,结果发现二甲双胍联合MOS通过降低理研菌科和梭状芽胞杆菌的相对丰度改变肠道菌群的组成和结构。MOS通过调节肠道菌群增强二甲双胍的降血糖作用。
4.3 临床应用前景
目前的研究揭示了甘露糖对T细胞的调节机制,为今后利用高剂量甘露糖治疗人类糖尿病等自身免疫性疾病提供了理论和动物试验依据。但此项研究仅处于动物试验阶段,对人体是否有相同的效果仍需临床验证。
5. 展望
甘露糖在生物体内起着重要的生理作用,通过不同手段对甘露糖代谢进行调节和干预,可以达到对相应疾病的干预和治疗的目的,例如抑制肿瘤细胞的增殖、提高癌细胞对化疗的敏感性、作为特异性靶点接受药物、治疗大肠杆菌引起的尿路感染、用于肥胖症治疗以及作为免疫调节剂治疗T1DM。此外,甘露糖还能作为辅助药物增强二甲双胍的降血糖作用,从而更高效地治疗T2DM。但是,目前甘露糖的研究还停留在实验阶段,在医学中的应用也存在诸多问题,如在甘露糖与化疗联合治疗癌症中的有效剂量尚不清楚; 甘露糖治疗尿路感染的副作用仍不明确; 该治疗方案的生物安全性有待进一步研究。相信随着对甘露糖作用机制的进一步深入研究及人体实验的开展,其在未来各类疾病的临床治疗中可以发挥更积极的作用。
-
表 1 UCP2蛋白的表达与结直肠癌临床病理特征的关系[n(%)]
临床病理特征 分类 阴性(n=54) 阳性(n=106) χ2 P 性别 男 40(74.07) 74(69.81) 0.32 0.57 女 14(25.93) 32(30.19) 年龄 < 60岁 28(51.85) 46(43.40) 1.03 0.31 ≥60岁 26(48.15) 60(56.60) 肿瘤直径 < 5 cm 28(51.85) 48(45.28) 0.62 0.43 ≥5 cm 26(48.15) 58(54.72) 肿瘤分化 高分化 26(48.15) 24(22.64) 10.83 < 0.01 低分化 28(51.85) 82(77.36) TNM分期 Ⅰ期 8(14.81) 5(4.72) — < 0.01 Ⅱ期 24(44.44) 23(21.70) Ⅲ期 22(40.74) 78(73.58) 淋巴结转移 是 10(18.52) 66(62.26) 10.83 < 0.01 否 44(81.48) 40(37.74) 表 2 影响结直肠癌患者预后的单因素分析
临床病理特征 分类 n 1年生存情况 χ2 P 性别 男 114 50(43.86) 2.11 0.15 女 46 26(56.52) 年龄 < 60岁 74 38(51.35) 0.82 0.37 ≥60岁 86 38(44.19) 肿瘤直径 < 5 cm 76 42(55.26) 3.50 0.06 ≥5 cm 84 34(40.48) 肿瘤分化程度 高分化 50 31(62.00) 6.13 0.01 低分化 110 45(40.91) TNM分期 Ⅰ期 13 11(84.62) 40.80 < 0.01 Ⅱ期 47 37(78.72) Ⅲ期 100 28(28.00) 淋巴结转移 是 76 16(21.05) 7.01 0.01 否 84 60(71.43) UCP2表达 阴性 54 36(66.67) 8.12 < 0.01 阳性 106 40(37.74) 表 4 结直肠癌患者预后临床因素的多因素Logistic回归分析
变量 B SE Wald χ2 OR 95%CI P 肿瘤分化(低分化) 0.88 0.12 3.57 1.426 1.13~3.05 0.03 TNM分期(Ⅲ期) 0.70 0.13 5.05 2.023 1.48~5.13 < 0.01 UCP2表达(阳性) 0.43 0.08 4.10 1.360 1.15~2.10 0.03 淋巴结转移(是) 1.39 0.10 3.10 1.445 1.06~2.12 0.03 -
[1] 王福海, 张广超. SIRT1通过NF-κB通路调节结直肠癌细胞HCT116增殖和活力[J]. 解剖学研究, 2019, 41(1): 20-24. https://www.cnki.com.cn/Article/CJFDTOTAL-GDJP201901007.htm [2] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7-30. doi: 10.3322/caac.21442
[3] 陈宇, 袁丽. 卡培他滨增强结直肠癌对奥沙利铂的敏感性研究[J]. 解剖学研究, 2022, 44(1): 39-44. https://www.cnki.com.cn/Article/CJFDTOTAL-GDJP202201008.htm [4] 王功成, 李雪琴, 茆飞, 等. 肾周脂肪解偶联蛋白1表达对肾透明细胞癌患者预后的影响[J]. 中华内分泌外科杂志, 2020, 14(3): 213-217. doi: 10.3760/cma.j.issn.115807-20200305-00063 [5] WANG A, LIU L, YUAN M, et al. Role and mechanism of FLNa and UCP2 in the development of cervical cancer[J]. Oncol Rep, 2020, 44(6): 2656-2668. doi: 10.3892/or.2020.7819
[6] 陆舜钦, 管竹春, 鲍丽娟. 螺旋CT三期增强扫描在结直肠癌诊断及分期中的诊断价值研究[J]. 中国CT和MRI杂志, 2018, 16(3): 100-102. doi: 10.3969/j.issn.1672-5131.2018.03.032 [7] 许良中, 杨文涛. 免疫组织化学反应结果的判断标准[J]. 中国癌症杂志, 1996, 6(4): 229-231. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGAZ604.000.htm [8] 蒋静, 陈燕, 吴宏. 线粒体解耦联蛋白2在宫颈癌中的作用及生物信息学分析[J]. 实用医学杂志, 2017, 33(1): 91-94. doi: 10.3969/j.issn.1006-5725.2017.01.024 [9] KUAI X Y, JI Z Y, ZHANG H J. Mitochondrial uncoupling protein 2 expression in colon cancer and its clinical significance[J]. World J Gastroenterol, 2010, 16(45): 5773-5778. doi: 10.3748/wjg.v16.i45.5773
[10] DONADELLI M, DANDO I, DALLA POZZA E, et al. Mitochondrial uncoupling protein 2 and pancreatic cancer: a new potential target therapy[J]. World J Gastroenterol, 2015, 21(11): 3232-3238. doi: 10.3748/wjg.v21.i11.3232
[11] HOSHOVS'KA IUV. The role of uncoupling proteins in mechanisms of protection from oxidative stress[J]. Fiziol Zh: 1994, 2015, 61(1): 91-101.
[12] TODA C, DIANO S. Mitochondrial UCP2 in the central regulation of metabolism[J]. Best Pract Res Clin Endocrinol Metab, 2014, 28(5): 757-764.
[13] DERDAK Z, MARK N M, BELDI G, et al. The mitochondrial uncoupling protein-2 promotes chemoresistance in cancer cells[J]. Cancer Res, 2008, 68(8): 2813-2819.
[14] 李秋妍, 彭瑶, 王浩丞, 等. UCP2参与人参皂苷PPD对肺腺癌A549细胞的抑制作用[C]. //中国生物化学与分子生物学会2019年全国学术会议暨学会成立四十周年论文集. 2019: 103-103. [15] 蒋滟蕲, 杨雅兰, 杨婷, 等. UCP2 rs659366位点多态性与结直肠癌术后患者生存结局的关系[J]. 浙江大学学报: 医学版, 2018, 47(2): 143-149. https://www.cnki.com.cn/Article/CJFDTOTAL-ZJYB201802008.htm -
期刊类型引用(2)
1. 何方,翁英,许洁颖. 老年阿尔茨海默病住院患者营养风险发生状况及其影响因素. 中国老年学杂志. 2023(01): 74-76 .  百度学术
百度学术
2. 陈丽琴. MISA评估对高龄患者营养和压力性损伤的影响. 中国继续医学教育. 2019(18): 138-141 .  百度学术
百度学术
其他类型引用(1)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号