Construction of a mortality competition risk model for patients with early-onset colorectal cancer
-
摘要:目的
分析早发性结直肠癌(EOCRC)患者发生肿瘤特异性死亡(CSM)的危险因素, 建立死亡风险预测模型并进行验证。
方法纳入监测、流行病学和最终结果(SEER)数据库2010—2019年经病理确诊的EOCRC患者14 554例, 并随机分成训练集10 188例及验证集4 366例。使用Fine-Gray竞争风险模型进行单因素及多因素分析,筛选EOCRC患者CSM率的影响因素; 建立预后预测模型,使用C指数、校准曲线进行内部验证,并绘制列线图。
结果病理类型、N分期、M分期、原发灶手术、区域淋巴结手术、远处转移灶手术及癌胚抗原(CEA)是EOCRC患者CSM率的独立影响因素(P < 0.05)。列线图模型的C指数接近0.8, 校准曲线贴合参考线。
结论本研究建立的EOCRC患者死亡竞争风险模型具有良好的预测价值,可以用于临床实践。
-
关键词:
- 早发性结直肠癌 /
- 肿瘤特异性死亡 /
- 竞争风险 /
- 预测模型 /
- 监测、流行病学和最终结果数据库
Abstract:ObjectiveTo analyze the risk factors of cancer-specific mortality (CSM) in patients with early-onset colorectal cancer (EOCRC), and to establish and verify the mortality risk prediction model.
MethodsA total of 14 554 patients pathologically diagnosed with EOCRC from 2010 to 2019 were included in the Surveillance, Epidemiology, and End Results (SEER) database and randomly divided into a training set with 10 188 patients and a validation set with 4 366 patients. Fine-Gray competitive risk model was used for univariate and multivariate analysis, and influencing factors of CSM rate in patients with EOCRC were screened. The prognostic model was established, the C index and calibration curve were used for internal verification, and the column graph was drawn.
ResultsPathological type, N stage, M stage, primary lesion surgery, regional lymph node surgery, distant metastasis surgery and carcinoembryonic antigen (CEA) were independent factors influencing the CSM rate of EOCRC patients (P < 0.05). The C-index of the line graph model was close to 0.8, and the calibration curves fitted the reference line.
ConclusionThe death competition risk model of EOCRC patients established in this study has good predictive value and can be used in clinical practice.
-
目前,医学界普遍将50岁前发病的结直肠癌(CRC)定义为早发性结直肠癌(EOCRC)[1-2]。EOCRC具有独特的病因及生物学特征,可能是区别于普通CRC的独立亚型[3-5]。临床上常用的肿瘤淋巴结转移(TNM)分期系统主要依据解剖特点判断预后,且解释较为复杂。传统的Cox比例风险模型将因其他原因产生的死亡作为删失数据,结论往往存在偏倚[6-8]。而竞争风险模型在考虑竞争事件的条件下,分析具有多种潜在结局的生存数据,可更为有效地消除竞争风险偏倚[9]。此外,监测、流行病学和最终结果(SEER)数据库是全球最可靠的大型多中心肿瘤登记注册数据库之一。因此,本研究系统分析了SEER数据库中EOCRC患者发生肿瘤特异性死亡(CSM)的危险因素,并建立列线图预后模型,以期为EOCRC患者的预后评估及决策优化提供参考。
1. 资料与方法
1.1 一般资料
提取SEER数据库中2010—2019年经病理确诊为CRC的14 554例患者的临床资料。纳入标准: 年龄18~49岁者; 临床资料完整者; 生存时间≥1个月的EOCRC者。使用R软件按7∶3的比例随机分成训练集与验证集,训练集数据用于模型的建立,验证集数据用于模型的验证。纳入研究的变量包括性别、年龄、肿瘤位置、病理类型、分化程度、T分期、N分期、M分期、原发灶手术、区域淋巴结手术、远处转移灶手术、放疗、化疗及癌胚抗原(CEA)。将CRC引起的死亡作为感兴趣事件,将死于其他原因作为竞争事件。主要观察指标为CSM, CSM定义为从确诊起至因CRC死亡的生存时间。本研究已签署《SEER数据使用协议》,鉴于数据库的数据均为匿名且已消除识别信息,故无需伦理审查及知情同意。研究参考《个体预后或诊断的多变量预测模型透明报告》(TRIPOD)声明进行报告[10]。
1.2 统计学分析
使用SPSS 26.0及R4.1.2软件进行数据分析。采用χ2检验进行组间均衡性比较。使用Fine-Gray竞争风险模型进行单因素及多因素分析。将单因素分析中差异有统计学意义的指标纳入多因素分析,并基于多因素分析中CSM率的独立影响因素,建立死亡风险预测模型,在10折交叉验证中使用C指数、校准曲线评估模型的判别能力、预测效能,并绘制预测1、3、5年CSM率的列线图。检验水准(α)为0.05。
2. 结果
2.1 EOCRC患者的临床病理特征分布
训练集与验证集患者的基线资料比较,差异无统计学意义(P>0.05), 具有可比性。通过训练集得到的统计模型可以在验证集中进行验证,见表 1。
表 1 训练集与验证集各指标的描述与比较[n(%)]变量 训练集(n=10 188) 验证集(n=4 366) χ2 P 生存状态 存活 7 447(73.1) 3 193(73.1) 0.003 0.999 死于原发肿瘤 2 523(24.8) 1 080(24.7) 死于其他原因 218(2.1) 93(2.1) 性别 女 4 895(48.0) 1 991(45.6) 7.325 0.007 男 5 293(52.0) 2 375(54.4) 年龄 18~30岁 542(5.3) 236(5.4) 0.044 0.834 31~49岁 9 646(94.7) 4 130(94.6) 肿瘤位置 右半结肠 3 094(30.4) 1 320(30.2) 0.078 0.962 左半结肠 4 772(46.8) 2 056(47.1) 直肠 2 322(22.8) 990(22.7) 病理类型 腺癌 9 279(91.1) 3 945(90.4) 1.910 0.167 非腺癌 909(8.9) 421(9.6) 分化程度 高分化 662(6.5) 283(6.5) 1.565 0.667 中分化 7 511(73.7) 3 182(72.9) 低分化 1 715(16.8) 762(17.5) 未分化 300(2.9) 139(3.2) T分期 T1期 954(9.4) 420(9.6) 2.483 0.478 T2期 1 103(10.8) 498(11.4) T3期 5 909(58.0) 2 538(58.1) T4期 2 222(21.8) 910(20.8) N分期 N0期 4 253(41.7) 1 811(41.5) 0.696 0.706 N1期 3 470(34.1) 1 517(34.7) N2期 2 465(24.2) 1 038(23.8) M分期 M0期 7 883(77.4) 3 411(78.1) 0.992 0.319 M1期 2 305(22.6) 955(21.9) 原发灶手术 无 525(5.2) 239(5.5) 0.633 0.426 有 9 663(94.8) 4 127(94.5) 区域淋巴结手术 无 853(8.4) 381(8.7) 0.493 0.482 有 9 335(91.6) 3 985(91.3) 远处转移灶手术 无 9 057(88.9) 3 905(89.4) 0.923 0.337 有 1 131(11.1) 461(10.6) 化疗 无 3 037(29.8) 1 304(29.9) 0.005 0.945 有 7 151(70.2) 3 062(70.1) 放疗 无 8 167(80.2) 3 468(79.4) 1.018 0.313 有 2 021(19.8) 898(20.6) 治疗前癌胚抗原 正常 5 913(58.0) 2 531(58.0) 0.006 0.939 升高 4 275(42.0) 1 835(42.0) 2.2 EOCRC患者发生CSM竞争风险模型分析
单因素分析结果显示,除放疗以外,其余因素均与EOCRC患者发生CSM相关(P < 0.05)。进一步多因素分析结果显示,病理类型、N分期、M分期、原发灶手术、区域淋巴结手术、远处转移灶手术及CEA是影响EOCRC患者CSM率的独立预后因素(P < 0.05), 见表 2。
表 2 EOCRC患者CSM影响因素的竞争风险模型分析变量(参考) 单因素分析 多因素分析 HR 95%CI P HR 95%CI P 性别(女) 男 1.16 1.07~1.26 < 0.001 1.08 0.99~1.17 0.070 年龄(18~30岁) 31~49岁 0.74 0.63~0.87 < 0.001 0.88 0.73~1.06 0.180 部位(右半结肠) 左半结肠 0.88 0.80~0.96 0.008 0.85 0.77~0.94 0.002 直肠 0.92 0.83~1.03 0.170 0.95 0.84~1.07 0.450 病理类型(腺癌) 非腺癌 1.88 1.67~2.11 < 0.001 1.47 1.28~1.69 < 0.001 分化程度(高分化) 中分化 1.43 1.17~1.76 < 0.001 1.18 0.97~1.44 0.096 低分化 3.32 2.68~4.10 < 0.001 1.99 1.60~2.46 < 0.001 未分化 3.02 2.30~3.97 < 0.001 2.01 1.52~2.65 < 0.001 T分期(T1期) T2期 0.50 0.39~0.64 < 0.001 0.79 0.61~1.01 0.065 T3期 1.19 1.01~1.41 0.031 1.07 0.89~1.28 0.460 T4期 3.10 2.62~3.67 < 0.001 1.59 1.31~1.94 < 0.001 N分期(N0期) N1期 2.30 2.07~2.55 < 0.001 1.56 1.38~1.76 < 0.001 N2期 4.13 3.72~4.58 < 0.001 2.13 1.88~2.43 < 0.001 M分期(M0期) M1期 8.25 7.61~8.94 < 0.001 4.87 4.38~5.43 < 0.001 原发性手术(无) 有 0.19 0.17~0.22 < 0.001 0.54 0.42~0.70 < 0.001 区域淋巴结手术(无) 有 0.33 0.29~0.36 < 0.001 0.67 0.54~0.83 < 0.001 远处转移灶手术(无) 有 2.18 1.98~2.40 < 0.001 0.79 0.71~0.89 < 0.001 化疗(无) 有 2.71 2.42~3.04 < 0.001 0.96 0.82~1.11 0.610 放疗(无) 有 1.05 0.96~1.15 0.270 癌胚抗原(正常) 升高 3.45 3.17~3.74 < 0.001 1.74 1.58~1.92 < 0.001 2.3 EOCRC患者CSM率预测模型建立及验证
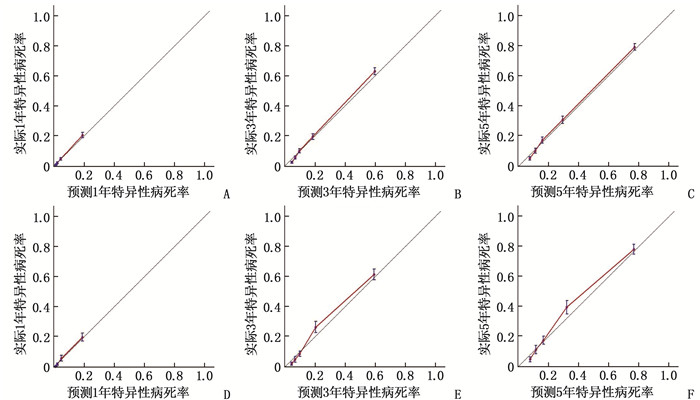
根据多因素分析结果拟合EOCRC患者的死亡风险模型,训练集和验证集的1、3、5年C指数分别为0.811、0.810、0.810和0.795、0.795、0.795, 说明模型可以较好地区分发生与未发生结局事件的个体。校准图显示、1、3、5年CSM率的预测值与实际值非常接近,预测效能良好,见图 1。在列线图中,通过将各因素的分数相加得到总分,总分对应的值即可估计EOCRC患者1、3、5年的CSM率,见图 2。
3. 讨论
EOCRC患者的发病率逐年升高,其生存分析的结果已被相继报道[11-14], 但考虑竞争风险的研究尚处于空白状态。TNM分期系统是预测肿瘤患者生存状况及指导治疗的重要工具,本研究分别研究T、N、M分期发现,存在淋巴结转移及远处转移的EOCRC患者存在较高的死亡风险,这与临床一贯认知相符,而T分期对其预后无明显影响,这也间接反映TNM分期系统在准确区分EOCRC患者的预后方面存在缺陷。
目前根治性手术仍然是可切除性CRC的首选治疗方案,手术应尽可能切除原发肿瘤及转移肿瘤,且应同时进行淋巴结清扫[15]。研究[16]指出, Ⅳ期CRC患者的生存时间与转移器官的部位及数量有关,通过积极治疗避免或减少其他器官的转移,可延长晚期CRC患者的生存期。如前所述,本研究也证实手术可能是EOCRC患者预后的保护性因素。既往研究[17]表明, EOCRC患者相对多见低分化腺癌、黏液腺癌及印戒细胞癌,肿瘤分化程度低,呈浸润性生长,且容易发生扩散及转移,因此预后不良。CEA在约40%的CRC患者中呈高表达,与肿瘤分期及有无淋巴结转移相关[18-19], CEA阳性者预后较差。此外,中国结直肠癌诊疗规范及美国国立综合癌症网络(NCCN)指南[15-16]表明,放疗适合T3、T4期和(或)局部晚期不可切除的CRC患者,化疗主要用于Ⅱ期高危及Ⅲ期患者。放化疗不仅有助于提高手术切除率,而且有助于降低肿瘤复发率。本研究发现,接受放疗未能降低EOCRC患者的特异性死亡风险,其原因可能是患者的随访时间较短,导致是否放疗的差异未得到明显区分,也可能是由于放疗相关的毒副作用减少了生存受益。研究[4, 20]表明,EOCRC患者更倾向于接受(新)辅助治疗,即使这种治疗可能没有临床指征。相关研究[21]提示,仅仅基于CRC诊断年龄的积极治疗是没有必要的。本研究中,EOCRC患者行化疗的疗效优势不明显,分析其原因可能与EOCRC患者更常见高度微卫星不稳定(MSI-H)状态有关[22], 这提示若对化疗不敏感,使用免疫检查点抑制剂可能有益[23]。NCCN指南建议CRC患者应进行微卫星不稳定(MSI)检测,以评估其能否从化疗中受益,避免因过度治疗而导致副反应[24]。
同时,本研究中性别、年龄、肿瘤位置、病理分级在多因素分析中未能成为EOCRC患者CSM率的影响因素。这可能是因为研究对象为18~49岁的患者,该年龄段患者的身体素质没有太大差异,所以未能影响预后[25], 此外还可能与本研究的样本来源、样本量及纳入变量等方面有关。本研究存在一定的局限性: ① SEER数据库未包含详尽的治疗方案、基因表达信息、免疫治疗等指标,可能会影响预测模型的准确全面性。②回顾性研究可能会导致固有偏倚,直接删除存在缺失数据的患者可能会引入选择偏倚。③研究中缺少独立的外部验证,可能会影响预测模型的实用普遍性。未来仍需优化预测因子的选择,并基于前瞻性随机临床试验加以证实。
综上所述,本研究基于病理类型、N分期、M分期、原发灶手术、区域淋巴结手术、远处转移灶手术及CEA共7个指标建立的EOCRC患者CSM率列线图预测模型区分能力良好,可有效评估患者的死亡风险,对EOCRC患者的个体化预后干预具有临床指导意义。
-
表 1 训练集与验证集各指标的描述与比较[n(%)]
变量 训练集(n=10 188) 验证集(n=4 366) χ2 P 生存状态 存活 7 447(73.1) 3 193(73.1) 0.003 0.999 死于原发肿瘤 2 523(24.8) 1 080(24.7) 死于其他原因 218(2.1) 93(2.1) 性别 女 4 895(48.0) 1 991(45.6) 7.325 0.007 男 5 293(52.0) 2 375(54.4) 年龄 18~30岁 542(5.3) 236(5.4) 0.044 0.834 31~49岁 9 646(94.7) 4 130(94.6) 肿瘤位置 右半结肠 3 094(30.4) 1 320(30.2) 0.078 0.962 左半结肠 4 772(46.8) 2 056(47.1) 直肠 2 322(22.8) 990(22.7) 病理类型 腺癌 9 279(91.1) 3 945(90.4) 1.910 0.167 非腺癌 909(8.9) 421(9.6) 分化程度 高分化 662(6.5) 283(6.5) 1.565 0.667 中分化 7 511(73.7) 3 182(72.9) 低分化 1 715(16.8) 762(17.5) 未分化 300(2.9) 139(3.2) T分期 T1期 954(9.4) 420(9.6) 2.483 0.478 T2期 1 103(10.8) 498(11.4) T3期 5 909(58.0) 2 538(58.1) T4期 2 222(21.8) 910(20.8) N分期 N0期 4 253(41.7) 1 811(41.5) 0.696 0.706 N1期 3 470(34.1) 1 517(34.7) N2期 2 465(24.2) 1 038(23.8) M分期 M0期 7 883(77.4) 3 411(78.1) 0.992 0.319 M1期 2 305(22.6) 955(21.9) 原发灶手术 无 525(5.2) 239(5.5) 0.633 0.426 有 9 663(94.8) 4 127(94.5) 区域淋巴结手术 无 853(8.4) 381(8.7) 0.493 0.482 有 9 335(91.6) 3 985(91.3) 远处转移灶手术 无 9 057(88.9) 3 905(89.4) 0.923 0.337 有 1 131(11.1) 461(10.6) 化疗 无 3 037(29.8) 1 304(29.9) 0.005 0.945 有 7 151(70.2) 3 062(70.1) 放疗 无 8 167(80.2) 3 468(79.4) 1.018 0.313 有 2 021(19.8) 898(20.6) 治疗前癌胚抗原 正常 5 913(58.0) 2 531(58.0) 0.006 0.939 升高 4 275(42.0) 1 835(42.0) 表 2 EOCRC患者CSM影响因素的竞争风险模型分析
变量(参考) 单因素分析 多因素分析 HR 95%CI P HR 95%CI P 性别(女) 男 1.16 1.07~1.26 < 0.001 1.08 0.99~1.17 0.070 年龄(18~30岁) 31~49岁 0.74 0.63~0.87 < 0.001 0.88 0.73~1.06 0.180 部位(右半结肠) 左半结肠 0.88 0.80~0.96 0.008 0.85 0.77~0.94 0.002 直肠 0.92 0.83~1.03 0.170 0.95 0.84~1.07 0.450 病理类型(腺癌) 非腺癌 1.88 1.67~2.11 < 0.001 1.47 1.28~1.69 < 0.001 分化程度(高分化) 中分化 1.43 1.17~1.76 < 0.001 1.18 0.97~1.44 0.096 低分化 3.32 2.68~4.10 < 0.001 1.99 1.60~2.46 < 0.001 未分化 3.02 2.30~3.97 < 0.001 2.01 1.52~2.65 < 0.001 T分期(T1期) T2期 0.50 0.39~0.64 < 0.001 0.79 0.61~1.01 0.065 T3期 1.19 1.01~1.41 0.031 1.07 0.89~1.28 0.460 T4期 3.10 2.62~3.67 < 0.001 1.59 1.31~1.94 < 0.001 N分期(N0期) N1期 2.30 2.07~2.55 < 0.001 1.56 1.38~1.76 < 0.001 N2期 4.13 3.72~4.58 < 0.001 2.13 1.88~2.43 < 0.001 M分期(M0期) M1期 8.25 7.61~8.94 < 0.001 4.87 4.38~5.43 < 0.001 原发性手术(无) 有 0.19 0.17~0.22 < 0.001 0.54 0.42~0.70 < 0.001 区域淋巴结手术(无) 有 0.33 0.29~0.36 < 0.001 0.67 0.54~0.83 < 0.001 远处转移灶手术(无) 有 2.18 1.98~2.40 < 0.001 0.79 0.71~0.89 < 0.001 化疗(无) 有 2.71 2.42~3.04 < 0.001 0.96 0.82~1.11 0.610 放疗(无) 有 1.05 0.96~1.15 0.270 癌胚抗原(正常) 升高 3.45 3.17~3.74 < 0.001 1.74 1.58~1.92 < 0.001 -
[1] MURPHY N, CAMPBELL P T, GUNTER M J. Unraveling the etiology of early-onset colorectal cancer[J]. J Natl Cancer Inst, 2021, 113(5): 505-506. doi: 10.1093/jnci/djaa165
[2] GOGENUR I, QVORTRUP C. Colorectal cancer screening in Europe: what are the next steps[J]. Lancet Oncol, 2021, 22(7): 898-899. doi: 10.1016/S1470-2045(21)00276-X
[3] CHEN Y L, CHEN Z X, HUANG J N, et al. Clinicopathological and molecular characteristics of early-onset vs late-onset colorectal cancer according to tumor location[J]. Int J Clin Oncol, 2022, 27(4): 749-755. doi: 10.1007/s10147-021-02101-9
[4] HIMBERT C, FIGUEIREDO J C, SHIBATA D, et al. Clinical characteristics and outcomes of colorectal cancer in the ColoCare study: differences by age of onset[J]. Cancers (Basel), 2021, 13(15): 3817. doi: 10.3390/cancers13153817
[5] SHEN J, WU Y L, MO M, et al. Risk factors associated with early-onset colorectal neoplasm in Chinese youth: a prospective population-based study[J]. Front Oncol, 2021, 11: 702322. doi: 10.3389/fonc.2021.702322
[6] WU W T, YANG J, LI D N, et al. Competitive risk analysis of prognosis in patients with cecum cancer: a population-based study[J]. Cancer Control, 2021, 28: 1073274821989316.
[7] DE GLAS N A, KIDERLEN M, VANDENBROUCKE J P, et al. Performing survival analyses in the presence of competing risks: a clinical example in older breast cancer patients[J]. J Natl Cancer Inst, 2016, 108(5): djv366. doi: 10.1093/jnci/djv366
[8] 王肖飞, 张国庆, 吴彬, 等. 食管神经内分泌癌患者原因别死亡竞争风险模型的建立与评价[J]. 临床肿瘤学杂志, 2019, 24(3): 231-236. doi: 10.3969/j.issn.1009-0460.2019.03.008 [9] 李海彬, 李霞, 王安心, 等. 竞争风险模型及其在Stata软件实现[J]. 中国卫生统计, 2016, 33(5): 889-891, 895. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGWT201605050.htm [10] 李秋萍, 谷鸿秋, 王俊峰. 临床预测模型: TRIPOD报告规范解读: 以心血管疾病预测模型QRISK3为例(上)[J]. 中国循证心血管医学杂志, 2020, 12(7): 778-782, 793. doi: 10.3969/j.issn.1674-4055.2020.07.03 [11] MCCLELLAND P H T, LIU T M, OZUNER G. Early-onset colorectal cancer in patients under 50 years of age: demographics, disease characteristics, and survival[J]. Clin Colorectal Cancer, 2022, 21(2): e135-e144. doi: 10.1016/j.clcc.2021.11.003
[12] FONTANA E, MEYERS J, SOBRERO A, et al. Early-onset colorectal adenocarcinoma in the IDEA database: treatment adherence, toxicities, and outcomes with 3 and 6 months of adjuvant fluoropyrimidine and oxaliplatin[J]. J Clin Oncol, 2021, 39(36): 4009-4019. doi: 10.1200/JCO.21.02008
[13] CHENG E, BLACKBURN H N, NG K, et al. Analysis of survival among adults with early-onset colorectal cancer in the national cancer database[J]. JAMA Netw Open, 2021, 4(6): e2112539. doi: 10.1001/jamanetworkopen.2021.12539
[14] WU J X, LU L B, CHEN H, et al. Prognostic nomogram to predict the overall survival of patients with early-onset colorectal cancer: a population-based analysis[J]. Int J Colorectal Dis, 2021, 36(9): 1981-1993. doi: 10.1007/s00384-021-03992-w
[15] 中国临床肿瘤学会指南工作委员会组织. 中国临床肿瘤学会(CSCO)结直肠癌诊疗指南-2021[M]. 北京: 人民卫生出版社, 2021: 5-10. [16] PROVENZALE D, NESS R M, LLOR X, et al. NCCN guidelines insights: colorectal cancer screening, version 2. 2020[J]. J Natl Compr Canc Netw, 2020, 18(10): 1312-1320. doi: 10.6004/jnccn.2020.0048
[17] REACCT COLLABORATIVE, ZABOROWSKI A M, ABDILE A, et al. Characteristics of early-onset vs late-onset colorectal cancer: a review[J]. JAMA Surg, 2021, 156(9): 865-874. doi: 10.1001/jamasurg.2021.2380
[18] 贾沛杰. 血清CA724、CA199联合CEA诊断结直肠癌的临床价值[J]. 中国肛肠病杂志, 2022, 42(5): 14-16. https://www.cnki.com.cn/Article/CJFDTOTAL-GCBZ202205006.htm [19] 曾凡鹏, 路庆艳, 李青. 术前HPR、LCR和CEA水平在结直肠癌中的临床价值分析[J]. 国际检验医学杂志, 2022, 43(7): 818-822. doi: 10.3969/j.issn.1673-4130.2022.07.011 [20] KOLARICH A, GEORGE T J Jr, HUGHES S J, et al. Rectal cancer patients younger than 50 years lack a survival benefit from NCCN guideline-directed treatment for stage II and III disease[J]. Cancer, 2018, 124(17): 3510-3519. doi: 10.1002/cncr.31527
[21] CERCEK A, CHATILA W K, YAEGER R, et al. A comprehensive comparison of early-onset and average-onset colorectal cancers[J]. J Natl Cancer Inst, 2021, 113(12): 1683-1692. doi: 10.1093/jnci/djab124
[22] WILLAUER A N, LIU Y S, PEREIRA A A L, et al. Clinical and molecular characterization of early-onset colorectal cancer[J]. Cancer, 2019, 125(12): 2002-2010. doi: 10.1002/cncr.31994
[23] YAMASHITA R, LONG J, LONGACRE T, et al. Deep learning model for the prediction of microsatellite instability in colorectal cancer: a diagnostic study[J]. Lancet Oncol, 2021, 22(1): 132-141. doi: 10.1016/S1470-2045(20)30535-0
[24] CONNELL L C, MOTA J M, BRAGHIROLI M I, et al. The rising incidence of younger patients with colorectal cancer: questions about screening, biology, and treatment[J]. Curr Treat Options Oncol, 2017, 18(4): 23. doi: 10.1007/s11864-017-0463-3
[25] 朱旭, 陈书, 魏歆然, 等. 基于Fine-Gray竞争风险模型的青年胃癌患者预后影响因素研究[J]. 第二军医大学学报, 2021, 42(10): 1140-1147. https://www.cnki.com.cn/Article/CJFDTOTAL-DEJD202110008.htm -
期刊类型引用(7)
1. 陈易华,罗艳,田强,曾冬梅,许雷. 结直肠癌组织中核受体视黄酸X受体a及核受体相互作用蛋白1的表达与预后的关系. 实用临床医药杂志. 2024(07): 36-40 .  本站查看
本站查看
2. 朱国玉,吴洋,秦陈,张晓春,李文骥. 中老年Ⅱ~Ⅲ期胃癌患者预后预测列线图模型的构建和验证. 实用临床医药杂志. 2024(17): 27-34+40 .  本站查看
本站查看
3. 施辉,樊健,王威,王凯健,倪晓东,樊春笋. SEER数据库14805例扁桃体鳞癌患者预后关联因素及竞争风险分析. 实用临床医药杂志. 2024(23): 42-46+51 .  本站查看
本站查看
4. 曹宇星,田龙,王晨宇. 一种新型直肠癌患者死亡风险预测技术—机器学习联合医学统计. 现代肿瘤医学. 2023(19): 3621-3625 .  百度学术
百度学术
5. 高丹丹,张恒,秦浩人,王辉. 术后早发性结直肠癌患者预后模型的构建及验证. 中国医药导报. 2023(27): 20-24+29 .  百度学术
百度学术
6. 林曼仪,叶伟杰,付肖岩. 早发性结直肠癌的防治进展. 实用临床医药杂志. 2023(19): 139-142+148 .  本站查看
本站查看
7. 王佩佩,双卫兵. 生存分析概述及模型应用. 中国医学工程. 2023(11): 62-68 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号