The risk prediction of premature coronary artery heart disease: development and evaluation of a clinical-nomogram
-
摘要:目的
探讨与早发冠心病(PCAD)发生相关的因素,并构建用于预测PCAD发生风险的列线图。
方法回顾性收集疑诊PCAD的202例患者的临床资料(训练集)。共收集26项人口统计学及血生化指标,以是否发生PCAD将研究对象分为PCAD组(n=139)和非冠心病组(NCAD组,n=63)。采用单因素分析及Logistic前向逐步回归法分析预测指标、筛选PCAD的独立相关因素以及构建列线图;通过计算C指数、绘制校准曲线和决策分析曲线评估模型区分度、校准度及临床有效性;采用1 000次Bootstrapping法进行内部验证。
结果空腹血糖调节受损/糖尿病、高血压、白细胞-高密度脂蛋白比值(LHR)≥7.58、超重/肥胖、吸烟与PCAD发生具有显著相关性(P < 0.05);基于上述因素构建的列线图具有良好的区分能力(C指数=0.815,95%CI:0.757~0.873)、校准度及临床有效性。内部验证时模型也表现出良好的区分度(C指数=0.798)。
结论基于LHR、吸烟、高血压、体质量指数(BMI)、空腹血糖等因素构建的列线图可以用于预测临床疑诊冠心病的年轻患者发生PCAD的风险,具有潜在临床应用价值。
Abstract:ObjectiveTo investigate the factors associated with the occurrence of premature coronary artery disease (PCAD), and to construct a column graph to predict the risk of PCAD.
MethodsClinical data of 202 patients suspected of PCAD were retrospectively collected (training set). A total of 26 demographic and blood biochemical indicators were collected, and the subjects were divided into PCAD group (n=139) and non-coronary heart disease group (NCAD group, n=63) according to the occurrence of PCAD. Univariate analysis and Logistic forward stepwise regression were used to analyze the prediction indicators, screen the independent correlation factors of PCAD and constructed the nomogram. The model differentiation, calibration and clinical effectiveness were evaluated by calculating C index, drawing calibration curve and decision analysis curve. The 1 000 times Bootstrapping method was used for internal verification.
ResultsImpaired fasting glucose regulation/diabetes mellitus, hypertension, leukocyte-high-density lipoprotein cholesterol ratio (LHR) ≥ 7.58, overweight/obesity and smoking were significantly correlated with the occurrence of PCAD (P < 0.05). The column chart constructed based on the above factors had good differentiation ability (C index=0.815, 95%CI, 0.757 to 0.873), calibration degree and clinical effectiveness. The model also showed good differentiation during internal validation (C index=0.798).
ConclusionThe nomogram constructed based on LHR, smoking, hypertension, body massindex (BMI), fasting blood glucose and other factors can be used to predict the risk of PCAD in young patients suspected of coronary heart disease, which has potential clinical application value.
-
冠心病(CHD)是全球最常见的致残、致死性疾病[1], 中国CHD的发病率、病死率较高,且呈年轻化趋势,给社会带来沉重负担[2]。早发冠心病(PCAD)定义为首次诊断冠心病时患者年龄≤65岁(女性)或≤55岁(男性),其是导致年轻人社会生产力受限及意外死亡的原因之一[3]。早期诊断可能是改善PCAD患者预后的关键突破点,但由于PCAD人群与传统CHD人群发病危险因素不完全相同,既往基于CHD危险因素所构建的评分工具常不能准确发现PCAD高风险个体[3-5]。因此,找寻新的临床预测指标及构建新的风险预测工具将有助于更好地识别人群中潜在的PCAD高风险个体,从而实现早期干预、降低疾病负担的目标。CHD传统危险因素及一些新兴临床复合指标对PCAD可能具有一定的预测诊断能力[5-6], 但基于上述因素开发列线图用于预测PCAD发生风险的文献较少。本研究收集202例疑诊为PCAD的患者资料,探究PCAD发病的独立因素,并用于开发及验证一个预测PCAD发病风险的列线图模型,以提高对年轻患者发生PCAD风险的预测能力。
1. 资料及方法
1.1 患者人群
本研究采取横断面研究方法,回顾性收集2020年1—12月内蒙古自治区巴彦淖尔市医院电子病历库中首次就诊于心内一科且疑诊为PCAD患者的人口统计学及临床资料,根据纳入、排除标准,最终入组202例。入组患者均用于组成模型训练集,模型的内部验证采用1 000次Bootstrapping法。以冠状动脉造影结果为依据,将研究对象分为PCAD组(n=139)和非冠心病组(NCAD组, n=63)。PCAD组男81例,女58例,患者年龄31~65岁,中位年龄为54(50, 58)岁; NCAD组男21例,女42例,患者年龄33~65岁,中位年龄53 (48, 58)岁。本项研究属回顾性研究,患者相关临床资料来自医院电子病历系统,不对患者隐私及权利产生不利影响,符合患者知情同意豁免条件。内蒙古自治区巴彦淖尔市医院伦理审查委员会已批准本研究的开展(批件号: 20220705001)。
纳入标准: ①男性≤55岁,女性≤65岁; ②因不同程度的心前区不适、胸痛、胸闷、心悸、呼吸困难、心电图异常或其他冠心病相关症状来院,并怀疑为冠心病且住院治疗者[7]; ③成功完成冠状动脉造影介入术者。排除标准: ①既往诊断冠心病或其他心血管疾病,需长期服用或在入院前1个月内存在服用调脂和/或抗血小板药物者; ②既往行冠状动脉介入术或冠状动脉搭桥手术者; ③既往存在严重心、肝、肾功能不全及精神疾病者; ④同时患有血液及其他系统恶性肿瘤者; ⑤合并甲状腺疾病且甲状腺功能异常者; ⑥临床病例资料缺失严重、不能完整收集者。
1.2 相关疾病诊断标准
① CHD诊断标准: 冠状动脉造影发现1支及以上的冠状动脉及其主要分支发生≥50%狭窄。② PCAD诊断标准: 诊断冠心病时,患者年龄≤55岁(男)或≤65岁(女)[8]。③高血压的判断标准: 入院时存在服用降压药物或间隔5 min以上2次坐位血压均值≥140/90 mmHg[9]; 吸烟、饮酒标准定义为截止入院时,患者仍存在吸烟、饮酒行为。
1.3 观察指标
拟分析患者指标从医院电子病例库中提取,包括以下内容。①人口统计学资料: 年龄、高血压、糖尿病、吸烟情况、饮酒情况、体质量指数(BMI)、入院当天上午或第2天清晨空腹血糖(FPG); ②血脂相关指标: 甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、极低密度脂蛋白胆固醇(VLDL-C)及高密度脂蛋白胆固醇(HDL-C)、小而密低密度脂蛋白胆固醇(sdLDL-C); ③血常规、凝血及肝肾功能指标: 谷丙转氨酶(ALT)、白细胞(WBC)、谷草转氨酶(AST)、纤维蛋白原(FIB)、D-二聚体(D-D)、血肌酐(Cr)、血尿酸(UA)。根据公式AI=(TC-HDL)/HDL、AIP=lg(TC/HDL)、TyG=ln(TG×FPG/2)、LHR=WBC/HDL分别计算动脉硬化指数(AI)、血浆致动脉硬化指数(AIP)、甘油三酯-葡萄糖指数(TyG指数)、白细胞与高密度脂蛋白比值(LHR)。以上血生化指标均来自于入院当天且未予以药物治疗时所采集的血液标本。
为保证最终模型的可解释性,本研究将最终用于构建预测模型的指标均转化为二分类指标。以PCAD为状态变量绘制了LHR的受试者工作特征(ROC)曲线,并根据cut-off值=7.58转换为二分类指标。BMI分类为正常(BMI < 24 kg/m2)、超重/肥胖(BMI≥24 kg/m2); FPG分类为正常血糖(FPG < 6.1 mmol/L)、空腹血糖调节受损/糖尿病(FPG≥6.1 mmol/L)。
1.4 统计学分析
本探究数据采用SPSS 25.0及R软件(4.1.3版本, www.r-project.org)进行处理分析。本研究仅纳入临床资料完整的患者,故无缺失数据需要进行处理。以(x±s)描述正态分布计量资料,组间比较行两独立样本t检验; 以[M(P25, P75)]表示偏态分布计量资料,组间比较采用Mann-Whitney U检验; 计数资料以[n(%)]表示,组间比较采用Person卡方检验。采用多因素Logistic回归分析以明确PCAD的独立相关因素,模型运行方式为前向逐步回归法。连续性自变量与Logit(P)间的非线性关系采用Box-Tidwell检验,并根据Bonferroni法矫正检验水准; 方差膨胀因子(VIF)用于检验自变量间的多重共线性关系, VIF>10代表存在严重多重共线性问题。基于Logistic回归模型构建列线图,以C指数判断模型区分度、校准图判断模型一致性、决策曲线分析(DCA)评价模型的临床实用性; 采用1 000次Bootstrapping法进行内部验证。构建列线图模型时使用的R软件包包括forestplot、rms、foreign、pROC及rmda包。本研究取双侧检验水准α=0.05, P < 0.05为差异有统计学意义。
2. 结果
2.1 患者临床资料比较
2.1.1 2组患者基线人口统计学指标的单因素分析
PCAD组与NCAD组在年龄、饮酒方面比较,差异无统计学意义(P>0.05); 与NCAD组比较, PCAD组患者中男性、BMI≥24.00 kg/m2、高血压、吸烟和糖尿病占比更高,差异具有统计学意义(P < 0.05), 见表 1。
表 1 2组基线人口统计学资料比较[n(%)][M(P25, P75)]一般资料 分类 PCAD组(n=139) NCAD组(n=63) t/Z/χ2 P 年龄/岁 54(50, 58) 53(48, 58) -0.400 0.690 性别 女 58(41.73) 42 (66.67) 男 81(58.27) 21 (33.33) 10.787 0.001 体质量指数 < 24.0 kg/m2 23(16.55) 21 (33.33) ≥24.0 kg/m2 116(83.45) 42 (66.67) 7.170 0.007 高血压 无 63(45.32) 42 (66.67) 有 76(54.68) 21 (33.33) 7.911 0.005 糖尿病 无 107(76.98) 56(88.89) 有 32(23.02) 7(11.11) 3.947 0.047 吸烟 无 88(63.31) 55(87.30) 有 51(36.69) 8(12.70) 12.069 < 0.001 饮酒 无 122(87.77) 58(92.06) 有 17(12.23) 5(7.94) 0.824 0.364 2.1.2 2组患者血生化指标的单因素分析
2组在TC、TG、VLDL-C、LDL、sdLDL、UA、Cr、Uera、FIB、D-D、AST水平方面比较, 差异无统计学意义(P>0.05); 与NCAD组相比, PCAD组患者的FPG、AI、ALT、WBC、AIP、TyG指数、LHR水平更高, HDL-C水平更低,差异有统计学意义(P < 0.05), 见表 2。
表 2 2组患者血生化指标比较(x±s)[n(%)][M(P25, P75)]指标 PCAD组(n=139) NCAD组(n=63) t/Z/χ2 P FPG
< 6.1 mmol/L84(60.43) 53(84.13) 11.153 < 0.001 ≥6.1 mmol/L 55(39.57) 10(15.87) TC/(mmol/L) 4.56±0.98 4.72±0.92 1.108 0.269 TG/(mmol/L) 2.17±1.32 1.86±1.28 -1.524 0.129 HDL-C/(mmol/L) 1.04±0.26 1.20±0.33 4.176 < 0.001 LDL-C/(mmol/L) 2.82±0.78 2.90±0.92 0.663 0.508 VLDL-C/(mmol/L) 0.37±0.26 0.41±0.24 -1.180 0.239 sdLDL-C/(mmol/L) 0.96±0.48 0.84±0.43 -1.693 0.092 UA/(μmol/L) 325.00(260.00, 384.00) 294.00(239.00, 347.00) -1.941 0.520 Cr/(μmol/L) 72.00(61.00, 87.00) 70.00(61.00, 81.00) -1.207 0.227 Uera/(mmol/L) 5.18(4.46, 6.28) 4.96(4.05, 5.80) -1.825 0.068 FIB/(g/L) 2.88(2.42, 3.28) 2.70(2.38, 3.25) -1.456 0.145 D-D/(mg/L FEU) 0.21(0.15, 0.36) 0.19(0.15, 0.30) -0.933 0.105 AST/(U/L) 20.00(16.00, 31.00) 19.00(16.00, 24.00) -1.619 0.105 ALT/(U/L) 23.00(16.00, 33.00) 18.00(11.00, 28.00) -2.724 0.006 WBC/(×109/L) 7.74(5.35, 9.49) 6.33(5.37, 7.55) -4.143 < 0.001 AI 2.83±0.95 2.52±0.96 -2.160 0.032 AIP 0.27±0.27 0.13±0.30 3.179 0.002 LHR 7.42(5.87, 9.83) 6.33(5.37, 7.55) -5.302 < 0.001 TyG指数 1.68(1.31, 2.14) 1.39(1.02, 1.73) -3.223 0.001 FPG: 空腹血糖; TC: 总胆固醇; TG: 甘油三酯; HDL-C: 高密度脂蛋白胆固醇; LDL-C: 低密度脂蛋白胆固醇;
VLDL-C: 极低密度脂蛋白胆固醇; sdLDL-C: 小而密低密度脂蛋白胆固醇; UA: 尿酸; Cr: 肌酐; Uera: 尿素氮;
FIB: 纤维蛋白原; D-D: D-二聚体; AST: 天冬氨酸氨基转移酶; ALT: 丙氨酸氨基转移酶; WBC: 白细胞;
AI: 动脉硬化指数; AIP: 血浆致动脉粥样硬化指数; LHR: 白细胞-高密度脂蛋白比值; TyG指数: 三酰甘油-葡萄糖指数。2.1.3 多因素Logistic回归分析PCAD发生独立相关因素
Box-Tidwell检验结果显示,单因素分析有统计学差异的连续性变量与Logit转换后的因变量间不存在非线性关系。但部分变量间存在严重共线性问题,为保证所构建模型的稳定性,本研究剔除了存在严重共线性的指标ALT、WBC, 最终对性别、高血压、糖尿病、吸烟、BMI、FPG、HDL-C、AI、AIP、TyG指数及LHR共11个指标进行多因素Logistic回归分析。结果表明, LHR、FPG、高血压、吸烟、超重/肥胖与PCAD的发生显著相关(P < 0.05)。其中, LHR≥7.58将增加PCAD的发生风险(OR=5.85, 95%CI: 2.45~13.95, P < 0.001); FPG≥6.1 mmol/L将导致发生PCAD的风险增加,差异具有统计学意义(OR=3.45, 95%CI: 1.51~7.91, P=0.003)。患有高血压将增加PCAD的发生风险,差异具有统计学意义(OR=2.57, 95%CI: 1.26~5.27, P=0.010); 吸烟将增加PCAD发生风险,差异具有统计学意义(OR=4.23, 95%CI: 1.68~10.66, P=0.002); BMI≥24.0 kg/m2将增加PCAD发生风险,差异具有统计学意义(OR=2.28, 95%CI: 1.01~15.12, P=0.460), 见表 3。
表 3 多因素Logistic回归分析PCAD发生独立相关因素特征 分类 β SE Wald χ2 OR(95%CI) P 截距 -1.405 0.431 10.620 0.245(—) 0.001 LHR < 7.58 ≥7.58 1.766 0.444 15.836 5.845(2.450~13.947) < 0.001 吸烟 无 有 1.442 0.472 9.339 4.227(1.677~10.655) 0.002 高血压 无 有 0.945 0.366 6.667 2.572(1.256~5.270) 0.010 FPG < 6.1 mmol/L ≥6.1 mmol/L 1.240 0.423 8.608 3.454(1.509~7.907) 0.003 BMI < 24 kg/m2 ≥24 kg/m2 0.823 0.413 3.970 2.277(1.014~5.117) 0.046 LHR: 白细胞-高密度脂蛋白比值; FPG: 空腹血糖; BMI: 体质量指数。 2.2 预测早发冠心病的临床列线图模型的构建与验证
2.2.1 预测PCAD发生风险的列线图的构建与评价
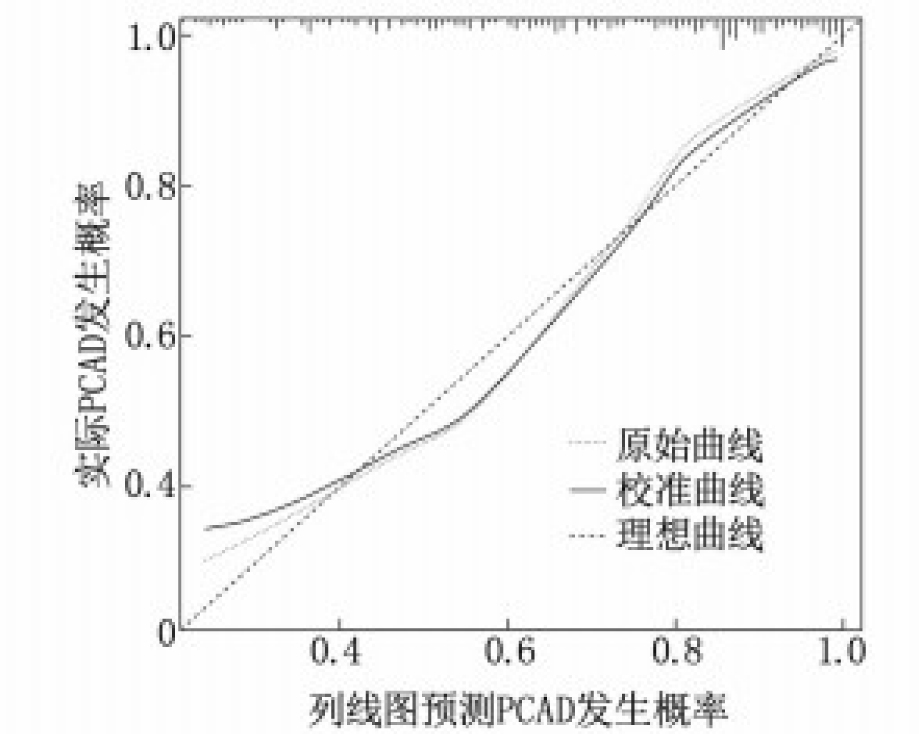
将上述与PCAD显著相关的的5个指标以可视化列线图的形式呈现(图 1)。列线图的C指数为0.815(95%CI: 0.757~0.874), 内部验证时的C指数为0.798, 表明模型区分度良好; 校准曲线表明该模型的一致性较好(图 2)。该列线图预测概率的ROC曲线cut-off值为74.6%, 即预测概率≥74.6%的患者为PCAD高风险患者。列线图预测患者发生PCAD的风险见表 4。
表 4 使用列线图预测年轻患者罹患PCAD风险的示例变量 病例1 病例2 病例3 病例4 分类 得分 分类 得分 分类 得分 分类 得分 是否PCAD 否 否 是 是 性别 女 — 男 — 女 — 男 — LHR < 7.58 0 < 7.58 0 < 7.58 0 ≥7.58 100.00 高血压 有 54.00 无 0 有 54.00 有 54.00 吸烟 无 0 有 82.00 无 0 有 82.00 FPG/(mmol/L) < 6.10 0 < 6.1 0 ≥6.10 70.00 ≥6.1 70.00 BMI/(kg/m2) < 24.00 0 ≥24.00 47.00 ≥24.00 47.00 ≥24.00 47.00 总得分 — 54.00 — 129.00 — 171.00 — 353.00 预测PCAD风险/%* — 38.80 — 70.30 — 82.80 — >90.00 *因预测因素均为分类变量,故此处列线图预测PCAD发生风险概率为近似值。LHR: 白细胞-高密度脂蛋白比值;
FPG: 空腹血糖; BMI: 体质量指数。列线图将Logistic模型中各预测变量的系数转换分值,范围为0~100分。图中线段赋值: LHR≥7.58得分为100分,高血压得分54分,吸烟得分为82分,空腹血糖≥6.1 mmol/L得分为70分, BMI≥24.0 kg/m2得分为47分。各危险因素得分相加为总得分,在线段“PCAD风险”可找到对应的发生PCAD的风险概率。
2.2.2 临床实用性评估
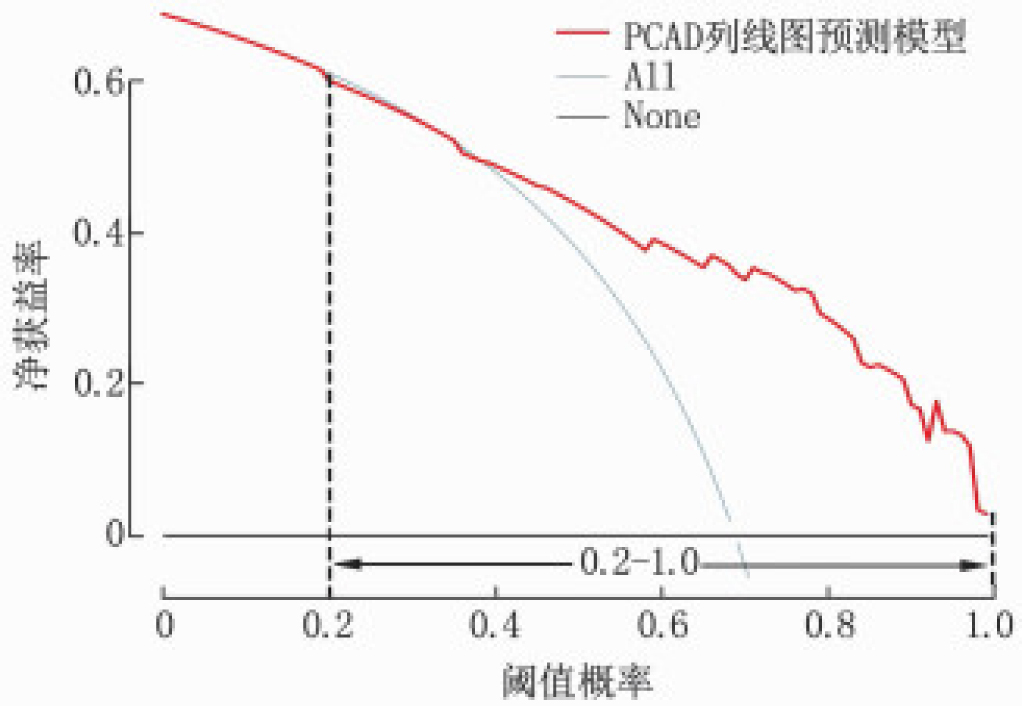
采用A评估列线图模型的实际临床应用价值(图 3)。如图所示,在阈值概率范围为20%~100%时,列线图模型曲线明显高于2条极端曲线,此时净获益率>0, 表示在这个范围内采用列线图预测PCAD的发生风险并采取干预措施,将会比将患者均当做PCAD采取措施或全部按NCAD不采取任何干预措施更加能使患者获益。
3. 讨论
构建列线图是当下最热门的研究方向之一[10], 在医学研究中列线图已被广泛作为预测疾病发生风险的工具。本研究构建了一种个体化预测患者PCAD发生风险的列线图。单因素分析及多因素Logistic回归分析从26项临床特征中筛选出高血压、吸烟、FPG、LHR及超重/肥胖等5项与PCAD显著相关的因素,随后用于构建列线图并进行内部验证。该列线图C指数为0.815(95%CI: 0.757~0.873), 代表模型具有良好区分度,校准图显示模型预测能力与实际情况一致性好; 内部验证也显示出良好的区分度与校准度; DCA曲线表明阈值概率范围为20%~100%时,模型具有很好的临床实用性。这些评价指标表明该列线图可以作为一个相对准确的判断PCAD高风险患者的临床预测工具。
风险因素控制良好的PCAD患者较依从性差的患者拥有更好的预后,提示开发PCAD风险预测工具也许有助于改善患者预后[11]。然而,目前中国用于预测患者PCAD发生风险的列线图工具的相关报道较少。本研究开发的这种预测PCAD的风险工具能有效帮助临床医师早期识别PCAD的高风险患者。准确的PCAD患病风险评估将有助于医师针对性采取干预,一方面将延缓或减少相关心血管不良事件的发生,另一方面可防止对低风险患者进行不必要干预或避免在极有可能产生净获益率的情况下中断或延迟干预措施。
在本研究中,高血压、吸烟、空腹血糖调节受损/糖尿病、超重/肥胖、LHR≥7.58可能是预测PCAD高风险患者的关键因素。本研究结果与既往研究结果[4, 6, 12-15]相似,高血压、吸烟、超重/肥胖等传统CAD危险因素与PCAD的发生存在显著关联。吸烟通过引发血管内皮功能障碍和炎症、血脂异常以及尼古丁氧化应激增加血管内自由基等作用,导致动脉粥样硬化发生[16-17]。LHR是对预测模型影响最大的因素,猜测其机制可能与体内炎症有关。心血管动脉粥样硬化是慢性炎症性疾病,泡沫细胞在动脉粥样硬化过程中发挥着重要作用[18-19]; HDL能清除粥样硬化病变中过量的胆固醇,同时具有保护内皮细胞、抗氧化、抗炎等作用[20]。既往研究[21]发现,单核细胞-高密度脂蛋白比值升高可反映早发冠心病患者体内氧化应激状态。由于白细胞是包含单核细胞在内的多种炎细胞的集合,是反应体内炎症的重要指标。因此,本研究推测涵盖范围更广的LHR一定程度上也能起到类似预测作用。
与既往研究不同,本研究发现空腹血糖调节受损/糖尿病(IFG/DM)才是PCAD的独立相关因素,而非单一的DM状态。众所周知DM是CAD的危险因素,但本研究中PCAD组与NCAD组的DM发生率比较,差异无统计学意义,而IFG/DM的发生率存在显著差异,表明在PCAD人群中存在着更高比例的IFG患者。文献[22]指出, IFG是DM前期的诊断标准之一,随着年龄增长, IFG患者有一定的概率进展为DM。一项对≤45岁的PCAD患者进行了长达21年的随访研究[11]发现,随着年龄增长,部分PCAD患者会新发DM。而另一研究[23]显示,在DM诊断前数年就已经开始了动脉粥样硬化的过程。据此本研究推测,由于PCAD患者较CAD患者更年轻,部分患者尚处于IFG阶段,此时尽管患者未患DM, 但是心血管已经开始了动脉粥样硬化进程,因此本研究结果提示,相较于单一的DM状态,也许IFG/DM更可能成为预测PCAD的关键因素之一。
本研究尚存在一些不足:首先,本研究为回顾性设计,存在信息偏移、选择偏移的可能,同时纳入样本量及收集指标类型有限,这些不足可能降低模型稳健性及可复现性;其次,本研究为单中心研究,尽管内部验证时显示模型具有良好的稳健性,但仍需要使用外部数据进行外部验证,以进一步评估模型的稳健性及外部有效性。若能克服了上述限制且模型的影响评估表现良好,该列线图将可能成为预测年轻人群罹患PCAD风险的可靠工具。
本研究成功开发并内部验证了一个纳入人口学及血生化参数的列线图模型,该列线图能协助医师个体化评估临床疑诊冠心病的年轻患者罹患PCAD的风险,有助于医师对PCAD高风险患者采取必要的干预。但该模型仍需大样本、前瞻性、多中心研究数据加以验证,以进一步评估模型稳健性及外部有效性。
-
表 1 2组基线人口统计学资料比较[n(%)][M(P25, P75)]
一般资料 分类 PCAD组(n=139) NCAD组(n=63) t/Z/χ2 P 年龄/岁 54(50, 58) 53(48, 58) -0.400 0.690 性别 女 58(41.73) 42 (66.67) 男 81(58.27) 21 (33.33) 10.787 0.001 体质量指数 < 24.0 kg/m2 23(16.55) 21 (33.33) ≥24.0 kg/m2 116(83.45) 42 (66.67) 7.170 0.007 高血压 无 63(45.32) 42 (66.67) 有 76(54.68) 21 (33.33) 7.911 0.005 糖尿病 无 107(76.98) 56(88.89) 有 32(23.02) 7(11.11) 3.947 0.047 吸烟 无 88(63.31) 55(87.30) 有 51(36.69) 8(12.70) 12.069 < 0.001 饮酒 无 122(87.77) 58(92.06) 有 17(12.23) 5(7.94) 0.824 0.364 表 2 2组患者血生化指标比较(x±s)[n(%)][M(P25, P75)]
指标 PCAD组(n=139) NCAD组(n=63) t/Z/χ2 P FPG
< 6.1 mmol/L84(60.43) 53(84.13) 11.153 < 0.001 ≥6.1 mmol/L 55(39.57) 10(15.87) TC/(mmol/L) 4.56±0.98 4.72±0.92 1.108 0.269 TG/(mmol/L) 2.17±1.32 1.86±1.28 -1.524 0.129 HDL-C/(mmol/L) 1.04±0.26 1.20±0.33 4.176 < 0.001 LDL-C/(mmol/L) 2.82±0.78 2.90±0.92 0.663 0.508 VLDL-C/(mmol/L) 0.37±0.26 0.41±0.24 -1.180 0.239 sdLDL-C/(mmol/L) 0.96±0.48 0.84±0.43 -1.693 0.092 UA/(μmol/L) 325.00(260.00, 384.00) 294.00(239.00, 347.00) -1.941 0.520 Cr/(μmol/L) 72.00(61.00, 87.00) 70.00(61.00, 81.00) -1.207 0.227 Uera/(mmol/L) 5.18(4.46, 6.28) 4.96(4.05, 5.80) -1.825 0.068 FIB/(g/L) 2.88(2.42, 3.28) 2.70(2.38, 3.25) -1.456 0.145 D-D/(mg/L FEU) 0.21(0.15, 0.36) 0.19(0.15, 0.30) -0.933 0.105 AST/(U/L) 20.00(16.00, 31.00) 19.00(16.00, 24.00) -1.619 0.105 ALT/(U/L) 23.00(16.00, 33.00) 18.00(11.00, 28.00) -2.724 0.006 WBC/(×109/L) 7.74(5.35, 9.49) 6.33(5.37, 7.55) -4.143 < 0.001 AI 2.83±0.95 2.52±0.96 -2.160 0.032 AIP 0.27±0.27 0.13±0.30 3.179 0.002 LHR 7.42(5.87, 9.83) 6.33(5.37, 7.55) -5.302 < 0.001 TyG指数 1.68(1.31, 2.14) 1.39(1.02, 1.73) -3.223 0.001 FPG: 空腹血糖; TC: 总胆固醇; TG: 甘油三酯; HDL-C: 高密度脂蛋白胆固醇; LDL-C: 低密度脂蛋白胆固醇;
VLDL-C: 极低密度脂蛋白胆固醇; sdLDL-C: 小而密低密度脂蛋白胆固醇; UA: 尿酸; Cr: 肌酐; Uera: 尿素氮;
FIB: 纤维蛋白原; D-D: D-二聚体; AST: 天冬氨酸氨基转移酶; ALT: 丙氨酸氨基转移酶; WBC: 白细胞;
AI: 动脉硬化指数; AIP: 血浆致动脉粥样硬化指数; LHR: 白细胞-高密度脂蛋白比值; TyG指数: 三酰甘油-葡萄糖指数。表 3 多因素Logistic回归分析PCAD发生独立相关因素
特征 分类 β SE Wald χ2 OR(95%CI) P 截距 -1.405 0.431 10.620 0.245(—) 0.001 LHR < 7.58 ≥7.58 1.766 0.444 15.836 5.845(2.450~13.947) < 0.001 吸烟 无 有 1.442 0.472 9.339 4.227(1.677~10.655) 0.002 高血压 无 有 0.945 0.366 6.667 2.572(1.256~5.270) 0.010 FPG < 6.1 mmol/L ≥6.1 mmol/L 1.240 0.423 8.608 3.454(1.509~7.907) 0.003 BMI < 24 kg/m2 ≥24 kg/m2 0.823 0.413 3.970 2.277(1.014~5.117) 0.046 LHR: 白细胞-高密度脂蛋白比值; FPG: 空腹血糖; BMI: 体质量指数。 表 4 使用列线图预测年轻患者罹患PCAD风险的示例
变量 病例1 病例2 病例3 病例4 分类 得分 分类 得分 分类 得分 分类 得分 是否PCAD 否 否 是 是 性别 女 — 男 — 女 — 男 — LHR < 7.58 0 < 7.58 0 < 7.58 0 ≥7.58 100.00 高血压 有 54.00 无 0 有 54.00 有 54.00 吸烟 无 0 有 82.00 无 0 有 82.00 FPG/(mmol/L) < 6.10 0 < 6.1 0 ≥6.10 70.00 ≥6.1 70.00 BMI/(kg/m2) < 24.00 0 ≥24.00 47.00 ≥24.00 47.00 ≥24.00 47.00 总得分 — 54.00 — 129.00 — 171.00 — 353.00 预测PCAD风险/%* — 38.80 — 70.30 — 82.80 — >90.00 *因预测因素均为分类变量,故此处列线图预测PCAD发生风险概率为近似值。LHR: 白细胞-高密度脂蛋白比值;
FPG: 空腹血糖; BMI: 体质量指数。 -
[1] BENJAMIN E J, MUNTNER P, ALONSO A, et al. Heart disease and stroke statistics-2019 update: a report from the American heart association[J]. Circulation, 2019, 139(10): e56-e528.
[2] 中国心血管健康与疾病报告编写组. 中国心血管健康与疾病报告2020概要[J]. 中国循环杂志, 2021, 36(6): 521-545. doi: 10.3969/j.issn.1000-3614.2021.06.001 [3] BUCHOLZ E M, RODDAY A M, KOLOR K, et al. Prevalence and predictors of cholesterol screening, awareness, and statin treatment among US adults with familial hypercholesterolemia or other forms of severe dyslipidemia (1999-2014)[J]. Circulation, 2018, 137(21): 2218-2230. doi: 10.1161/CIRCULATIONAHA.117.032321
[4] 苏云娟, 王京京, 韩晓涛, 等. 青年男性冠心病的危险因素及Framingham风险评分的预测价值[J]. 首都医科大学学报, 2022, 43(1): 143-148. doi: 10.3969/j.issn.1006-7795.2022.01.024] [5] SMITH C L, SEIGERMAN M, ADUSUMALLI S, et al. Evolution and outcomes of premature coronary artery disease[J]. Curr Cardiol Rep, 2021, 23(4): 36. doi: 10.1007/s11886-021-01457-8
[6] POORZAND H, TSAROUHAS K, HOZHABROSSADATI S A, et al. Risk factors of premature coronary artery disease in Iran: a systematic review and meta-analysis[J]. Eur J Clin Invest, 2019, 49(7): e13124.
[7] 官莉, 袁耿彪. 核素心肌灌注显像与冠状动脉造影在冠心病疑诊患者危险度评估中的相关性研究[J]. 重庆医学, 2021, 50(15): 2634-2638, 2642. doi: 10.3969/j.issn.1671-8348.2021.15.025 [8] 诸骏仁, 高润霖, 赵水平, 等. 中国成人血脂异常防治指南(2016年修订版)[J]. 中国循环杂志, 2016, 31(10): 937-953. doi: 10.3969/j.issn.1000-3614.2016.10.001 [9] 中国高血压防治指南修订委员会, 高血压联盟(中国, 中华医学会心血管病学分会中国医师协会高血压专业委员会, 等. 中国高血压防治指南(2018年修订版)[J]. 中国心血管杂志, 2019, 24(1): 24-56. doi: 10.3969/j.issn.1007-5410.2019.01.002 [10] ZHOU Z R, WANG W W, LI Y, et al. In-depth mining of clinical data: the construction of clinical prediction model with R[J]. Ann Transl Med, 2019, 7(23): 796. doi: 10.21037/atm.2019.08.63
[11] COLLET J P, ZEITOUNI M, PROCOPI N, et al. Long-term evolution of premature coronary artery disease[J]. J Am Coll Cardiol, 2019, 74(15): 1868-1878. doi: 10.1016/j.jacc.2019.08.1002
[12] 张正伟, 刘瑾春, 王智彬, 等. 趋化因子CCL21与早发冠心病的相关性研究[J]. 中国心血管杂志, 2022, 27(3): 247-251. https://www.cnki.com.cn/Article/CJFDTOTAL-XIXG202203009.htm [13] SAWADA H, ANDO H, TAKASHIMA H, et al. Epidemiological features and clinical presentations of acute coronary syndrome in young patients[J]. Intern Med, 2020, 59(9): 1125-1131. doi: 10.2169/internalmedicine.4138-19
[14] ARORA S, STOUFFER G A, KUCHARSKA-NEWTON A M, et al. Twenty year trends and sex differences in young adults hospitalized with acute myocardial infarction[J]. Circulation, 2019, 139(8): 1047-1056. doi: 10.1161/CIRCULATIONAHA.118.037137
[15] 李琪, 黄剑. 育龄期女性急性心肌梗死的危险因素及冠状动脉病变分析[J]. 实用临床医药杂志, 2022, 26(3): 72-75. doi: 10.7619/jcmp.20213785 [16] KUMAGAI S, AMANO T, TAKASHIMA H, et al. Impact of cigarette smoking on coronary plaque composition[J]. Coron Artery Dis, 2015, 26(1): 60-65. doi: 10.1097/MCA.0000000000000168
[17] SCHOENENBERGER A W, RADOVANOVIC D, STAUFFER J C, et al. Acute coronary syndromes in young patients: presentation, treatment and outcome[J]. Int J Cardiol, 2011, 148(3): 300-304. doi: 10.1016/j.ijcard.2009.11.009
[18] CHOI H Y, HAFIANE A, SCHWERTANI A, et al. High-density lipoproteins: biology, epidemiology, and clinical management[J]. Can J Cardiol, 2017, 33(3): 325-333. doi: 10.1016/j.cjca.2016.09.012
[19] 刘艾婷, 彭旷, 欧蕾宇, 等. 补体系统在动脉粥样硬化中的作用研究进展[J]. 中国动脉硬化杂志, 2021, 29(4): 363-368. doi: 10.3969/j.issn.1007-3949.2021.04.017 [20] 高秀鑫, 丁振江, 王文丰, 等. 三酰甘油/高密度脂蛋白胆固醇比值与冠心病的患病风险[J]. 临床心血管病杂志, 2019, 35(12): 1085-1088. https://www.cnki.com.cn/Article/CJFDTOTAL-LCXB201912006.htm [21] 徐慧, 刘芳. 单核细胞计数/高密度脂蛋白胆固醇比值与早发冠心病的相关性分析[J]. 临床心血管病杂志, 2020, 36(8): 709-713. https://www.cnki.com.cn/Article/CJFDTOTAL-LCXB202008007.htm [22] CHAWLA R, MADHU S V, MAKKAR B M, et al. RSSDI-ESI clinical practice recommendations for the management of type 2 diabetes mellitus 2020[J]. Indian J Endocrinol Metab, 2020, 24(1): 1-122. doi: 10.4103/ijem.IJEM_225_20
[23] POZNYAK A, GRECHKO A V, POGGIO P, et al. The diabetes mellitus-atherosclerosis connection: the role of lipid and glucose metabolism and chronic inflammation[J]. Int J Mol Sci, 2020, 21(5): 1835.
-
期刊类型引用(3)
1. 张晏铭,于高修,王聪,陈峰. 早发冠心病发病机制与预防的研究进展. 中国临床医学. 2024(03): 491-498 .  百度学术
百度学术
2. 迟晨汝,陈梦奇,杨丹,刘欢,周志庆. 老年慢性病住院患者营养不良的风险预测模型构建. 赣南医学院学报. 2024(07): 678-683 .  百度学术
百度学术
3. 邢来敬,刘艳存,王宇,杨巧芳. 慢性心力衰竭患者合并肾功能不全的2种列线图风险预测模型比较研究. 实用临床医药杂志. 2023(10): 91-96+101 .  本站查看
本站查看
其他类型引用(1)




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号
