Methylation status of Septin 9 in peripheral blood and its relationship with colorectal cancer
-
摘要:目的
检测结直肠癌(CRC)患者外周血胞裂蛋白9(Septin 9)的甲基化状态, 分析Septin 9甲基化与CRC的关系。
方法选取120例CRC患者为研究对象,分析其外周血Septin 9甲基化状态与临床资料的关系; 分离CRC患者和健康人群的血清外泌体,采用该外泌体处理CRC细胞,测定CRC细胞的增殖和凋亡情况。
结果共计1586例体检人群接受了Septin 9筛查,其中Seprtin 9甲基化阳性56例,阳性率为3.5%。Sepetin 9阳性者中,胃肠状态异常者(肠胃炎症或者息肉)20例(35.7%), 而Septin 9阴性者胃肠状态异常率仅为5.4%(83/1530), 提示Septin 9在外周血中的甲基化状态与胃肠状态密切相关。120例CRC患者中, Septin 9甲基化阳性率为78.4%(73/93);在不同分化程度的比较中,高分化、中分化、低分化CRC患者的Septin 9甲基化阳性率依次为52.6%(10/19)、79.7%(59/74)、88.9%(24/27), 低分化CRC患者外周血Septin 9甲基化阳性率高于高分化组,差异有统计学意义(P=0.006)。外周血Septin 9甲基化的灵敏度为72.3%, 特异度为92.5%。Western blot结果显示CRC患者外泌体中Septin 9表达较健康人群降低,外泌体中Septin 9甲基化水平较正常人群上升,差异均有统计学意义(P=0.009、0.003)。本研究结果显示, CRC患者血清外泌体可促进细胞增殖,对细胞凋亡有抑制作用,差异有统计学意义(P < 0.05或P < 0.01)。
结论Septin 9可作为CRC早期筛查的标志物, CRC患者血清外泌体诱导的CRC增殖、凋亡抵抗可能是Septin 9的作用机制。
Abstract:ObjectiveTo detect the methylation status of Septin 9 in the peripheral blood of patients with colorectal cancer (CRC) and analyze the relationship between the methylation of Septin 9 and CRC.
MethodsA total of 120 patients with CRC were selected as research objects, and the relationship between the methylation status of Septin 9 in the peripheral blood and the medical materials was analyzed; the serum exosomes isolated from patients with CRC and healthy people were used to treat the CRC cells, and the proliferation and apoptosis of CRC cells were detected.
ResultsA total of 1 586 people with health examinations were screened for Septin 9, and 56 of whom were positive for methylation of Septin 9, with a positive rate of 3.5%. Among patients with Septin 9 positive, there were 20 cases (35.7%) with abnormal gastrointestinal status (gastrointestinal inflammation or polyps), while only 5.4% (83/1 530) of patients with Septin 9 negative had abnormal gastrointestinal status, which indicated that the methylation status of Septin 9 in the peripheral blood was closely related to the gastrointestinal status. Among 120 CRC patients, the positive rate of methylation of Septin 9 was 78.4% (73/93); in the comparison of different differentiation degrees, the positive rates of Septin 9 methylation in patients with highly differentiated, moderately differentiated and poorly differentiated CRC were 52.6% (10/19), 79.7% (59/74) and 88.9% (24/27) respectively, and the positive rate of Septin 9 methylation in peripheral blood of patients with poorly differentiated CRC was significantly higher than that of patients with highly differentiated CRC (P=0.006). The sensitivity and specificity of Septin 9 methylation in the peripheral blood were 72.3% and 92.5% respectively. Western blot results showed that the expression of Septin 9 in the exosomes of CRC patients was significantly lower than that in the normal people, while the methylation level of Septin 9 in the exosomes was significantly higher than that in the healthy people (P=0.009, 0.003). The results of this study showed that serum exosomes of CRC patients could significantly promote cell proliferation and inhibit cell apoptosis (P < 0.05 or P < 0.01).
ConclusionSeptin 9 can be used as a marker for early screening of CRC, and the mechanism of Septin 9 may be the proliferation and apoptosis resistance of CRC induced by serum exosomes in patients with CRC.
-
Keywords:
- colorectal cancer /
- Septin 9 /
- exosomes /
- carcinoembryonic antigen /
- carbohydrate antigen 199 /
- diagnosis
-
结直肠癌(CRC)是较为常见的恶性肿瘤之一,患者5年生存率仅为47.2%[1]。CRC的预后与早期诊治密切相关,早期诊治的CRC患者的5年生存率可高达90%, 而晚期诊治的CRC患者的5年生存率不足10%[2]。研究[3-4]显示外周血Septin 9甲基化状态在CRC发生的极早期就会发生变化,或可作为CRC早期筛查的分子标志物。本研究检测了120例CRC患者外周血中Septin 9甲基化状态,分析外周血中Septin 9甲基化与CRC的关系,现将结果报告如下。
1. 资料与方法
1.1 一般资料
分析2017年1月—2019年12月在西南医院体检中心体检并接受Septin 9筛查的人群1 586例。另选取2017年1月—2018年12月120例CRC者,其中男84例,女36例,平均年龄(57.1±12.2)岁,均采集样本并进行Septin 9甲基化、癌胚抗原(CEA)和糖链抗原199(CA199)检测。纳入标准: ①接受结肠镜检查的患者; ②年龄>18岁者。排除标准: ①既往有恶性肿瘤病史的患者; ②曾接受放化疗的患者; ③既往有腹部手术史的患者; ④妊娠期女性。
1.2 Septin 9甲基化状态、CEA及CA199检测
采集受试者外周静脉血10 mL置于EDTA抗凝真空采血管中, 1 500转/min离心15 min, 分离血清和血浆,保存于-80 ℃环境中并在4周内完成检测。Septin 9甲基化检查过程参照大肠癌甲基化基因检测试剂盒(PCR荧光探针法)说明书,采用伯乐实时荧光定量PCR仪完成检测,血清CEA、CA199采用电化学发光法检测,均由本院检验科完成。
1.3 外泌体分离
将血清置于无菌操作台中融化,按1∶ 1体积加入外泌体沉淀试剂盒(赛默飞),置于翻转摇床上4 ℃孵育过夜,次日以12 000 g离心60 min, 收集白色沉淀,采用100 μL无菌PBS溶解,测定蛋白浓度并将外泌体稀释到1 mg/mL待用。
1.4 体外实验
1.4.1 细胞培养
Saos2细胞培养于由90%的DMEM培养基、10%FBS及1%双抗组成的培养基中。待细胞融合度达到约90%时,采用胰酶消化细胞,并进行传代。
1.4.2 免疫蛋白印迹(Western blot)
外泌体采用RIPA裂解液于冰上进行提取,采用BCA试剂盒测定蛋白浓度后,按照50 μg的剂量将蛋白样品加到10%的SDS-page中进行电泳; 电泳后进行转膜,而后将膜用5%的脱脂牛奶进行封闭室温孵育1 h, 一抗工作液4 ℃孵育过夜,洗膜后孵育相应的二抗工作,然后采用化学发光试剂盒检测杂交信号。
1.4.3 CCK-8法检测细胞增殖
消化细胞并进行细胞计数,而后按照5 000个/孔的密度将细胞种植于96孔板中,待细胞贴牢后(6 h), 换为含有20 μg/mL外泌体的培养基(对照组为含有相应体积PBS的培养基),置于37 ℃培养箱中继续培养。分别在处理后24、48、72 h向培养基中加入10 μL CCK-8溶液,将其置于37 ℃培养箱中继续培养90 min, 而后采用酶标仪检测450 nm处的吸光度。
1.4.4 流式细胞术检测细胞凋亡
外泌体处理细胞48 h后,采用0.25%胰酶消化细胞,血清中止,收集细胞, PBS重悬后按照Annexin V-FITC/PI试剂盒相关说明进行Annein V和PI染色,然后上机检测,随后应用FlowJo7.6进行数据分析。
1.5 统计学分析
采用SPSS 24.0进行统计分析,组间比较采用t检验,组间率的比较采用χ2检验,总样本不同诊断方式采用受试者工作特征(ROC)曲线分析, P < 0.05为差异有统计学意义。
2. 结果
2.1 1 586例体检者的Septin 9阳性率
共计1 586例体检者接受了Septin 9筛查,其中男1 023例,女563例; Seprtin 9甲基化阳性56例,阳性率为3.5%; 56例Septin 9阳性者中癌前病变1例,而Septin 9阴性者中未见癌变或癌前病变。Sepetin 9阳性者中,胃肠状态异常者(肠胃炎症或者息肉等)20例(35.7%), 而Septin 9阴性者胃肠状态异常率仅为5.4%(83/1 530), 提示Septin 9在外周血中的甲基化状态与受试者胃肠状态密切相关,可能与癌前病变相关。见表 1。
表 1 1 586例正常人群Septin 9甲基化与胃肠状态的相关性指标 分类 Septin 9甲基化状态 阳性(n=56) 阴性(n=1 530) 性别 男 43 982 女 13 548 胃肠状态 正常 36 1 447 异常 20 83 2.2 120例CRC患者外周血Septin 9甲基化状态监测结果
120例CRC患者中, Septin 9甲基化阳性者93例,平均年龄(59.1±12.8)岁; Septin 9甲基化阴性者27例,平均年龄(53.1±10.2)岁; CRC在年龄较高人群中更易感,但与性别无关。120例CRC患者中, Septin 9甲基化阳性率为78.4%(73/93); 在不同性别、不同年龄的比较中, CRC患者外周血Septin 9甲基化阳性率的差异无统计学意义(P=0.635、0.149); 在不同分化程度的比较中,高分化、中分化、低分化CRC患者的Septin 9甲基化阳性率依次为52.6%(10/19)、79.7%(59/74)、88.9%(24/27), 低分化CRC患者外周血Septin 9甲基化阳性率高于高分化组,差异有统计学意义(P=0.006)。见表 2。
表 2 CRC患者Septin 9检测情况[n(%)]指标 分类 Septin 9阳性(n=93) Septin 9阴性(n=27) 性别 男 67(79.8) 17(20.2) 女 26(72.2) 10(27.8) 年龄 ≤60岁 51(71.8) 20(28.2) >60岁 42(85.7) 7(14.3) 分化程度 高分化 10(52.6)** 9(47.4) 中分化 59(79.7) 15(20.3) 低分化 24(88.9) 3(11.1) 低分化比较, ** P < 0.01。 2.3 CRC患者外周血Septin 9甲基化以及CEA、CA199蛋白检测结果
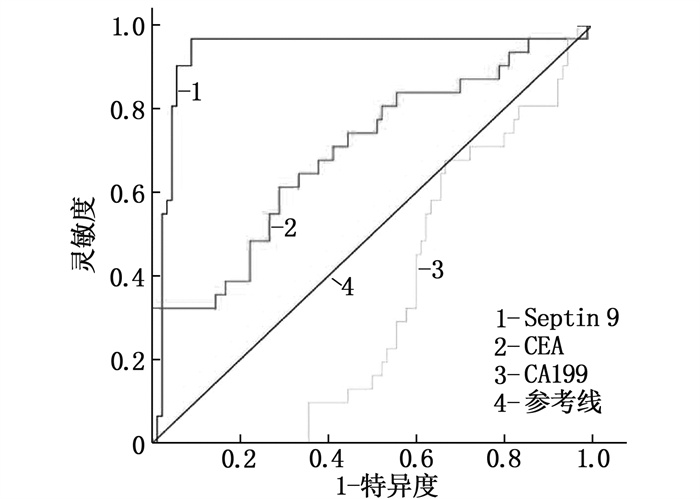
本研究结果显示,与CA199、CEA相比,外周血Septin 9甲基化的灵敏度为72.3%, 特异度为92.5%, 均优于CEA和CA199的灵敏度和特异度,见表 3、图 1。
表 3 CRC患者Septin 9、CEA、CA199的灵敏度和特异度比较指标 灵敏度(95%CI) 特异度(95%CI) 曲线下面积 Septin 9 72.3(60.5~80.5) 92.5(75.5~95.5) 0.87 CEA 42.2(32.2~55.6) 75.0(65.5~87.5) 0.59 CA199 20.5(12.1~27.1) 45.0(37.7~55.5) 0.24 2.4 血清外泌体中Septin 9的表达及甲基化状态
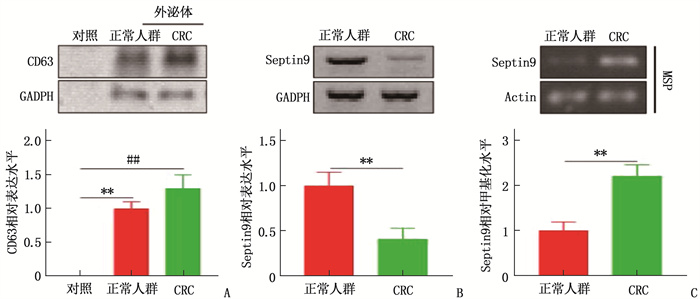
本研究分别提取了正常健康人群和CRC患者外周血的血清外泌体,并以外泌体标志物CD63进行鉴定。结果显示,提取的样本中存在大量外泌体, Western blot结果显示CRC患者外泌体中Septin 9表达较正常人群降低,外泌体中Septin 9甲基化水平也较正常人群上升,差异均有统计学意义(P=0.009、0.003)。见图 2。
2.5 CRC患者血清外泌体对CRC细胞Saos2增殖、凋亡的影响
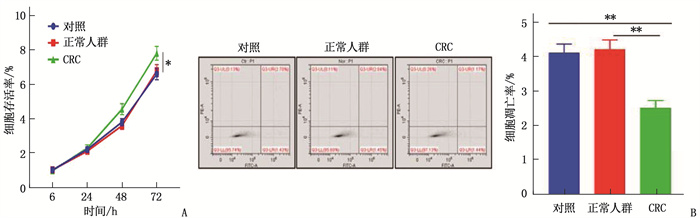
本研究将提取的外泌体以20 μg/mL的水平来处理CRC细胞系Saos2, 测定细胞增殖和凋亡情况。结果显示, CRC患者血清外泌体可促进细胞增殖,对细胞凋亡有抑制作用,差异有统计学意义(P < 0.05或P < 0.01),表明CRC患者血清外泌体与CRC细胞增殖和凋亡密切相关。见图 3。
3. 讨论
目前, CRC的早期诊断主要借助侵入式的结肠镜,但患者的依从性较低[5]; 粪便潜血检测有助于筛选高危人群,但易出现假阳性或假阴性,需要反复送检,导致患者依从性也较低。Septin 9是一个高度保守的GTP结合蛋白,广泛存在于人类细胞中,其基因位于长染色体17q25.3, 研究[6]显示Septin 9甲基化在CRC及部分癌前病变患者外周血中有较高的检出率。
Septin 9甲基化可出现在各期CRC中,阳性率不受患者性别、年龄、病变部位的影响; CRC患者的外周血Septin 9甲基化水平与癌症分期呈正相关,即Ⅳ期患者外周血Septin 9甲基化水平显著高于Ⅰ~Ⅲ期,但Septin 9甲基化阳性率与肿瘤分化程度无关[7]。YANG J K等[8]及陈培等[9]认为,不同病理分期CRC患者的Septin 9甲基化阳性率差异无统计学意义(P>0.05), 而本研究发现CRC患者外周血Septin 9甲基化与疾病分化程度相关,外周血Septin 9甲基化检测的灵敏度及特异度均优于传统肿瘤标志物CEA及CA199。本研究认为对外周血中Septin 9甲基化的检测要考虑受试人群存在人种差异,亚洲人群外周血Septin 9甲基化或可是更好的CRC早期筛查标志物。
外泌体是细胞分泌的一种具有磷脂双分子层的微小囊泡,其直径多在30~200 nm[10], 并广泛分布于人体内,可以传递包括蛋白、RNA和DNA等多种物质。外泌体被用于多种疾病的诊断[11], 在CRC中也有作为分子标志物的报道[12]。本研究证实外周血中Septin 9甲基化状态可作为CRC的分子标志。外泌体的内容物是经过母体细胞精密调节、高度选择的结果,携带其来源母体细胞的特性[13]。外泌体能将各种细胞因子、转录因子、蛋白质和染色质传递给间质细胞、内皮细胞、炎症细胞和免疫细胞等受体细胞,在肿瘤微环境调节、肿瘤细胞与正常细胞及肿瘤细胞间信息传递中发挥重要作用[14-16]。本研究结果表明, CRC患者血清外泌体中Septin 9表达降低,甲基化水平升高, CRC患者血清外泌体能显著促进Saos2细胞增殖。
综上所述, Septin 9可作为CRC早期筛查的标志物, CRC患者血清外泌体诱导的CRC增殖、凋亡抵抗可能是Septin 9的作用机制。
-
表 1 1 586例正常人群Septin 9甲基化与胃肠状态的相关性
指标 分类 Septin 9甲基化状态 阳性(n=56) 阴性(n=1 530) 性别 男 43 982 女 13 548 胃肠状态 正常 36 1 447 异常 20 83 表 2 CRC患者Septin 9检测情况[n(%)]
指标 分类 Septin 9阳性(n=93) Septin 9阴性(n=27) 性别 男 67(79.8) 17(20.2) 女 26(72.2) 10(27.8) 年龄 ≤60岁 51(71.8) 20(28.2) >60岁 42(85.7) 7(14.3) 分化程度 高分化 10(52.6)** 9(47.4) 中分化 59(79.7) 15(20.3) 低分化 24(88.9) 3(11.1) 低分化比较, ** P < 0.01。 表 3 CRC患者Septin 9、CEA、CA199的灵敏度和特异度比较
指标 灵敏度(95%CI) 特异度(95%CI) 曲线下面积 Septin 9 72.3(60.5~80.5) 92.5(75.5~95.5) 0.87 CEA 42.2(32.2~55.6) 75.0(65.5~87.5) 0.59 CA199 20.5(12.1~27.1) 45.0(37.7~55.5) 0.24 -
[1] ZENG H M, ZHENG R S, GUO Y M, et al. Cancer survival in China, 2003-2005: a population-based study[J]. Int J Cancer, 2015, 136(8): 1921-1930. doi: 10.1002/ijc.29227
[2] KANG Q, JIN P, YANG L, et al. Significance of Septin 9 gene methylation detection of plasma circulation DNA in colorectal cancer screening[J]. Zhonghua Yi Xue Za Zhi, 2014, 94(48): 3839-3841. .
[3] SUN G P, MENG J, DUAN H, et al. Diagnostic ssessment of Septin 9 DNA methylation for colorectal cancer using blood detection: a meta-analysis[J]. Pathol Oncol Res, 2019, 25(4): 1525-1534. doi: 10.1007/s12253-018-0559-5
[4] LIU T, ZHANG X, DU L T, et al. Exosome transmitted miR-l 28-3p increase chemosensitivity of oxaliplatin-resistant coloretal cancer[J]. Mol Cancer, 2019, 18(1): 43. doi: 10.1186/s12943-019-0981-7
[5] 谭琪, 宗明, 處珊珊, 等. 联合检测外周血游离Septin 9、SDC2、BCATI基因甲基化在结直肠癌诊断中的意义[J]. 中华检验医学杂志, 2021, 44(3): 204-211. https://www.cnki.com.cn/Article/CJFDTOTAL-ZMXZ201605028.htm [6] YANQING H, CHENG D, LING X. Serum CA72-4 as a bionarker in the diagnosis of colorectal cancer: a meta-analysis[J]. Open Med: Wars, 2018, 13: 164-171. doi: 10.1515/med-2018-0026
[7] 宋慧琴, 张君娜. Septin 9基因、缺氧诱导因子1与结直肠癌发生发展的相关性[J]. 广州医科大学学报, 2021, 49(1): 14-17. doi: 10.3969/j.issn.2095-9664.2021.01.04 [8] YANG J K, YANG J P, TONG J, et al. Exosomal miR-221 targets DNM3 to induce tumor progression and temozolomide re sistance in glioma[J]. J Neurooncol, 2017, 131(2): 255-265. doi: 10.1007/s11060-016-2308-5
[9] 陈培, 邓钦木, 李丹丹. 血浆Septin 9甲基化检测在结直肠癌中的诊断价值[J]. 现代检验医学杂志, 2020, 35(4): 10-13. doi: 10.3969/j.issn.1671-7414.2020.04.003 [10] 宫媛, 王卫华, 杜海涛, 等. 外周血Septin 9基因甲基化检测在结直肠癌诊断中的研究进展[J]. 临床输血与检验, 2021, 23(2): 263-268. doi: 10.3969/j.issn.1671-2587.2021.02.028 [11] 张春燕, 于正麟, 王蓓丽, 等. 血浆Septin 9基因甲基化检测性能评价及对结直肠癌患者的筛查价值[J]. 临床检验杂志, 2019, 37(2): 152-155. https://www.cnki.com.cn/Article/CJFDTOTAL-LCJY201902018.htm [12] YAN S S, HAN B, GAO S Y, et al. Exsome-encapsulated micro RNAs as circulating biomarkers for colorectal cancer[J] Oncotarget, 2017, 8(36): 60149-60158. . doi: 10.18632/oncotarget.18557
[13] 陈越亚, 陈卫昌. 外周血SEPT9基因甲基化检测在结直肠癌中的研究进展[J]. 中国血液流变学杂志, 2021, 31(2): 265-270. doi: 10.3969/j.issn.1009-881X.2021.02.031 [14] 穆剑强, 高海锋. 外周血Septin9基因甲基化和血清CA199联合检测在结直肠癌筛查中的诊断价值[J]. 检验医学与临床, 2022, 19(4): 526-529. https://www.cnki.com.cn/Article/CJFDTOTAL-JYYL202204023.htm [15] RICHARDS K E, ZELENIAK A E, FISHEL M L, et al. Cancer-associated fibroblast exosomes regulate survival and proliferation of pancreatic cancer cells[J]. Oncogene, 2017, 36(13): 1770-1778.
[16] 赵媛, 陈四明, 蒋益兰, 等. Septin-9基因甲基化检测对结直肠癌诊断价值的meta分析[J]. 中国医师杂志, 2020, 22(6): 852-856. doi: 10.3760/cma.j.cn431274-20200222-00172




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号