Effect of long non-coding RNA SLCO4A1-AS1 targeting microRNA-615-5p on the proliferation, apoptosis and inflammatory factors expression in esophageal cancer cells
-
摘要:目的
探讨长链非编码RNA(LncRNA)溶质载体有机阴离子转运蛋白家族成员4A1反义RNA1(SLCO4A1-AS1) 靶向微小RNA-615-5p(miR-615-5p)对食管癌细胞增殖、凋亡和炎症因子表达的影响。
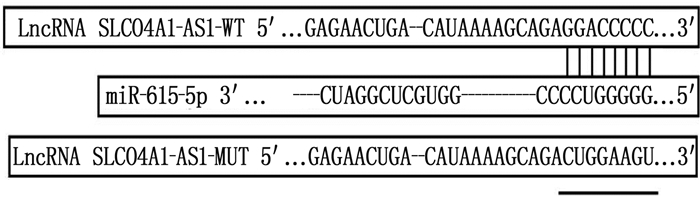
方法运用实时荧光定量聚合酶链式反应(RT-qPCR)分析LncRNA SLCO4A1-AS1和miR-615-5p在食管癌组织、细胞系中表达情况。将si-NC、si-LncRNA SLCO4A1-AS1、miR-NC、miR-615-5p模拟物、pcDNA、pcDNA-LncRNA SLCO4A1-AS1、si-LncRNA SLCO4A1-AS1+anti-miR-NC、si-LncRNA SLCO4A1-AS1+anti-miR-615-5p分别转染Eca109细胞。CCK-8和流式细胞术用于检测细胞活力和凋亡率; 平板克隆实验用于检测细胞增殖; 酶联免疫吸附法(ELISA)试剂盒检测培养液中白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)水平。采用双荧光素酶报告基因法确定LncRNA SLCO4A1-AS1与miR-615-5p的关系。
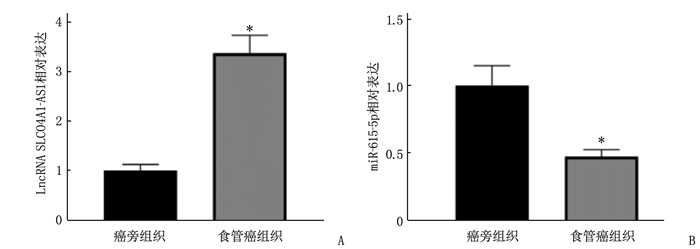
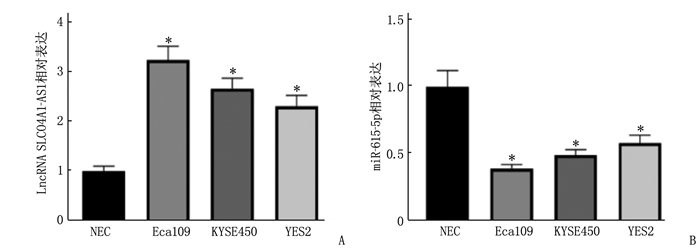
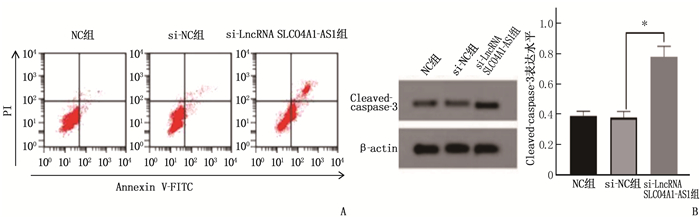
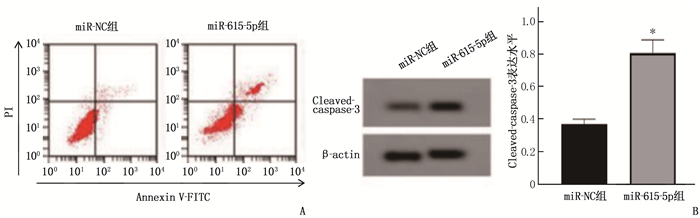
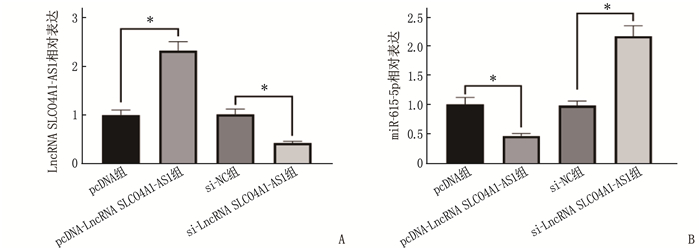
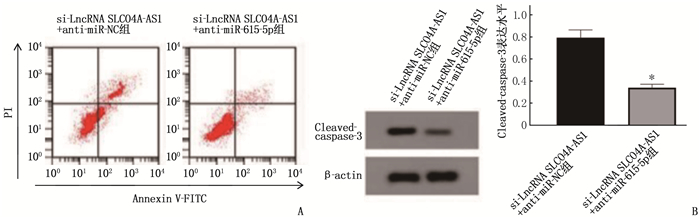
结果食管癌组织、细胞系中LncRNA SLCO4A1-AS1表达上调, miR-615-5p表达下调。抑制LncRNA SLCO4A1-AS1表达后,细胞活力、细胞克隆形成数量以及培养液中IL-6和TNF-α水平降低, miR-615-5p表达量、细胞凋亡率升高,差异有统计学意义(P<0.05)。与miR-NC组比较, miR-615-5p组Eca109细胞中miR-615-5p表达量、Cleaved-caspase-3蛋白水平、凋亡率升高,细胞活力、细胞克隆形成数量、培养液中IL-6和TNF-α水平降低,差异有统计学意义(P<0.05)。与si-LncRNA SLCO4A1-AS1+anti-miR-NC比较, si-LncRNA SLCO4A1-AS1+anti-miR-615-5p组Eca109细胞中miR-615-5p表达量、Cleaved-caspase-3蛋白水平、凋亡率降低,细胞活力、细胞克隆形成数量、培养液中IL-6和TNF-α水平升高,差异有统计学意义(P<0.05)。
结论LncRNA SLCO4A1-AS1能够促进食管癌的发生和发展。抑制LncRNA SLCO4A1-AS1能够减少食管癌细胞的增殖,降低炎症因子的表达,诱导癌细胞凋亡。
-
关键词:
- 食管癌 /
- 长链非编码RNA SLCO4A1-AS1 /
- 微小RNA-615-5p /
- 增殖 /
- 炎症 /
- 凋亡
Abstract:ObjectiveTo investigate the effects of long non-coding RNA (LncRNA) solute carrier organic anion transporter family member 4A1 (SLCO4A1-AS1) targeting microRNA-615-5p (miR-615-5p) in esophageal cancer cells on cell proliferation, apoptosis, and expression of inflammatory factors.
MethodsReal-time quantitative polymerase chain reaction (RT-qPCR) was used to analyze the expression of LncRNA SLCO4A1-AS1 and miR-615-5p in esophageal cancer tissues and cell lines. Eca109 cells were transfected with si-NC, si-LncRNA SLCO4A1-AS1, miR-NC, miR-615-5p mimic, pcDNA, pcDNA-LncRNA SLCO4A1-AS1, si-LncRNA SLCO4A1-AS1+anti-miR-NC, and si-LncRNA SLCO4A1-AS1+anti-miR-615-5p. Cell viability and apoptosis rate were measured by CCK-8 and flow cytometry, respectively; cell proliferation was determined by plate cloning assay; and levels of interleukin-6 (IL-6) and tumor necrosis factor-alpha (TNF-α) in the culture medium were measured using an enzyme-linked immunosorbent assay (ELISA) kit. A dual luciferase reporter gene assay was used to determine the relationship between LncRNA SLCO4A1-AS1 and miR-615-5p.
ResultsExpression of LncRNA SLCO4A1-AS1 was upregulated, and miR-615-5p expression was downregulated in esophageal cancer tissues and cell lines. After inhibiting LncRNA SLCO4A1-AS1 expression, cell viability, the number of cell clones, and levels of IL-6 and TNF-α in the culture medium decreased, while miR-615-5p expression and apoptosis rate increased (P < 0.05). Compared with the miR-NC group, the miR-615-5p group showed increased miR-615-5p expression, levels of Cleaved-caspase-3 protein, and apoptosis rate, and decreased cell viability, the number of cell clones, and levels of IL-6 and TNF-α in the culture medium (P < 0.05). Compared with the si-LncRNA SLCO4A1-AS1+anti-miR-NC group, the si-LncRNA SLCO4A1-AS1+anti-miR-615-5p group showed decreased miR-615-5p expression, levels of Cleaved-caspase-3 protein, and apoptosis rate, and increased cell viability, the number of cell clones, and levels of IL-6 and TNF-α in the culture medium (P < 0.05).
ConclusionLncRNA SLCO4A1-AS1 can promote the occurrence and development of esophageal cancer. Inhibiting LncRNA SLCO4A1-AS1 can reduce the proliferation of esophageal cancer cells, decrease the expression of inflammatory factors, and induce apoptosis.
-
Keywords:
- esophageal cancer /
- long non-coding RNA SLCO4A1-AS1 /
- microRNA-615-5p /
- proliferation /
- inflammation /
- apoptosis
-
宫颈癌是妇科常见恶性肿瘤,由人类乳头瘤病毒感染所致,近年来发病逐渐年轻化[1]。宫颈癌患者早期常无明显症状,随着病情进展,确诊时往往已发展至中晚期,可出现感染、尿频、尿痛、便秘、脓性白带、下肢肿痛等继发性改变。宫颈癌主要转移方式为直接蔓延或淋巴转移,仅靠手术治疗不能完全抑制肿瘤,常需联合化疗、放疗等手段进行治疗。逆向调强放疗(IMRT)常被用于治疗宫颈癌,晚期宫颈癌患者放疗后生存率可显著提高,但放疗也会对宫颈相邻正常器官造成一定损伤,从而影响患者的生活质量[2]。自适应调强放疗(ART)可改善局部晚期宫颈癌患者的临床治疗效果,目前已在临床广泛应用。本研究观察了ART治疗局部晚期宫颈癌的临床效果,现报告如下。
1. 资料与方法
1.1 一般资料
选取河南省永城市人民医院妇科2015年1月—2018年7月收治的85例局部晚期宫颈癌患者作为研究对象,采用随机数字表法分为对照组42例和观察组43例。对照组患者年龄27~49岁,平均(38.75±2.38)岁; 病程1~4年,平均(2.76±0.76)年; 病理类型为鳞癌38例,腺癌4例; 接触性阴道出血35例,无接触性阴道出血7例。观察组患者年龄28~50岁,平均(39.45±2.41)岁; 病程1~4年,平均(2.59±0.34)年; 病理类型为鳞癌37例,腺癌6例; 接触性阴道出血37例,无接触性阴道出血6例。2组患者一般资料比较,差异无统计学意义(P>0.05), 具有可比性。纳入标准: ①符合《中国常见恶性肿瘤诊疗规范》[3]中宫颈癌相关诊断标准者; ②经病理检查证实宫颈癌晚期者; ③患者及家属对本研究知情同意。排除标准: ①存在其他恶性肿瘤者; ②伴有心、肝、肺、脑等疾病者; ③入院前接受过其他宫颈癌治疗者。
1.2 方法
2组患者均常规采用顺铂(齐鲁制药有限公司,国药准字H20033936)为主的化疗药物进行治疗,顺铂剂量75 mg/m2, 4次/周,共治疗8周。①对照组在化疗基础上联合采用逆向IMRT治疗: 患者治疗前先排空直肠,然后饮入足量水保持膀胱充盈后取仰卧位,计算机断层扫描(CT)、磁共振成像(MRI)扫描范围为胸10椎体上缘至阴道外口下10 cm, 照射4次/周,治疗8周。②观察组在化疗基础上联合采用ART治疗: 患者照射前先排空直肠,并饮入足量水保持膀胱充盈,照射12次后重新扫描评价计划靶区,照射4次/周,治疗8周。
1.3 观察指标
① 临床疗效: 依照世界卫生组织(WHO)制定的疗效标准[4]于治疗前后对患者的病灶情况进行评价。治愈,病灶完全消失; 有效,病灶减小50%及以上; 无效,病灶未减小。总有效率=(治愈+有效)/总例数×100%。②危及器官剂量学指标水平:放疗后,比较2组患者治疗1 d末和治疗8周末身体其他器官(直肠、小肠、膀胱)的受损情况,指标水平越高表示受损越严重。③不良反应发生情况: 比较2组患者治疗期间不良反应发生情况,包括白细胞减少、血小板减少、恶心呕吐、肝功能异常、肾功能异常等。
1.4 统计学分析
采用SPSS 22.0统计学软件分析数据,计量资料采用(x±s)表示,比较行t检验,计数资料采用[n(%)]表示,比较行χ2检验,以P<0.05为差异有统计学意义。
2. 结果
2.1 临床疗效
治疗后,观察组治疗总有效率高于对照组,差异有统计学意义(P<0.05), 见表 1。
表 1 2组患者临床疗效比较[n(%)]组别 n 治愈 有效 无效 总有效 对照组 42 14(33.33) 17(40.48) 11(26.19) 31(73.81) 观察组 43 19(44.19) 21(48.84) 3(6.98) 40(93.02)* 与对照组比较, * P<0.05。 2.2 危及器官剂量学指标水平
治疗1 d末, 2组危及器官剂量学指标水平比较,差异无统计学意义(P>0.05); 治疗8周末,2组危及器官剂量学指标水平均低于治疗1 d末,且观察组低于对照组,差异有统计学意义(P<0.05), 见表 2。
表 2 2组患者危及器官剂量学指标水平比较(x±s)Gy 组别 n 直肠 小肠 膀胱 治疗1 d末 治疗8周末 治疗1 d末 治疗8周末 治疗1 d末 治疗8周末 对照组 42 73.51±1.38 35.69±0.96* 65.46±2.16 27.83±1.68* 82.54±1.97 37.68±1.28* 观察组 43 73.18±1.67 26.37±0.74*# 66.34±1.98 19.54±1.23*# 83.12±1.36 30.44±0.68*# 与治疗1 d末比较, * P<0.05; 与对照组比较, #P<0.05。 2.3 不良反应
治疗后,观察组不良反应发生率低于对照组,差异有统计学意义(P<0.05), 见表 3。
表 3 2组不良反应发生情况比较[n(%)]组别 n 白细胞减少 血小板减少 恶心、呕吐 肝功能异常 肾功能异常 对照组 42 6(14.29) 4(9.52) 8(19.05) 7(16.67) 5(11.90) 观察组 43 1(2.33)* 0* 2(4.65)* 1(2.33)* 0* 与对照组比较, * P<0.05。 3. 讨论
宫颈癌是女性常见恶性肿瘤,治疗后易出现转移和复发,晚期患者常因肿瘤体积较大无法进行手术治疗[5]。化疗可降低宫颈癌的转移率或复发率,提高临床疗效。顺铂是临床常用的化疗药物,能够破坏DNA复制和转录,高浓度时还可抑制RNA及蛋白质的合成,遏制肿瘤细胞增殖分化,从而治疗宫颈癌,但具有一定毒性,会引发胃肠道不适、骨髓抑制等不良反应,严重影响患者预后[6]。近年来, ART被广泛应用于宫颈癌、前列腺癌等疾病的治疗中,其可减少病灶周围正常组织的放射剂量,从而降低并发症发生率,提高患者的生存质量。
ART通过抑制DNA复制而发挥疗效,可对细胞膜结构造成损伤,从而有效杀灭肿瘤细胞(相同条件下,肿瘤细胞比正常细胞增殖速度快,敏感性更高)。ART还能够改善患者泌尿系统症状,且对胃肠道以及肾脏功能的损害较小,从而可改善宫颈癌患者预后。本研究结果显示,治疗后,观察组治疗总有效率为93.02%(40/43), 高于对照组的73.81%(31/42), 差异有统计学意义(P<0.05), 与康海利等[7]研究结论一致。
ART主要通过计算机辅助程序来确定非均匀分布单个放射野内剂量,可减少宫颈癌患者病灶周围正常组织(如直肠、小肠和膀胱)的放射剂量,增加肿瘤病灶靶区剂量,从而有效提升疗效。ART还可以对宫颈癌患者体内的免疫细胞进行调节,抑制肿瘤细胞生长,减小病灶体积,提升机体抗肿瘤能力。本研究结果显示,观察组治疗8周末的危及器官剂量学指标水平低于对照组,差异有统计学意义(P<0.05), 与雍家慧等[8]研究结果一致。
宫颈癌患者采用ART治疗能够减少对周围正常组织的损伤,降低不良反应发生率,从而改善患者的生活质量。本研究结果显示,治疗8周后,观察组白细胞减少、恶心呕吐和肝功能异常等不良反应发生率均低于对照组,差异有统计学意义(P<0.05)。分析原因, ART能够显著增强内皮细胞功能,促进巨噬细胞和白细胞生成,提高宫颈癌患者的免疫功能。同时, ART还能诱导肿瘤细胞凋亡,抑制肿瘤细胞生长,改善患者免疫功能,缩小患者病灶体积,减少肿瘤病灶周围血供,最终减少不良反应的发生[9]。
综上所述,ART治疗局部晚期宫颈癌患者疗效显著,可提高病灶靶区剂量,并减轻周围组织损伤,降低不良反应发生率,改善患者预后。
-
表 1 抑制LncRNA SLCO4A1-AS1表达对Eca109细胞增殖、凋亡和炎症因子表达的影响(x±s)(n=9)
指标 NC组 si-NC组 si-LncRNA SLCO4A1-AS1组 LncRNA SLCO4A1-AS1表达量 1.00±0.11 1.02±0.10 0.43±0.04* Cleaved-caspase-3 0.39±0.03 0.38±0.04 0.78±0.07* 吸光度值 1.12±0.10 1.12±0.09 0.57±0.05* 细胞克隆形成数量/个 103.65±10.02 102.46±10.14 58.36±5.07* 凋亡率/% 6.27±0.59 6.23±0.58 26.31±2.27* 白细胞介素-6/(pg/mL) 207.46±18.54 208.13±17.41 95.61±8.36* 肿瘤坏死因子-α/(pg/mL) 2.63±0.19 2.59±0.22 0.94±0.08* 与si-NC组比较, *P<0.05。 表 2 过表达miR-615-5p对Eca109细胞增殖、凋亡和炎症因子表达的影响(x±s)(n=9)
指标 miR-NC组 miR-615-5p组 miR-615-5p 1.00±0.13 2.43±0.21* Cleaved-caspase-3 0.37±0.03 0.81±0.08* 吸光度值 1.12±0.10 0.60±0.05* 细胞克隆形成数量/个 102.48±9.36 53.74±4.85* 凋亡率/% 6.31±0.58 24.16±2.29* 白细胞介素-6/(pg/mL) 207.96±19.61 81.69±7.52* 肿瘤坏死因子-α/(pg/mL) 2.53±0.23 1.16±0.10* 与miR-NC组比较, *P<0.05。 表 3 抑制miR-615-5p表达可逆转LncRNA SLCO4A1-AS1低表达对Eca109增殖、凋亡和炎症因子表达的影响(x±s)(n=9)
指标 si-LncRNA SLCO4A1-AS1+anti-miR-NC组 si-LncRNA SLCO4A1-AS1+anti-miR-615-5p组 miR-615-5p 1.00±0.08 0.46±0.03* Cleaved-caspase-3 0.79±0.07 0.34±0.03* 吸光度值 0.58±0.05 1.02±0.10* 细胞克隆形成数量/个 56.38±5.03 92.42±8.46* 凋亡率/% 26.27±2.08 8.14±0.76* 白细胞介素-6/(pg/mL) 95.31±8.42 214.23±18.53* 肿瘤坏死因子-α/(pg/mL) 0.98±0.09 2.13±0.19* 与si-LncRNA SLCO4A1-AS1+anti-miR-NC组比较, *P<0.05。 -
[1] 刘宗超, 李哲轩, 张阳, 等. 2020全球癌症统计报告解读[J]. 肿瘤综合治疗电子杂志, 2021, 7(2): 1-14. [2] UHLENHOPP D J, THEN E O, SUNKARA T, et al. Epidemiology of esophageal cancer: update in global trends, etiology and risk factors[J]. Clin J Gastroenterol, 2020, 13(6): 1010-1021. doi: 10.1007/s12328-020-01237-x
[3] CODIPILLY D C, QIN Y, DAWSEY S M, et al. Screening for esophageal squamous cell carcinoma: recent advances[J]. Gastrointest Endosc, 2018, 88(3): 413-426. doi: 10.1016/j.gie.2018.04.2352
[4] 沈钲杰, 朱银银, 沈凡含, 等. lncRNA与miRNA调节关系和ceRNA关系在疾病中的研究进展[J]. 中国细胞生物学学报, 2018, 40(10): 1774-1780. [5] 赵志国, 张力平. miRNA和lncRNA相互作用与恶性肿瘤相关性的研究进展[J]. 现代肿瘤医学, 2018, 26(18): 2991-2994. doi: 10.3969/j.issn.1672-4992.2018.18.040 [6] YU J T, HAN Z Y, SUN Z Q, et al. LncRNA SLCO4A1-AS1 facilitates growth and metastasis of colorectal cancer through β-catenin-dependent Wnt pathway[J]. J Exp Clin Cancer Res, 2018, 37(1): 222. doi: 10.1186/s13046-018-0896-y
[7] YANG Y, WANG F, HUANG H, et al. lncRNA SLCO4A1-AS1 promotes growth and invasion of bladder cancer through sponging miR-335-5p to upregulate OCT4[J]. Onco Targets Ther, 2019, 12: 1351-1358. doi: 10.2147/OTT.S191740
[8] YANG B Y, XIE R, WU S N, et al. MicroRNA-615-5p targets insulin-like growth factor 2 and exerts tumor-suppressing functions in human esophageal squamous cell carcinoma[J]. Oncol Rep, 2018, 39(1): 255-263.
[9] LI Q P, JIANG B, QI Y, et al. Long non-coding RNA SLCO4A1-AS1 drives the progression of non-small-cell lung cancer by modulating miR-223-3p/IKKα/NF-κB signaling[J]. Cancer Biol Ther, 2020, 21(9): 806-814. doi: 10.1080/15384047.2020.1787757
[10] WU K, XU T, SONG X D, et al. LncRNA SLCO4A1-AS1 modulates colon cancer stem cell properties by binding to miR-150-3p and positively regulating SLCO4A1[J]. Lab Invest, 2021, 101(7): 908-920. doi: 10.1038/s41374-021-00577-7
[11] WEI Y X, WEI L, LI J W, et al. SLCO4A1-AS1 promotes cell growth and induces resistance in lung adenocarcinoma by modulating miR-4701-5p/NFE2L1 axis to activate WNT pathway[J]. Cancer Med, 2020, 9(19): 7205-7217. doi: 10.1002/cam4.3270
[12] MAO J P, GAO W L, XUE L G, et al. The lncRNA SLCO4A1-AS1/miR-876-3p/RBBP6 axis regulates cell proliferation and apoptosis in acute lymphocytic leukemia via the JNK signaling pathway[J]. Int J Lab Hematol, 2021, 43(5): 1050-1061. doi: 10.1111/ijlh.13501
[13] TANG R, CHEN J H, TANG M T, et al. LncRNA SLCO4A1-AS1 predicts poor prognosis and promotes proliferation and metastasis via the EGFR/MAPK pathway in colorectal cancer[J]. Int J Biol Sci, 2019, 15(13): 2885-2896. doi: 10.7150/ijbs.38041
[14] LIN E W, KARAKASHEVA T A, HICKS P D, et al. The tumor microenvironment in esophageal cancer[J]. Oncogene, 2016, 35(41): 5337-5349. doi: 10.1038/onc.2016.34
[15] 刘良忠, 李小红, 马楼艳, 等. 白细胞介素37对食管癌细胞增殖、迁移、炎症反应的影响及其机制[J]. 山东医药, 2016, 56(45): 34-37. doi: 10.3969/j.issn.1002-266X.2016.45.010 [16] FANG Y T, SUN B, GAO J P, et al. LncRNA SLCO4A1-AS1 accelerates growth and metastasis of gastric cancer via regulation of the miR-149/XIAP axis[J]. Front Oncol, 2021, 11: 683256. doi: 10.3389/fonc.2021.683256
[17] WANG Z Z, JIN J J. LncRNA SLCO4A1-AS1 promotes colorectal cancer cell proliferation by enhancing autophagy via miR-508-3p/PARD3 axis[J]. Aging, 2019, 11(14): 4876-4889. doi: 10.18632/aging.102081
[18] ZHANG M Q, LIN B Q, LIU Y M, et al. LINC00324 affects non-small cell lung cancer cell proliferation and invasion through regulation of the miR-139-5p/IGF1R axis[J]. Mol Cell Biochem, 2020, 473(1/2): 193-202.
[19] GAO W, GU Y, LI Z, et al. MiR-615-5p is epigenetically inactivated and functions as a tumor suppressor in pancreatic ductal adenocarcinoma[J]. Oncogene, 2015, 34(13): 1629-1640. doi: 10.1038/onc.2014.101
[20] GUAN X, ZONG Z H, LIU Y, et al. circPUM1 promotes tumorigenesis and progression of ovarian cancer by sponging miR-615-5p and miR-6753-5p[J]. Mol Ther Nucleic Acids, 2019, 18: 882-892. doi: 10.1016/j.omtn.2019.09.032
[21] 陈刚, 王国栋, 王乃辉. mir-615-5p通过靶向调节癌基因TRAF4抑制非小细胞肺癌细胞的增殖[J]. 中国生物化学与分子生物学报, 2016, 32(2): 184-190. [22] LIANG Z Y, ZHAO B S, HOU J S, et al. CircRNA circ-OGDH (hsa_circ_0003340) acts as a ceRNA to regulate glutamine metabolism and esophageal squamous cell carcinoma progression by the miR-615-5p/PDX1 axis[J]. Cancer Manag Res, 2021, 13: 3041-3053. doi: 10.2147/CMAR.S290088
-
期刊类型引用(5)
1. 陈丽云. 高效液相色谱串联质谱法检测精神病患者血清中的多种抗精神病类药物及代谢物的浓度. 北方药学. 2024(07): 4-8 .  百度学术
百度学术
2. 徐佳雯,高青,张斐,张雯,王逸. 高效液相色谱法测定地西泮直肠凝胶有关物质. 实用临床医药杂志. 2024(17): 92-98 .  本站查看
本站查看
3. 王本军,张寒娟,韩文超. 二维液相色谱法测定两性霉素B的血药浓度方法研究. 医药论坛杂志. 2024(20): 2213-2217 .  百度学术
百度学术
4. 陈明,刘真,黄晓舞. 液质联用方法测定抗真菌药物伏立康唑、泊沙康唑及两性霉素B的药物浓度. 武警医学. 2024(12): 1039-1045 .  百度学术
百度学术
5. 纪梅芳,卢桂清. 直接蛋白沉淀-超高效液相色谱法测定氟尿嘧啶血药浓度. 北方药学. 2023(08): 9-11+14 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号