Correlation between left atrial diameter and renal function in patients with atrial fibrillation
-
摘要:目的
探讨心房颤动患者左心房内径(LAD)与肾功能的相关性。
方法选取364例心房颤动患者作为研究对象, 收集患者的临床资料, 包括性别、年龄、身高、体质量、吸烟史、饮酒史、心房颤动类型、高血压病史、冠心病病史、糖尿病病史、心力衰竭病史、用药史、高敏肌钙蛋白I、脑钠肽、C反应蛋白、肌酐、尿素氮、LAD、左室射血分数(LVEF)、左室舒张末期内径(LVDd)、左室后壁厚度(LVPWTd)和室间隔厚度(IVSTd); 计算估算肾小球滤过率(eGFR)和体质量指数。采用Spearman相关分析法探讨LAD与肌酐、尿素氮、eGFR的相关性; 将eGFR < 60 mL/(min·1.73 m2)设定为肾功能不全, 采用单因素Logistic回归分析探讨心房颤动患者肾功能不全的影响因素; 采用二元Logistic回归分析探讨房颤患者LAD与肾功能不全的关系。
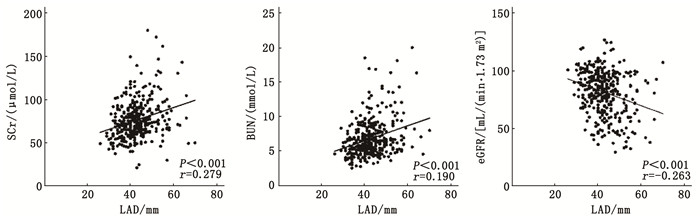
结果Spearman相关分析结果显示, 心房颤动患者中LAD与肌酐(r=0.279, P < 0.001)、尿素氮(r=0.190, P < 0.001)呈正相关, 与eGFR(r=-0.263, P < 0.001)呈负相关。单因素Logistic回归分析结果显示, 性别、糖尿病病史、高血压病史、冠心病病史、心力衰竭病史、房颤类型、钠-葡萄糖共转运蛋白2抑制剂用药史、利尿剂用药史、LAD、LVEF、LVDd、IVSTd均为房颤患者肾功能不全的影响因素(P < 0.05)。二元Logistic回归分析结果显示, 与LAD第1四分位(LAD ≤ 38 mm)相比, LAD第4四分位(LAD>47 mm)心房颤动患者发生肾功能不全的风险升高5.199倍(OR=5.199, 95 %CI: 1.210~22.337, P=0.027)。
结论心房颤动患者的LAD与肾功能显著相关, 且LAD是心房颤动患者肾功能不全的影响因素。
Abstract:ObjectiveTo explore the correlation between left atrial diameter (LAD) and renal function in patients with atrial fibrillation.
MethodsA total of 364 patients with atrial fibrillation were selected as study subjects. Clinical data of the patients were collected, including gender, age, height, body weight, smoking history, drinking history, atrial fibrillation type, history of hypertension, coronary heart disease, diabetes, heart failure, medication history, high-sensitivity troponin I, brain natriuretic peptide, C-reactive protein, creatinine, urea nitrogen, LAD, left ventricular ejection fraction (LVEF), left ventricular end-diastolic diameter (LVDd), left ventricular posterior wall thickness (LVPWTd), and interventricular septal thickness (IVSTd). Estimated glomerular filtration rate (eGFR) and body mass index were calculated. Spearman correlation analysis was used to explore the correlations of LAD with creatinine, urea nitrogen, and eGFR. With eGFR < 60 mL/(min·1.73 m2) setting as renal insufficiency, univariate Logistic regression analysis was used to explore the influencing factors of renal insufficiency in patients with atrial fibrillation. Binary Logistic regression analysis was used to explore the relationship between LAD and renal insufficiency in patients with atrial fibrillation.
ResultsSpearman correlation analysis showed that LAD was positively correlated with creatinine (r=0.279, P < 0.001) and urea nitrogen (r=0.190, P < 0.001) in patients with atrial fibrillation, and negatively correlated with eGFR (r=-0.263, P < 0.001). Univariate Logistic regression analysis showed that gender, history of diabetes, hypertension, coronary heart disease, heart failure, atrial fibrillation type, sodium-glucose cotransporter 2 inhibitor medication history, diuretic medication history, LAD, LVEF, LVDd, and IVSTd were all influencing factors of renal insufficiency in patients with atrial fibrillation (P < 0.05). Binary Logistic regression analysis showed that compared with the first quartile of LAD (LAD ≤ 38 mm), the risk of renal insufficiency in patients with atrial fibrillation in the fourth quartile of LAD (LAD>47 mm) increased by 5.199 times(OR=5.199; 95 %CI, 1.210 to 22.337; P=0.027).
ConclusionLAD of patients with atrial fibrillation is significantly related to renal function, and LAD is an influencing factor of renal insufficiency in patients with atrial fibrillation.
-
心房颤动(简称房颤)表现为快速无序的心房电活动替代正常电活动,引起心室率不规则和心脏收缩功能降低,进而使心脏泵血效率下降[1]。房颤可引发多种严重并发症,如中风、心力衰竭、认知障碍和肾损伤等[2-3]。左心房扩大与房颤关系密切,左心房扩大可增加房颤易感性,而房颤又会加剧左心房扩大。既往研究[4]发现,左心房扩大是卒中、心肌梗死、心力衰竭和肾功能不全等多种疾病的危险因素。肾功能不全可引起机体代谢废物排出减少、电解质失衡等,临床常采用血清肌酐(SCr)、血尿素氮(BUN)和估算肾小球滤过率(eGFR)评估肾功能[5]。房颤可引起肾功能不全并加重肾脏病,肾功能损伤也会导致房颤发病率升高和病情恶化, 15%~20%的肾功能不全患者同时患有房颤[6]。本研究探讨房颤患者左心房内径(LAD)与肾功能的相关性,现报告如下。
1. 对象与方法
1.1 研究对象
回顾性选取2020年1月—2022年4月青岛市市立医院(东院区)心内二科收治的364例房颤患者作为研究对象。纳入标准: ①经12导联心电图或动态心电图检查确诊房颤,或既往有房颤病史者; ②年龄≥18岁者。排除标准: ①合并先天性心脏病、严重心脏瓣膜病、心肌梗死、甲状腺功能亢进、恶性肿瘤患者; ②心脏消融术后患者; ③确诊肾脏疾病者; ④资料不完整者。本研究经医院医学伦理委员会审查批准(批件号KTLL202306156)。
1.2 研究方法
以研究对象观察年度的首次住院检查结果为研究指标,2名研究人员共同收集、整理数据并核对。通过联众数字化病案浏览器收集研究对象的基本资料,包括性别、年龄、身高、体质量、吸烟史、饮酒史、房颤类型、高血压病史、冠心病病史、糖尿病病史、心力衰竭病史、用药史[胰岛素、钠-葡萄糖共转运蛋白2抑制剂(SGLT2i)、β受体阻滞剂、钙通道阻滞剂、血管紧张素转化酶抑制剂(ACEI)、血管紧张素Ⅱ受体阻断剂(ARB)、血管紧张素受体-脑啡肽酶抑制剂(ARNI)、利尿剂]。记录入院后首次测定的空腹8 h后静脉血SCr、BUN、高敏肌钙蛋白I(hs-cTnI)、脑钠肽(BNP)、C反应蛋白(CRP)水平,收集超声心动图指标LAD、左室射血分数(LVEF)、左室舒张末期内径(LVDd)、左室后壁厚度(LVPWTd)和室间隔厚度(IVSTd)。使用慢性肾脏病流行病学合作研究公式(CKD-EPI)计算eGFR[7], 通过体质量(kg)/身高(m)2计算体质量指数(BMI)。
1.3 分组
根据LAD的四分位数,将364例房颤患者分为第1组(LAD≤38 mm)95例、第2组(LAD>38~42 mm)99例、第3组(LAD>42~47 mm)90例和第4组(LAD>47 mm)80例。
1.4 统计学分析
采用SPSS 26.0统计学软件分析数据,采用GraphPad Prism 9.5.0软件绘图。通过Shapiro-Wilk检验明确连续变量是否呈正态分布,正态分布的连续变量以(x±s)表示,多组间比较采用单因素方差分析; 非正态分布的连续变量以[M(P25, P75)]表示,多组间比较采用Kruskal-Wallis秩和检验; 分类变量以[n(%)]表示,比较采用χ2检验。采用Spearman相关分析法探讨LAD与SCr、BUN、eGFR的相关性; 将eGFR < 60 mL/(min·1.73 m2)设定为肾功能不全,采用单因素Logistic回归分析探讨房颤患者肾功能不全的影响因素; 以肾功能不全为因变量(eGFR计算公式中包含年龄,同时对eGFR和年龄进行调整可能会在回归模型中产生混淆,因此未将年龄纳入),以LAD四分位数为自变量(最低四分位数作为参照),采用二元Logistic回归分析探讨房颤患者LAD与肾功能不全的关系。P < 0.05为差异有统计学意义。
2. 结果
2.1 一般资料
364例患者平均年龄为68.83岁,其中男203例(55.77%), 女161例(44.23%)。4组患者性别、年龄、糖尿病病史、高血压病史、冠心病病史、吸烟史、饮酒史和胰岛素、SGLT2i、β受体阻滞剂、钙通道阻滞剂、ACEI/ARB/ARNI用药情况比较,差异均无统计学意义(P>0.05); 4组患者BMI、心力衰竭病史、利尿剂用药情况、房颤类型和hs-cTnI、BNP、CRP、LVEF、LVDd、LVPWTd、IVSTd、SCr、BUN、eGFR水平比较,差异均有统计学意义(P < 0.05),见表 1。
表 1 4组房颤患者一般资料比较[n(%)][M(P25, P75)]指标 分类 第1组(n=95) 第2组(n=99) 第3组(n=90) 第4组(n=80) χ2/H P 性别 男 42(44.21) 56(56.57) 55(61.11) 50(62.50) 7.681 0.053 女 53(55.79) 43(43.43) 35(38.89) 30(37.50) 年龄/岁 68.00(58.00, 77.00) 69.00(61.00, 77.00) 70.00(61.75, 77.25) 73.50(63.00, 81.00) 5.837 0.120 体质量指数/(kg/m2) 24.98(23.03, 26.67) 26.37(24.61, 28.55) 27.11(24.27, 28.75) 26.75(24.73, 29.90) 18.124 < 0.001 吸烟史 14(14.74) 25(25.25) 23(25.56) 20(25.00) 4.478 0.214 饮酒史 10(10.53) 20(20.20) 21(23.33) 14(17.50) 5.699 0.127 病史 糖尿病 17(17.89) 28(28.28) 30(33.33) 27(33.75) 7.394 0.060 高血压 48(50.53) 56(56.57) 58(64.44) 52(65.00) 5.341 0.148 冠心病 35(36.84) 46(46.46) 45(50.00) 43(53.75) 5.696 0.127 心力衰竭 6(6.32) 14(14.14) 18(20.00) 22(27.50) 15.390 0.002 用药史 胰岛素 5(5.26) 3(3.03) 5(5.56) 6(7.50) 1.821 0.610 SGLT2i 5(5.26) 4(4.04) 7(7.78) 4(5.00) 1.354 0.716 β受体阻滞剂 22(23.16) 23(23.23) 26(28.89) 25(31.25) 2.828 0.516 钙通道阻滞剂 21(22.11) 21(21.21) 28(31.11) 19(23.75) 3.028 0.387 ACEI/ARB/ARNI 32(33.68) 26(26.26) 30(33.33) 30(37.50) 2.759 0.430 利尿剂 9(9.47) 11(11.11) 9(10.00) 18(22.50) 8.503 0.037 房颤类型 持续性 16(16.84) 49(49.49) 51(56.67) 63(78.75) 69.759 < 0.001 阵发性 79(83.16) 50(50.51) 39(43.33) 17(21.25) hs-cTnI/(ng/mL) 0.001(0.001, 0.006) 0.003(0.001, 0.190) 0.008(0.001, 0.029) 0.010(0.001, 0.035) 23.481 < 0.001 脑钠肽/(ng/mL) 70.39(26.10, 155.97) 201.30(81.48, 396.30) 248.78(112.00, 571.78) 423.98(179.94, 1 118.80) 62.210 < 0.001 C反应蛋白/(mg/L) 0.50(0.50, 1.29) 0.95(0.50, 2.98) 0.63(0.50, 3.15) 1.17(0.50, 4.63) 9.440 0.024 eGFR/[mL/(min·1.73 m2)] 89.90(76.68, 98.84) 86.33(73.65, 7.31) 81.97(69.51, 93.46) 75.26(56.24, 92.61) 21.651 < 0.001 SCr/(μmol/L) 68.02(55.17, 78.44) 72.80(60.91, 85.53) 74.45(65.31, 86.98) 80.35(70.34, 99.75) 29.490 < 0.001 BUN/(mmol/L) 5.83(4.59, 7.11) 6.59(5.07, 7.88) 6.31(5.02, 7.65) 6.95(5.46, 8.91) 13.747 0.003 LVEF/% 60.00(58.00, 60.00) 58.00(55.00, 60.00) 58.00(55.00, 60.00) 55.50(43.50, 58.00) 83.370 < 0.001 LVDd/mm 45.00(43.00, 48.00) 47.00(44.00, 50.00) 48.00(46.00, 53.00) 50.00(48.00, 57.75) 72.768 < 0.001 左室后壁厚度/mm 8.60(8.00, 9.20) 9.00(8.50, 9.60) 9.30(8.70, 10.00) 9.75(9.00, 10.30) 39.431 < 0.001 室间隔厚度/mm 9.00(8.10, 10.00) 9.30(8.80, 10.00) 9.95(9.00, 11.00) 10.00(9.00, 11.00) 25.637 < 0.001 SGLT2i: 钠-葡萄糖协同转运蛋白2抑制剂; ACEI: 血管紧张素转化酶抑制剂; ARB: 血管紧张素Ⅱ受体阻断剂; ARNI: 血管紧张素受体-脑啡肽酶抑制剂; hs-cTnI: 高敏肌钙蛋白I; eGFR: 估算肾小球滤过率; SCr: 肌酐; BUN: 尿素氮; LVEF: 左室射血分数; LVDd: 左室舒张末期内径。 2.2 LAD与SCr、BUN和eGFR的相关性
Spearman相关分析结果显示,房颤患者LAD与SCr(r=0.279, P < 0.001)、BUN(r=0.190, P < 0.001)呈正相关, 与eGFR(r=-0.263, P < 0.001)呈负相关,见图 1。
2.3 肾功能不全的影响因素
以肾功能不全为因变量(是=1, 否=0), 以性别(女=0, 男=1)、BMI(实测值)、hs-cTnI(实测值)、CRP(实测值)、LAD(实测值)、LVEF(实测值)、LVDd(实测值)、LVPWTd(实测值)、IVSTd(实测值)、SGLT2i(未服用=0, 服用=1)、ACEI/ARB/ARNI(未服用=0, 服用=1)、β受体阻滞剂(未服用=0, 服用=1)、利尿剂(未服用=0, 服用=1)、糖尿病病史(有=1, 无=0)、高血压病史(有=1, 无=0)、冠心病病史(有=1, 无=0)、心力衰竭病史(有=1, 无=0)、吸烟史(有=1, 无=0)、饮酒史(有=1, 无=0)、房颤类型(阵发性=0, 持续性=1)为自变量,进行单因素Logistic回归分析。分析结果显示,性别、房颤类型、糖尿病病史、高血压病史、冠心病病史、心力衰竭病史、SGLT2i用药史、利尿剂用药史、LAD、LVEF、LVDd、IVSTd均为房颤患者肾功能不全的影响因素(P < 0.05), 见表 2。
表 2 房颤患者肾功能不全的单因素Logistic回归分析变量 β SE OR 95%CI P 性别 -0.645 0.288 0.525 0.298~0.922 0.025 体质量指数 -0.061 0.041 0.941 0.869~1.019 0.135 吸烟史 -0.559 0.386 0.572 0.268~1.219 0.148 饮酒史 -0.751 0.454 0.472 0.194~1.150 0.099 高敏肌钙蛋白I -0.558 0.788 0.572 0.122~2.680 0.479 C反应蛋白 -0.001 0.002 0.999 0.995~1.004 0.761 房颤类型 0.658 0.293 1.931 1.088~3.426 0.025 糖尿病病史 1.037 0.293 2.820 1.588~5.006 < 0.001 高血压病史 0.846 0.320 2.329 1.243~4.365 0.008 冠心病病史 0.965 0.298 2.625 1.463~4.711 0.001 心力衰竭病史 0.678 0.340 1.970 1.012~3.834 0.046 SGLT2i用药史 1.343 0.481 3.830 1.492~9.832 0.005 ACEI/ARB/ARNI用药史 0.345 0.294 1.412 0.793~2.514 0.241 β受体阻滞剂用药史 0.435 0.305 1.545 0.850~2.811 0.154 利尿剂用药史 0.812 0.363 2.253 1.106~4.588 0.025 左心房内径 0.090 0.019 1.094 1.053~1.136 < 0.001 左室射血分数 -0.042 0.013 0.959 0.934~0.984 0.002 左室舒张末期内径 0.043 0.021 1.044 1.001~1.088 0.042 左室后壁厚度 0.211 0.136 1.234 0.946~1.611 0.121 室间隔厚度 0.202 0.091 1.224 1.024~1.463 0.027 2.4 LAD与肾功能不全关系的二元Logistic回归分析
以LAD四分位数为自变量(最低四分位数作为参照),以肾功能不全为因变量,逐步矫正性别、BMI、糖尿病病史、高血压病史、冠心病病史、心力衰竭病史、CRP、LVEF、LVDd、IVSTd、房颤类型混杂因素,进行二元Logistic回归分析。分析结果显示,与LAD第1四分位相比, LAD第4四分位房颤患者发生肾功能不全的风险升高5.199倍(OR=5.199, 95%CI: 1.210~22.337, P=0.027), 见表 3。
表 3 房颤患者LAD与肾功能不全的二元Logistic回归分析LAD分组 模型1 模型2 模型3 β SE OR(95%CI) P β SE OR(95%CI) P β SE OR(95%CI) P 第1四分位 — — — — — — — — — — — — 第2四分位 0.716 0.522 2.046(0.735~5.694) 0.170 1.019 0.587 2.771(0.876~8.759) 0.083 0.695 0.678 2.004(0.531~7.563) 0.305 第3四分位 1.005 0.512 2.732(1.001~7.459) 0.050 1.385 0.568 3.994(1.313~12.148) 0.015 1.038 0.641 2.822(0.803~9.921) 0.106 第4四分位 2.022 0.484 7.557(2.929~19.495) < 0.001 2.303 0.547 10.008(3.428~29.221) < 0.001 1.648 0.744 5.199(1.210~22.337) 0.027 第1四分位数: LAD≤38 mm; 第2四分位数: LAD>38~42 mm; 第3四分位数: LAD>42~47 mm; 第4四分位数: LAD>47 mm; 模型1: 不包含协变量; 模型2: 根据模型1,加入性别、BMI、糖尿病病史、高血压病史、冠心病病史、心力衰竭病史协变量进行调整; 模型3: 根据模型2,加入CRP、LVEF、LVDd、IVSTd、房颤类型协变量进行调整。 3. 讨论
房颤与肾功能不全为临床常见疾病,发病率较高,其共同危险因素包括高血压、糖尿病、心肌梗死、心力衰竭等[8]。本研究结果显示,房颤患者LAD增大与较高的SCr、BUN和较低的eGFR相关,且单因素Logistic回归分析发现糖尿病、高血压、冠心病、心力衰竭病史均为房颤患者肾功能不全的危险因素。一方面,房颤可能通过引发氧化应激反应、加剧炎症和促进肾动脉栓塞,诱发或加重肾功能损伤[9]; 房颤可激活血管紧张素Ⅱ型受体介导的氧化应激反应,干扰肾脏血供,下调肾脏中性内肽酶表达,促进肾纤维化,逐渐损害肾功能[10]; 房颤相关的全身促炎状态可直接导致肾功能下降[11], 并促进心肌纤维化,继而引发血流动力学失衡和心功能降低,间接导致肾功能下降[12]; 房颤伴左心房扩大,会引起心房内涡流,增加左心耳血栓形成风险[13], 即便服用抗凝药物,房颤患者亦难以规避相关风险,血栓脱落可堵塞肾动脉,引发肾梗死,严重损害肾功能[14]。一项双向孟德尔随机化研究[15]表明,根据基因预测的房颤与eGFR降低(β=-0.003, P < 0.001)、慢性肾脏病风险增加(β=0.059, P < 0.001)显著相关,而根据基因预测的肾功能与房颤风险无关。另有研究[16]显示,较低的eGFR与房颤风险增加相关(HR=1.08, 95%CI: 1.03~1.14), 且房颤与肾功能下降风险增加相关(HR=1.33, 95%CI: 1.12~1.58)。2型糖尿病患者中,房颤者较心律正常者更易患慢性肾病(HR=1.68, 95%CI: 1.41~2.01)[17]。一项针对中国北方人群的研究[18]发现,房颤是新发慢性肾功能不全(CKD)的危险因素(HR=1.477, 95%CI: 1.208~1.806, P < 0.001)。另一方面,肾功能损伤也会升高房颤的发病率,这与肾功能不全所致水钠潴留、钙离子分布异常及炎症有关。尿毒症毒素积聚可造成肺静脉中钙离子大量渗漏,诱发肺静脉延迟后去极化、窦房结自发活动减少以及左心房动作电位持续时间缩短,从而升高房颤发生率[19]。此外,肾素-血管紧张素-醛固酮系统(RAAS)过度激活、循环系统超负荷、伴随肾功能减退的全身炎症状态等均可升高肾功能下降患者的房颤发病率[10]。
心房重构包括电重构和结构重构,在房颤的发生和维持中起重要作用[20]。心房结构重构是间质纤维化增多的结果,伴随着心脏结构改变及心房腔扩大[21]。心房纤维化和肾功能不全存在密切关联。钙调蛋白依赖性蛋白激酶Ⅱ(CaMKⅡ)过度磷酸化是心律失常的关键机制,肾功能不全时,过度活跃的炎症反应和RAAS会促进活性氧积累,通过氧化CaMKⅡ加速心房纤维化进程,进而促进房颤发展。CKD通过成纤维细胞生长因子-23/成纤维细胞生长因子受体4轴促进活性氧积累,并调节信号换能器和转录激活因子3通路,加剧心房纤维化[6]。相关研究[22]指出, LAD与左心房容积具有线性关系,且LAD已被广泛用于评估左心房大小。尽管LAD为单一维度测量指标,但其具有测量简便、观测者间一致性高及可重复性高等优点,故本研究采用LAD评估左心房大小。
LAD增大与多种不良事件有关,如房颤、卒中、心肌梗死、心力衰竭、肾功能不全等[23]。评估LAD, 可预测房颤的发病风险、消融成功概率和复发概率[24]。房颤可导致LAD增大,且房颤类型和持续时间均可影响LAD[25], 相较于窦性心律者和阵发性房颤患者,持续性房颤患者左心房显著增大。本研究发现,与LAD低四分位数组别相比,LAD高四分位数高组别中的持续性房颤患者占比显著更高。既往研究[26]表明,随着CKD分期的增加, LAD增大。研究[27]显示, LAD增大与CKD患者肾脏疾病不良预后独立相关。早期或晚期CKD患者中, LAD增大均提示肾功能下降速度更快,且未来需透析治疗的可能性更高[28-29]。相关研究[29]对房颤患者进行随访发现, eGFR下降组患者的基线LAD大于非下降组,进一步调整潜在混杂因素, LAD增大与eGFR大幅下降有关(OR=1.55, 95%CI: 1.03~2.32, P=0.035)。本研究也发现,房颤患者LAD与eGFR呈负相关,且LAD是房颤患者肾功能不全的影响因素。
综上所述,房颤患者LAD与肾功能显著相关,提示LAD或可作为反映房颤患者肾功能的指标。房颤是肾功能不全的危险因素,优化房颤管理策略有望降低肾功能受损风险。房颤、肾功能不全均与心房纤维化有关,定期检测LAD有助于临床医师监测房颤患者肾功能,为制订个体化房颤治疗方案提供依据。本研究存在一定局限性: ①本研究为横断面研究,后续还需长期随访验证结论的有效性; ②本研究仅采用LAD衡量左心房大小,后续研究中应考虑纳入更多的敏感指标以提高评估精度。③本研究仅纳入单中心患者作为研究对象,可能存在选择偏倚,后续可增加样本量以及开展多中心研究进一步验证。
-
表 1 4组房颤患者一般资料比较[n(%)][M(P25, P75)]
指标 分类 第1组(n=95) 第2组(n=99) 第3组(n=90) 第4组(n=80) χ2/H P 性别 男 42(44.21) 56(56.57) 55(61.11) 50(62.50) 7.681 0.053 女 53(55.79) 43(43.43) 35(38.89) 30(37.50) 年龄/岁 68.00(58.00, 77.00) 69.00(61.00, 77.00) 70.00(61.75, 77.25) 73.50(63.00, 81.00) 5.837 0.120 体质量指数/(kg/m2) 24.98(23.03, 26.67) 26.37(24.61, 28.55) 27.11(24.27, 28.75) 26.75(24.73, 29.90) 18.124 < 0.001 吸烟史 14(14.74) 25(25.25) 23(25.56) 20(25.00) 4.478 0.214 饮酒史 10(10.53) 20(20.20) 21(23.33) 14(17.50) 5.699 0.127 病史 糖尿病 17(17.89) 28(28.28) 30(33.33) 27(33.75) 7.394 0.060 高血压 48(50.53) 56(56.57) 58(64.44) 52(65.00) 5.341 0.148 冠心病 35(36.84) 46(46.46) 45(50.00) 43(53.75) 5.696 0.127 心力衰竭 6(6.32) 14(14.14) 18(20.00) 22(27.50) 15.390 0.002 用药史 胰岛素 5(5.26) 3(3.03) 5(5.56) 6(7.50) 1.821 0.610 SGLT2i 5(5.26) 4(4.04) 7(7.78) 4(5.00) 1.354 0.716 β受体阻滞剂 22(23.16) 23(23.23) 26(28.89) 25(31.25) 2.828 0.516 钙通道阻滞剂 21(22.11) 21(21.21) 28(31.11) 19(23.75) 3.028 0.387 ACEI/ARB/ARNI 32(33.68) 26(26.26) 30(33.33) 30(37.50) 2.759 0.430 利尿剂 9(9.47) 11(11.11) 9(10.00) 18(22.50) 8.503 0.037 房颤类型 持续性 16(16.84) 49(49.49) 51(56.67) 63(78.75) 69.759 < 0.001 阵发性 79(83.16) 50(50.51) 39(43.33) 17(21.25) hs-cTnI/(ng/mL) 0.001(0.001, 0.006) 0.003(0.001, 0.190) 0.008(0.001, 0.029) 0.010(0.001, 0.035) 23.481 < 0.001 脑钠肽/(ng/mL) 70.39(26.10, 155.97) 201.30(81.48, 396.30) 248.78(112.00, 571.78) 423.98(179.94, 1 118.80) 62.210 < 0.001 C反应蛋白/(mg/L) 0.50(0.50, 1.29) 0.95(0.50, 2.98) 0.63(0.50, 3.15) 1.17(0.50, 4.63) 9.440 0.024 eGFR/[mL/(min·1.73 m2)] 89.90(76.68, 98.84) 86.33(73.65, 7.31) 81.97(69.51, 93.46) 75.26(56.24, 92.61) 21.651 < 0.001 SCr/(μmol/L) 68.02(55.17, 78.44) 72.80(60.91, 85.53) 74.45(65.31, 86.98) 80.35(70.34, 99.75) 29.490 < 0.001 BUN/(mmol/L) 5.83(4.59, 7.11) 6.59(5.07, 7.88) 6.31(5.02, 7.65) 6.95(5.46, 8.91) 13.747 0.003 LVEF/% 60.00(58.00, 60.00) 58.00(55.00, 60.00) 58.00(55.00, 60.00) 55.50(43.50, 58.00) 83.370 < 0.001 LVDd/mm 45.00(43.00, 48.00) 47.00(44.00, 50.00) 48.00(46.00, 53.00) 50.00(48.00, 57.75) 72.768 < 0.001 左室后壁厚度/mm 8.60(8.00, 9.20) 9.00(8.50, 9.60) 9.30(8.70, 10.00) 9.75(9.00, 10.30) 39.431 < 0.001 室间隔厚度/mm 9.00(8.10, 10.00) 9.30(8.80, 10.00) 9.95(9.00, 11.00) 10.00(9.00, 11.00) 25.637 < 0.001 SGLT2i: 钠-葡萄糖协同转运蛋白2抑制剂; ACEI: 血管紧张素转化酶抑制剂; ARB: 血管紧张素Ⅱ受体阻断剂; ARNI: 血管紧张素受体-脑啡肽酶抑制剂; hs-cTnI: 高敏肌钙蛋白I; eGFR: 估算肾小球滤过率; SCr: 肌酐; BUN: 尿素氮; LVEF: 左室射血分数; LVDd: 左室舒张末期内径。 表 2 房颤患者肾功能不全的单因素Logistic回归分析
变量 β SE OR 95%CI P 性别 -0.645 0.288 0.525 0.298~0.922 0.025 体质量指数 -0.061 0.041 0.941 0.869~1.019 0.135 吸烟史 -0.559 0.386 0.572 0.268~1.219 0.148 饮酒史 -0.751 0.454 0.472 0.194~1.150 0.099 高敏肌钙蛋白I -0.558 0.788 0.572 0.122~2.680 0.479 C反应蛋白 -0.001 0.002 0.999 0.995~1.004 0.761 房颤类型 0.658 0.293 1.931 1.088~3.426 0.025 糖尿病病史 1.037 0.293 2.820 1.588~5.006 < 0.001 高血压病史 0.846 0.320 2.329 1.243~4.365 0.008 冠心病病史 0.965 0.298 2.625 1.463~4.711 0.001 心力衰竭病史 0.678 0.340 1.970 1.012~3.834 0.046 SGLT2i用药史 1.343 0.481 3.830 1.492~9.832 0.005 ACEI/ARB/ARNI用药史 0.345 0.294 1.412 0.793~2.514 0.241 β受体阻滞剂用药史 0.435 0.305 1.545 0.850~2.811 0.154 利尿剂用药史 0.812 0.363 2.253 1.106~4.588 0.025 左心房内径 0.090 0.019 1.094 1.053~1.136 < 0.001 左室射血分数 -0.042 0.013 0.959 0.934~0.984 0.002 左室舒张末期内径 0.043 0.021 1.044 1.001~1.088 0.042 左室后壁厚度 0.211 0.136 1.234 0.946~1.611 0.121 室间隔厚度 0.202 0.091 1.224 1.024~1.463 0.027 表 3 房颤患者LAD与肾功能不全的二元Logistic回归分析
LAD分组 模型1 模型2 模型3 β SE OR(95%CI) P β SE OR(95%CI) P β SE OR(95%CI) P 第1四分位 — — — — — — — — — — — — 第2四分位 0.716 0.522 2.046(0.735~5.694) 0.170 1.019 0.587 2.771(0.876~8.759) 0.083 0.695 0.678 2.004(0.531~7.563) 0.305 第3四分位 1.005 0.512 2.732(1.001~7.459) 0.050 1.385 0.568 3.994(1.313~12.148) 0.015 1.038 0.641 2.822(0.803~9.921) 0.106 第4四分位 2.022 0.484 7.557(2.929~19.495) < 0.001 2.303 0.547 10.008(3.428~29.221) < 0.001 1.648 0.744 5.199(1.210~22.337) 0.027 第1四分位数: LAD≤38 mm; 第2四分位数: LAD>38~42 mm; 第3四分位数: LAD>42~47 mm; 第4四分位数: LAD>47 mm; 模型1: 不包含协变量; 模型2: 根据模型1,加入性别、BMI、糖尿病病史、高血压病史、冠心病病史、心力衰竭病史协变量进行调整; 模型3: 根据模型2,加入CRP、LVEF、LVDd、IVSTd、房颤类型协变量进行调整。 -
[1] BAMAN J R, PASSMAN R S. Atrial fibrillation[J]. JAMA, 2021, 325(21): 2218. doi: 10.1001/jama.2020.23700
[2] LIPPI G, SANCHIS-GOMAR F, CERVELLIN G. Global epidemiology of atrial fibrillation: an increasing epidemic and public health challenge[J]. Int J Stroke, 2021, 16(2): 217-221. doi: 10.1177/1747493019897870
[3] WIJESURENDRA R S, CASADEI B. Mechanisms of atrial fibrillation[J]. Heart, 2019, 105(24): 1860-1867. doi: 10.1136/heartjnl-2018-314267
[4] 中华医学会心电生理和起搏分会, 中国医师协会心律学专业委员会, 中国房颤中心联盟心房颤动防治专家工作委员会. 心房颤动: 目前的认识和治疗建议(2021)[J]. 中华心律失常学杂志, 2022, 26(1): 15-88. [5] KASHANI K, ROSNER M H, OSTERMANN M. Creatinine: from physiology to clinical application[J]. Eur J Intern Med, 2020, 72: 9-14. doi: 10.1016/j.ejim.2019.10.025
[6] WANG Y N, YANG Y, HE F. Insights into concomitant atrial fibrillation and chronic kidney disease[J]. Rev Cardiovasc Med, 2022, 23(3): 105. doi: 10.31083/j.rcm2303105
[7] PATEL R B, FONAROW G C, GREENE S J, et al. Kidney function and outcomes in patients hospitalized with heart failure[J]. J Am Coll Cardiol, 2021, 78(4): 330-343. doi: 10.1016/j.jacc.2021.05.002
[8] BARASHI R, HORNIK-LURIE T, GABAY H, et al. Renal function and outcome of patients with non-valvular atrial fibrillation[J]. Eur Heart J Acute Cardiovasc Care, 2021, 10(10): 1180-1186. doi: 10.1093/ehjacc/zuab075
[9] 米琴, 郭雪娅. 心房颤动与慢性肾脏病相关性研究[J]. 中华老年心脑血管病杂志, 2019, 21(2): 204-206. doi: 10.3969/j.issn.1009-0126.2019.02.025 [10] RIMMELE D L, BOROF K, JENSEN M, et al. Association between carotid atherosclerosis and atrial fibrillation, cardiac, and renal function[J]. Eur J Vasc Endovasc Surg, 2022, 63(4): 641-647. doi: 10.1016/j.ejvs.2022.01.010
[11] HU Y F, CHEN Y J, LIN Y J, et al. Inflammation and the pathogenesis of atrial fibrillation[J]. Nat Rev Cardiol, 2015, 12(4): 230-243. doi: 10.1038/nrcardio.2015.2
[12] TAPOI L, URECHE C, SASCAU R, et al. Atrial fibrillation and chronic kidney disease conundrum: an update[J]. J Nephrol, 2019, 32(6): 909-917. doi: 10.1007/s40620-019-00630-1
[13] KOZBERG M G, PEROSA V, GUROL M E, et al. A practical approach to the management of cerebral amyloid angiopathy[J]. Int J Stroke, 2021, 16(4): 356-369. doi: 10.1177/1747493020974464
[14] FLORIA M, TANASE D M. Atrial fibrillation type and renal dysfunction: new challenges in thromboembolic risk assessment[J]. Heart, 2019, 105(17): 1295-1297. doi: 10.1136/heartjnl-2019-315212
[15] PARK S, LEE S, KIM Y, et al. Atrial fibrillation and kidney function: a bidirectional Mendelian randomization study[J]. Eur Heart J, 2021, 42(29): 2816-2823. doi: 10.1093/eurheartj/ehab291
[16] VAN DER BURGH A C, GEURTS S, IKRAM M A, et al. Bidirectional association between kidney function and atrial fibrillation: a population-based cohort study[J]. J Am Heart Assoc, 2022, 11(10): e025303. doi: 10.1161/JAHA.122.025303
[17] GENG T T, WANG Y, LU Q, et al. Associations of new-onset atrial fibrillation with risks of cardiovascular disease, chronic kidney disease, and mortality among patients with type 2 diabetes[J]. Diabetes Care, 2022, 45(10): 2422-2429. doi: 10.2337/dc22-0717
[18] 张爱丽, 侯旗旗, 韩全乐, 等. 中国北方人群心房颤动与新发慢性肾脏病发病风险的相关性研究[J]. 中国全科医学, 2023, 26(36): 4521-4526. doi: 10.12114/j.issn.1007-9572.2023.0006 [19] DING W Y, GUPTA D, WONG C F, et al. Pathophysiology of atrial fibrillation and chronic kidney disease[J]. Cardiovasc Res, 2021, 117(4): 1046-1059. doi: 10.1093/cvr/cvaa258
[20] LÓPEZ-GALVEZ R, RIVERA-CARAVACA J M, ROLDÁN V, et al. Imaging in atrial fibrillation: a way to assess atrial fibrosis and remodeling to assist decision-making[J]. Am Heart J, 2023, 258: 1-16. doi: 10.1016/j.ahj.2022.12.007
[21] THOMAS L, ABHAYARATNA W P. Left atrial reverse remodeling: mechanisms, evaluation, and clinical significance[J]. JACC Cardiovasc Imaging, 2017, 10(1): 65-77. doi: 10.1016/j.jcmg.2016.11.003
[22] MILLS H, ESPERSEN K, JURLANDER R, et al. Prevention of sudden cardiac death in hypertrophic cardiomyopathy: risk assessment using left atrial diameter predicted from left atrial volume[J]. Clin Cardiol, 2020, 43(6): 581-586. doi: 10.1002/clc.23351
[23] THOMAS L, MURARU D, POPESCU B A, et al. Evaluation of left atrial size and function: relevance for clinical practice[J]. J Am Soc Echocardiogr, 2020, 33(8): 934-952. doi: 10.1016/j.echo.2020.03.021
[24] BEYER C, TOKARSKA L, STÜHLINGER M, et al. Structural cardiac remodeling in atrial fibrillation[J]. JACC Cardiovasc Imaging, 2021, 14(11): 2199-2208. doi: 10.1016/j.jcmg.2021.04.027
[25] GOETTE A, LENDECKEL U. Atrial cardiomyopathy: pathophysiology and clinical consequences[J]. Cells, 2021, 10(10): 2605. doi: 10.3390/cells10102605
[26] NGUYEN H T T, DO C V, DANG D T V, et al. Progressive alterations of left atrial and ventricular volume and strain across chronic kidney disease stages: a speckle tracking echocardiography study[J]. Front Cardiovasc Med, 2023, 10: 1197427. doi: 10.3389/fcvm.2023.1197427
[27] CHEN S C, CHANG J M, TSAI Y C, et al. Left atrial diameter and albumin with renal outcomes in chronic kidney disease[J]. Int J Med Sci, 2013, 10(5): 575-584. doi: 10.7150/ijms.5845
[28] HUANG T H, CHIU H, WU P Y, et al. The association of echocardiographic parameters on renal outcomes in chronic kidney disease[J]. Ren Fail, 2021, 43(1): 433-444. doi: 10.1080/0886022X.2021.1885444
[29] HU L L, XIONG Q M, CHEN Z Q, et al. Factors associated with a large decline in renal function or progression to renal insufficiency in hospitalized atrial fibrillation patients with early-stage CKD[J]. Int Heart J, 2020, 61(2): 239-248. doi: 10.1536/ihj.19-205
-
期刊类型引用(2)
1. 王元,纪俊霞,段伟刚,王岩. 中医药在心房颤动上游治疗中的应用及机制研究进展. 中国民间疗法. 2024(19): 100-103 .  百度学术
百度学术
2. 吴春蕾,杨盼,徐敏,李瑛,王跃涛. 心电图P波离散度及Ⅱ导联P波峰值时间对原发性高血压患者新发心房颤动的预测价值. 实用临床医药杂志. 2024(22): 21-25 .  本站查看
本站查看
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号