Regulatory role and mechanism of mitochondrial ribosomal protein S35 in proliferation, invasion, and migration of colon cancer cells
-
摘要:目的
探讨线粒体核糖体蛋白S35(MRPS35)对结肠癌细胞增殖、侵袭和迁移的调控作用及机制。
方法收集120例结肠癌根治术患者的结肠癌组织及癌旁正常组织标本, 培养人结肠癌细胞系(HCT116、SW480、SW620)和人正常结肠上皮细胞系(NCM460)。通过生物信息学分析、实时荧光定量聚合酶链反应、蛋白质印迹法(Western blot)、免疫组织化学(IHC)分析、细胞功能实验(平板克隆形成实验、划痕实验、Transwell细胞迁移实验、CCK-8细胞活力实验)等方法评估MRPS35在结肠癌中的表达及调控机制。
结果生物信息学分析结果显示, MRPS35基因在结直肠癌组织中的表达水平高于癌旁正常组织,差异有统计学意义(P < 0.05)。人结肠癌细胞系(HCT116、SW480、SW620)中MRPS35 mRNA和MRPS35蛋白相对表达量均高于NCM460细胞,差异有统计学意义(P < 0.05); 结肠癌组织中的MRPS35蛋白相对表达量高于癌旁正常组织,差异有统计学意义(P < 0.05)。MRPS35表达水平与肿瘤直径、肿瘤分化程度、T分期显著相关(P=0.002、0.021、0.036)。MRPS35高表达患者的总体生存率高于MRPS35低表达患者,差异有统计学意义(Log-rank P=0.015)。敲低MRPS35后,结肠癌细胞克隆、增殖、侵袭、迁移能力均显著增强。敲低MRPS35后, Wnt1、β-Catenin及其下游靶标蛋白的表达显著增加。
结论MRPS35在结肠癌组织和结肠癌细胞中均显著高表达,其可能通过调控Wnt/β-Catenin信号通路抑制结肠癌的发生与发展,有望成为结肠癌的新型生物标志物和潜在治疗靶点。
-
关键词:
- 线粒体核糖体蛋白S35 /
- Wnt/β-Catenin信号通路 /
- 结肠癌细胞 /
- 增殖 /
- 侵袭 /
- 迁移
Abstract:ObjectiveTo investigate the regulatory role and mechanism of mitochondrial ribosomal protein S35 (MRPS35) in the proliferation, invasion, and migration of colon cancer cells.
MethodsA total of 120 colon cancer tissues and adjacent normal tissues from patients undergoing radical resection for colon cancer were collected. Human colon cancer cell lines (HCT116, SW480, SW620) and a human normal colon epithelial cell line (NCM460) were cultured. Bioinformatics analysis, real-time quantitative polymerase chain reaction, Western blot, immunohistochemical (IHC) analysis, and cellular functional experiments (plate clone formation assay, scratch test, Transwell migration assay, CCK-8 cell viability assay) were conducted to evaluate the expression and regulatory mechanism of MRPS35 in colon cancer.
ResultsBioinformatics analysis showed that the expression level of the MRPS35 gene was higher in colorectal cancer tissues than in adjacent normal tissues (P < 0.05). The relative expression levels of MRPS35 mRNA and MRPS35 protein were higher in human colon cancer cell lines (HCT116, SW480, SW620) than in NCM460 cells (P < 0.05). The relative expression level of MRPS35 protein was higher in colon cancer tissues than that in adjacent normal tissues (P < 0.05). The expression level of MRPS35 was significantly correlated with tumor diameter, tumor differentiation, and T stage (P=0.002, 0.021, 0.036). Patients with high MRPS35 expression had a higher overall survival rate than those with low MRPS35 expression (Log-rank P=0.015). After knockdown of MRPS35, the abilities of colon cancer cell cloning, proliferation, invasion, and migration were significantly enhanced. Furthermore, the expression of Wnt1, β-Catenin, and their downstream target proteins increased significantly after MRPS35 knockdown.
ConclusionMRPS35 is significantly overexpressed in both colon cancer tissues and colon cancer cells, and it may inhibit the occurrence and development of colon cancer by regulating the Wnt/β-Catenin signaling pathway. Therefore, MRPS35 has the potential to become a novel biomarker and therapeutic target for colon cancer.
-
2020年全球癌症统计数据[1]显示,结肠癌在全球新发癌症病例中排名第3, 在癌症相关死亡中排名第2。近年来,中国的结直肠癌发病率呈逐年上升趋势,严重威胁居民健康[2]。5%~10%的结肠癌患者在初次手术时即存在腹膜转移, 4%~19%的患者在根治性手术后随访期间发生腹膜转移,40%~80%的患者最终因结直肠癌腹膜转移而死亡[3]。因此,寻找结肠癌早期诊断标志物并深入探讨其发病机制及干预策略具有重要意义。基因组不稳定性是促进癌症发展的关键因素之一,其影响线粒体能量代谢和细胞凋亡过程。线粒体核糖体蛋白(MRPs)由核基因MRP家族编码,是线粒体翻译过程中不可或缺的组成部分。既往研究[4]发现,超过40种MRPs在癌症中呈现高表达,并作为调控癌细胞活力的关键因子。LI X等[5]研究发现,线粒体核糖体蛋白L52(MRPL52)在乳腺癌中上调,且具有与凋亡抗性和转移促进相关的致癌作用。此外,部分MRPs被视为肿瘤抑制因子,例如线粒体核糖体蛋白L41(MRPL41)在癌症中表达下调[6]。尽管MRPs家族成员在癌症的发生和发展中发挥重要作用,但其在结肠癌预后评估中的价值仍需进一步明确。本研究探讨线粒体核糖体蛋白S35(MRPS35)对结肠癌细胞增殖、侵袭和迁移的调控作用及机制,现报告如下。
1. 对象与方法
1.1 研究对象
选取2020年8月—2023年2月在扬州大学附属苏北人民医院接受结肠癌根治术的120例患者作为研究对象。患者平均年龄为(67.3±5.2)岁; 男99例,女21例; 肿瘤分化程度为中高分化67例,低分化53例; 肿瘤直径 < 5 cm 77例, ≥5 cm 43例; T分期为T1~T2期68例, T3~T4期52例; N分期为N0期(无淋巴结转移)67例, N1~N2期(淋巴结转移)53例; M分期为M0期(无远处转移)111例, M1期(远处转移)9例。收集所有患者的病理标本(所有手术切除标本均经病理证实为结肠腺癌),共计120对,每对标本包括1份结肠癌组织和1份距癌组织边缘5 cm的癌旁正常组织。术中标本在离体后立即使用液氮冻存,并迅速转移至实验室的-80 ℃冰箱中保存。
1.2 细胞系和主要试剂
人结肠癌细胞系(HCT116、SW480、SW620)、人正常结肠上皮细胞系(NCM460)购自海星生物公司; 胰蛋白酶、胎牛血清(FBS)及RPMI-1640培养基购自美国Gibco公司; 聚合酶链反应(PCR)引物由安升达生命科学公司设计并合成,引物序列见表 1; 小干扰RNA(siRNA)由吉玛基因公司设计并合成; Lipofectamine 2000转染试剂(Lip 2000)购自赛默飞世尔科技公司; 反转录试剂盒、实时荧光定量PCR试剂盒购自赛默飞世尔科技公司; MRPS35抗体、Wnt1抗体、Wnt3抗体、β-catenin抗体、磷酸化β-catenin(p-β-catenin)抗体购自武汉三鹰生物技术公司; 内参Tubulin抗体及兔鼠二抗购自爱博泰克(Abclonal)公司。
表 1 PCR引物序列基因 正向引物(5′→3′) 反向引物(5′→3′) MRPS35 GCCCAGAACCCATTTCCTTGAC GGACCTGTTTCTAACCAGAGTTGAC β-actin ATCGTGCGTGACATTAAGGAGAAG AGGAAGGAAGGCTGGAAGAGTG 1.3 方法
1.3.1 生物信息学分析
从癌症基因组图谱(TCGA)数据库下载结肠癌及其配对癌旁正常组织的基因表达数据,使用DESeq2软件进行差异表达分析,筛选出结肠癌中上调的基因。通过DAVID数据库进行功能注释和基因本体论(GO)富集分析,并通过京都基因与基因组百科全书(KEGG)数据库进行通路富集分析,以确认MRPS35在结肠癌中的表达差异及其可能的功能和参与的信号通路。
1.3.2 细胞培养
将HCT116、SW480、SW620和NCM460细胞系培养于含有10%(体积分数)FBS的RPMI-1640培养基中,培养条件为37 ℃、5%(体积分数)CO2, 湿度95%。每2~3 d更换1次培养基,当细胞汇合度达到80%~90%时,按1∶ 2至1: 3的比例进行传代。
1.3.3 实时荧光定量PCR
使用RNA-easy试剂提取细胞总RNA,随后使用反转录试剂盒将1 μg RNA逆转录为cDNA。实时荧光定量PCR的反应体系总体积为20.0 μL, 包含SYBR Green混合液10.0 μL、2种引物(10 μmol/L)各0.4 μL、cDNA模板1.0 μL和去离子水8.2 μL。PCR循环参数设置为95 ℃预变性10 min, 随后进行40个循环(每个循环包括95 ℃ 15 s和60 ℃ 1 min)。基因相对表达量使用2-ΔΔCt方法计算,内参基因为Tubulin。
1.3.4 蛋白质印迹法(Western blot)
提取细胞总蛋白,使用RIPA裂解液(Beyotime)并加入蛋白酶抑制剂PMSF, 于冰上裂解30 min, 随后以12 000 r/min离心10 min, 取上清。采用BCA法(Beyotime)测定蛋白浓度,取30 μg蛋白样品,加入5×蛋白上样缓冲液, 95 ℃煮沸5 min后进行十二烷酸磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。将蛋白转移至聚偏氟乙烯(PVDF)膜(Millipore), 转膜条件为100 V、90 min。用脱脂奶粉溶液(5 g/dL)在室温下封闭1 h, 分别使用MRPS35(1∶ 1 000)、Wnt1(1∶ 1 000)、Wnt3(1∶ 1 000)、β-catenin(1∶ 1 000)、p-β-catenin(1∶ 1 000)和Tubulin(1∶ 2 000)一抗4 ℃孵育过夜,随后用辣根过氧化物酶(HRP)标记的二抗(1∶ 5 000)在室温下孵育1 h。使用ECL显色液(Bio-Rad)显色,并通过Bio-Rad Gel Doc XR+系统进行成像和分析。
1.3.5 平板克隆形成实验
将转染不同siRNA的HCT116和SW620细胞以500个/孔的密度接种于6孔板中,在含有10%FBS的RPMI-1640培养基中培养14 d, 期间每3 d更换1次培养基。培养结束后,用4%(体积分数)多聚甲醛溶液固定细胞20 min, 再用结晶紫(0.1 g/dL)染色15 min, 以流水冲洗后晾干。使用显微镜观察并计数形成的细胞克隆群,每个克隆群至少包含50个细胞。
1.3.6 细胞划痕实验
将细胞培养至90%融合度,使用无菌枪头在细胞单层上划出划痕,用磷酸盐缓冲液(PBS)轻轻清洗2次以去除细胞碎片。加入不含血清的培养基,继续培养24 h。分别于0 h和24 h时用显微镜拍摄划痕的愈合情况,并应用ImageJ软件测量划痕面积,计算细胞迁移率。
1.3.7 Transwell细胞迁移实验
将细胞以5×104个/孔的密度接种于Transwell上室(8 μm孔径, Corning), 上室加入200 μL无血清培养基,下室加入含10%FBS的600 μL培养基,在37 ℃、5%CO2条件下培养24 h。用4%多聚甲醛溶液固定迁移至下室的细胞20 min, 用结晶紫(0.1 g/dL)染色15 min。随后用显微镜观察并计数迁移至下室的细胞数量,随机选择5个视野进行计数,计算平均值。
1.3.8 CCK-8细胞活力实验
将细胞以2×103个/孔的密度接种于96孔板中,每组设5个复孔,在含10%FBS的RPMI-1640培养基中培养。分别于0、24、48、72、96 h时点加入10 μL CCK-8试剂(Dojindo), 37 ℃孵育2 h后测定每孔450 nm处光密度(OD450 nm)值,绘制细胞生长曲线并评估细胞增殖能力。
1.4 统计学分析
所有数据均采用SPSS 27.0统计学软件进行分析。符合正态分布的计量资料以( ±s)表示,计数资料以频数和百分比[n(%)]表示。2组间计量资料的比较采用独立样本t检验,多组间计量资料的比较采用单因素方差分析(ANOVA), 事后多重比较采用LSD法。不符合正态分布的计量资料采用非参数检验(Mann-Whitney U检验或Kruskal-Wallis检验)。采用Kaplan-Meier法绘制生存曲线,并通过Log-rank检验比较生存率,采用Cox比例风险回归模型分析预后的独立影响因素。根据数据分布特点,选用Pearson相关系数或Spearman秩相关系数进行相关性分析。实验数据基于至少3次独立实验的结果,取平均值进行统计学分析,组间差异比较采用独立样本t检验。所有统计学分析均为双侧检验, P < 0.05表示差异具有统计学意义。所有图表采用GraphPad Prism 9.0软件绘制。对于CCK-8细胞活力实验和Transwell细胞迁移实验等多时点的重复测量数据,采用重复测量的方差分析进行处理。
2. 结果
2.1 MRPS35 基因筛选
本研究分析MRPs基因家族在消化道肿瘤等常见肿瘤中的表达情况发现,与其他家族成员相比, MRPS35 基因在消化道肿瘤组织中的表达水平显著升高,见图 1; 基于TCGA数据库的泛癌分析结果显示, MRPS35 基因在多种癌组织中表达上调,见图 2; 此外, TCGA数据库数据显示, MRPS35 基因在结直肠癌组织中的表达水平高于癌旁正常组织,差异有统计学意义(P < 0.05), 见图 3。
![]() 图 2 基于TCGA数据库分析MRPS35基因在泛癌组织中的表达情况BLCA: 膀胱癌; BRCA: 乳腺癌易感基因; CESC: 宫颈鳞状细胞癌; CHOL: 胆管癌; COAD: 结肠腺癌; ESCA: 食管癌; GBM: 胶质母细胞瘤; HNSC: 头颈部鳞状细胞癌; KICH: 肾嫌色细胞癌; KIRC: 肾透明细胞癌; KIRP: 肾乳头状细胞癌; LIHC: 肝细胞肝癌; LUAD: 肺腺癌; LUSC: 肺鳞状细胞癌; PAAD: 胰腺腺癌; PRAD: 前列腺腺癌; PCPG: 嗜铬细胞瘤和副神经节瘤; READ: 直肠腺癌; SARC: 肉瘤; SKCM: 皮肤黑色素瘤; THCA: 甲状腺癌; THYM: 胸腺瘤; STAD: 胃腺癌; UCEC; 子宫内膜癌。蓝色表示癌旁正常组织,红色表示癌组织。
图 2 基于TCGA数据库分析MRPS35基因在泛癌组织中的表达情况BLCA: 膀胱癌; BRCA: 乳腺癌易感基因; CESC: 宫颈鳞状细胞癌; CHOL: 胆管癌; COAD: 结肠腺癌; ESCA: 食管癌; GBM: 胶质母细胞瘤; HNSC: 头颈部鳞状细胞癌; KICH: 肾嫌色细胞癌; KIRC: 肾透明细胞癌; KIRP: 肾乳头状细胞癌; LIHC: 肝细胞肝癌; LUAD: 肺腺癌; LUSC: 肺鳞状细胞癌; PAAD: 胰腺腺癌; PRAD: 前列腺腺癌; PCPG: 嗜铬细胞瘤和副神经节瘤; READ: 直肠腺癌; SARC: 肉瘤; SKCM: 皮肤黑色素瘤; THCA: 甲状腺癌; THYM: 胸腺瘤; STAD: 胃腺癌; UCEC; 子宫内膜癌。蓝色表示癌旁正常组织,红色表示癌组织。2.2 人结肠癌细胞系与人正常结肠上皮细胞系中 MRPS35 mRNA表达比较
实时荧光定量PCR检测结果显示,人结肠癌细胞系(HCT116、SW480、SW620)中 MRPS35 mRNA相对表达量均高于人正常结肠上皮细胞系NCM460, 差异有统计学意义(P < 0.000 1), 进一步验证了 MRPS35 基因在结肠癌中高表达,见图 4。
2.3 人结肠癌细胞系、人正常结肠黏膜细胞系中MRPS35蛋白表达比较
Western blot检测结果显示,人结肠癌细胞系(HCT116、SW480、SW620)中MRPS35蛋白相对表达量高于人正常结肠上皮细胞系NCM460, 差异有统计学意义(P < 0.05或P < 0.01), 见图 5。
2.4 结肠癌组织与癌旁正常组织中MRPS35蛋白表达比较
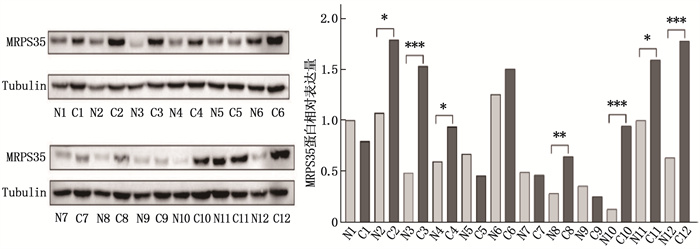
Western blot检测结果显示,结肠癌组织中的MRPS35蛋白相对表达量高于癌旁正常组织,差异有统计学意义(P < 0.05或P < 0.01或P < 0.001), 进一步验证了MRPS35蛋白在结肠癌中高表达,见图 6。
2.5 120例结肠癌患者组织芯片中MRPS35阳性表达情况
通过免疫组织化学(IHC)方法检测120例结肠癌患者组织芯片中MRPS35阳性表达情况,结果显示, MRPS35在结肠癌组织中的阳性表达率为85.0%(102/120), 高于癌旁正常组织的40.0%(48/120), 差异有统计学意义(P < 0.05), 见图 7。
2.6 MRPS35表达水平与结肠癌患者临床特征的关系
按照MRPS35表达水平,将120例结肠癌患者分为MRPS35高表达组77例和MRPS35低表达组43例。2组患者的临床特征比较结果显示, MRPS35表达水平与肿瘤直径、肿瘤分化程度、T分期显著相关(P=0.002、0.021、0.036), 但与患者年龄、性别、淋巴结转移(N分期)和远处转移(M分期)无关(P>0.05), 见表 2。
表 2 不同MRPS35表达水平结肠癌患者的临床特征比较[n(%)]临床特征 分类 n MRPS35高表达组(n=77) MRPS35低表达组(n=43) P 年龄 < 65岁 37 24(31.2) 13(30.2) 0.975 ≥65岁 83 53(68.8) 30(69.8) 性别 男 99 60(77.9) 39(90.7) 0.204 女 21 17(22.1) 4(9.3) 肿瘤直径 < 5 cm 77 50(64.9) 27(62.8) 0.002 ≥5 cm 43 27(35.1) 16(37.2) 肿瘤分化程度 中高分化 67 45(58.4) 22(51.2) 0.021 低分化 53 32(41.6) 21(48.8) T分期 T1~T2期 68 45(58.4) 23(53.5) 0.036 T3~T4期 52 32(41.6) 20(46.5) N分期 N0期 67 43(55.8) 24(55.8) 0.624 N1~N2期 53 34(44.2) 19(44.2) M分期 M0期 111 70(90.9) 41(95.3) 0.447 M1期 9 7(9.1) 2(4.7) 2.7 结肠癌组织中MRPS35表达水平对患者生存预后的影响
基于TCGA数据库中资料,本研究对结直肠癌患者进行Kaplan-Meier生存分析和Log-rank检验。分析结果显示, MRPS35高表达患者(n=326)的总体生存率高于MRPS35低表达患者(n=37), 差异有统计学意义(Log-rank P=0.015), 见图 8。
2.8 敲低MRPS35对结肠癌细胞系增殖、侵袭和迁移能力的影响
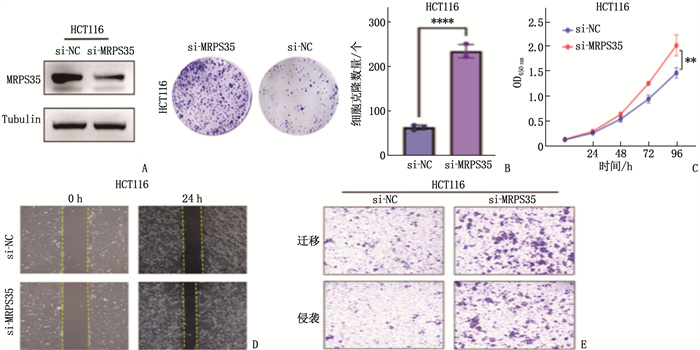
应用siRNA在结肠癌细胞系HCT116中敲低MRPS35后(图 9A), 平板克隆形成实验、CCK-8实验、划痕实验、Transwell实验结果显示, HCT116细胞克隆、增殖、侵袭、迁移能力均显著增强,见图 9B~E。
2.9 MRPS35表达水平对下游通路的影响
本研究基于TCGA数据库,对MRPS35高表达和低表达的结肠癌患者进行分组,并进行差异基因表达分析和KEGG通路富集分析,结果显示, MRPS35高表达组样本中Wnt/β-Catenin信号通路相关基因的表达显著下调,且MRPS35可能通过抑制Wnt/β-Catenin信号通路而抑制结肠癌的发生与发展(图 10A)。
为进一步验证这一假设,本研究通过Western blot检测Wnt/β-Catenin信号通路关键蛋白的表达情况,结果显示,敲低MRPS35后,Wnt1、β-Catenin及其下游靶标蛋白的表达显著增加(图 10B)。
3. 讨论
2020年,中国结直肠癌新发病例达55万例,发病率和致死率在恶性肿瘤中均位居前列[7]。随着结直肠癌基础研究的不断深入,新型靶向药物和免疫检查点抑制剂不断被开发,显著改善了患者的预后[8]。因此,探索结肠癌发生发展的分子机制对相关药物的研发及结肠癌的特异化治疗具有重要意义。
癌细胞严重依赖线粒体氧化磷酸化(OXPHOS) 系统提供能量,而MRPs是OXPHOS系统[9]的关键调节因子,参与构成OXPHOS酶复合物,并与活性氧(ROS)的生成有关[10]。因此, MRPs在肿瘤转化进程中发挥关键作用,其中高水平MRPL13可促进肝癌细胞侵袭[11], MRPL9对肝癌具有积极的预后价值[12], MRPS35可作为胃癌诊断的潜在分子标志物[13], 而高表达的MRPS23可预测肿瘤的不良预后[14]。恶性肿瘤中MRPs的上调可能与“War-burg效应”有关,即癌细胞在缺氧条件下表现出高糖酵解率的现象[15]。通过增强糖酵解ATP供应、PTEN失活和激活蛋白激酶B(Akt)活性[16], MRPs促进了癌性代谢改变。相反的,一些MRPs可通过调控p21WAF1/CIP1、p27Kip1和p53来延缓细胞周期进程,并诱导细胞凋亡[14, 17-18]。
本研究通过分析MRPs基因家族在消化道肿瘤中的差异表达,筛选出结肠癌中表达最高的 MRPS35 基因作为研究对象。基于TCGA数据库,本研究构建了 MRPS35 基因在泛癌组织中的差异表达矩阵,发现 MRPS35 基因在大多数泛癌组织及其对应癌旁正常组织中均存在差异表达,且 MRPS35 基因在结直肠癌组织中的表达水平显著高于癌旁正常组织。本研究进一步通过多项实验发现, MRPS35在人结肠癌细胞系和结肠癌组织中均显著高表达,与TCGA数据库分析结果相符。目前,结肠癌组织中MRPS35表达上调的具体机制尚不明确,但可能与N6-甲基腺苷修饰增强了MRPS35的稳定性有关。
本研究还发现, MRPS35表达水平与肿瘤分期显著相关,提示MRPS35可能作为一种抑癌因子发挥作用。研究[19]显示, MRPS35可促进抑癌基因 p21、p27 表达,进而抑制肿瘤细胞增殖,还可促进E-钙黏蛋白表达,抑制肿瘤细胞上皮-间质转化,进而抑制肿瘤细胞的迁移和侵袭能力。本研究采用IHC方法检测120例结肠癌患者组织芯片中MRPS35的表达情况,发现MRPS35在结肠癌组织中的阳性表达率显著高于癌旁正常组织,且MRPS35高表达组的肿瘤直径较小、分化程度较好、分期较早。由此提示, MRPS35可能具有抑制结肠癌侵袭和转移的作用,或可成为结肠癌的新型预后评估标志物。
为了验证MRPS35在结肠癌中的作用,本研究利用siRNA敲低了结肠癌细胞中的MRPS35表达,并通过平板克隆形成实验、CCK-8实验、划痕实验、Transwell实验发现结肠癌细胞克隆、增殖、侵袭、迁移能力均增强,表明 MRPS35 基因具有抑癌作用。本研究进一步对TCGA数据库中MRPS35高表达、低表达患者进行分组及KEGG通路富集分析,发现MRPS35可能调控Wnt/β-Catenin信号通路。Wnt信号通路参与多个发育过程,包括细胞增殖、干细胞自我更新和细胞分化[20]。Wnt/β-Catenin通路与肿瘤干细胞的产生及自我更新密切相关,且在肠道干细胞和结直肠癌干细胞的生理过程中具有重要的生物学功能[21]。本研究还发现,敲低结肠癌细胞系的MRPS35表达后,Wnt1、β-Catenin及其下游靶标蛋白的表达显著增加,提示MRPS35可能通过抑制Wnt/β-Catenin信号通路抑制结肠癌细胞的增殖和迁移。
综上所述, MRPS35在结肠癌组织和人结肠癌细胞系中均显著高表达,敲低MRPS35后,结肠癌细胞的增殖、侵袭和迁移能力显著增强。MRPS35可能通过调控Wnt/β-Catenin信号通路抑制结肠癌的发生与发展,有望成为结肠癌的新型生物标志物和潜在治疗靶点。
-
图 2 基于TCGA数据库分析MRPS35基因在泛癌组织中的表达情况
BLCA: 膀胱癌; BRCA: 乳腺癌易感基因; CESC: 宫颈鳞状细胞癌; CHOL: 胆管癌; COAD: 结肠腺癌; ESCA: 食管癌; GBM: 胶质母细胞瘤; HNSC: 头颈部鳞状细胞癌; KICH: 肾嫌色细胞癌; KIRC: 肾透明细胞癌; KIRP: 肾乳头状细胞癌; LIHC: 肝细胞肝癌; LUAD: 肺腺癌; LUSC: 肺鳞状细胞癌; PAAD: 胰腺腺癌; PRAD: 前列腺腺癌; PCPG: 嗜铬细胞瘤和副神经节瘤; READ: 直肠腺癌; SARC: 肉瘤; SKCM: 皮肤黑色素瘤; THCA: 甲状腺癌; THYM: 胸腺瘤; STAD: 胃腺癌; UCEC; 子宫内膜癌。蓝色表示癌旁正常组织,红色表示癌组织。
表 1 PCR引物序列
基因 正向引物(5′→3′) 反向引物(5′→3′) MRPS35 GCCCAGAACCCATTTCCTTGAC GGACCTGTTTCTAACCAGAGTTGAC β-actin ATCGTGCGTGACATTAAGGAGAAG AGGAAGGAAGGCTGGAAGAGTG 表 2 不同MRPS35表达水平结肠癌患者的临床特征比较[n(%)]
临床特征 分类 n MRPS35高表达组(n=77) MRPS35低表达组(n=43) P 年龄 < 65岁 37 24(31.2) 13(30.2) 0.975 ≥65岁 83 53(68.8) 30(69.8) 性别 男 99 60(77.9) 39(90.7) 0.204 女 21 17(22.1) 4(9.3) 肿瘤直径 < 5 cm 77 50(64.9) 27(62.8) 0.002 ≥5 cm 43 27(35.1) 16(37.2) 肿瘤分化程度 中高分化 67 45(58.4) 22(51.2) 0.021 低分化 53 32(41.6) 21(48.8) T分期 T1~T2期 68 45(58.4) 23(53.5) 0.036 T3~T4期 52 32(41.6) 20(46.5) N分期 N0期 67 43(55.8) 24(55.8) 0.624 N1~N2期 53 34(44.2) 19(44.2) M分期 M0期 111 70(90.9) 41(95.3) 0.447 M1期 9 7(9.1) 2(4.7) -
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. doi: 10.3322/caac.21660
[2] FIDLER M M, SOERJOMATARAM I, BRAY F. A global view on cancer incidence and national levels of the human development index[J]. Int J Cancer, 2016, 139(11): 2436-2446. doi: 10.1002/ijc.30382
[3] KOPPE M J, BOERMAN O C, OYEN W J, et al. Peritoneal carcinomatosis of colorectal origin: incidence and current treatment strategies[J]. Ann Surg, 2006, 243(2): 212-222. doi: 10.1097/01.sla.0000197702.46394.16
[4] LIN X Y, GUO L J, LIN X, et al. Expression and prognosis analysis of mitochondrial ribosomal protein family in breast cancer[J]. Sci Rep, 2022, 12: 10658. doi: 10.1038/s41598-022-14724-7
[5] LI X, WANG M, LI S, et al. HIF-1-induced mitochondrial ribosome protein L52: a mechanism for breast cancer cellular adaptation and metastatic initiation in response to hypoxia[J]. Theranostics, 2021, 11(15): 7337-7359. doi: 10.7150/thno.57804
[6] CHARAFE-JAUFFRET E, GINESTIER C, IOVINO F, et al. Breast cancer cell lines contain functional cancer stem cells with metastatic capacity and a distinct molecular signature[J]. Cancer Res, 2009, 69(4): 1302-1313. doi: 10.1158/0008-5472.CAN-08-2741
[7] SIEGEL R L, MILLER K D, GODING SAUER A, et al. Colorectal cancer statistics, 2020[J]. CA A Cancer J Clinicians, 2020, 70(3): 145-164. doi: 10.3322/caac.21601
[8] BAI Z, XIA X, LU J. microRNA-639 is down-regulated in hepatocellular carcinoma tumor tissue and inhibits proliferation and migration of human hepatocellular carcinoma cells through the KAT7/wnt/β-catenin pathway[J]. Med Sci Monit, 2020, 26: e919241.
[9] YUAN Y, JU Y S, KIM Y, et al. Comprehensive molecular characterization of mitochondrial genomes in human cancers[J]. Nat Genet, 2020, 52: 342-352. doi: 10.1038/s41588-019-0557-x
[10] 3LIU L, LUO C, LUO Y, et al. MRPL33 and its splicing regulator hnRNPK are required for mitochondria function and implicated in tumor progression[J]. Oncogene, 2018, 37(1): 86-94. doi: 10.1038/onc.2017.314
[11] LEE Y K, LIM J J, JEOUN U W, et al. Lactate-mediated mitoribosomal defects impair mitochondrial oxidative phosphorylation and promote hepatoma cell invasiveness[J]. J Biol Chem, 2017, 292(49): 20208-20217. doi: 10.1074/jbc.M117.809012
[12] TANG B, ZHU J, ZHAO Z, et al. Diagnosis and prognosis models for hepatocellular carcinoma patient's management based on tumor mutation burden[J]. J Adv Res, 2021, 33: 153-165. doi: 10.1016/j.jare.2021.01.018
[13] 黄灿坡, 王琳, 林建泉, 等. circMRPS35和KAT7在胃癌组织中的表达及预后评估价值[J]. 国际检验医学杂志, 2022, 43(23): 2846-2851. [14] PU M, WANG J L, HUANG Q K, et al. High MRPS23 expression contributes to hepatocellular carcinoma proliferation and indicates poor survival outcomes[J]. Tumour Biol, 2017, 39(7): 101042831770912.
[15] WANG X, PERALTA S, MORAES C T. Mitochondrial alterations during carcinogenesis: a review of metabolic transformation and targets for anticancer treatments[J]. Adv Cancer Res, 2013, 119: 127-160.
[16] PIAO L, LI Y, KIM S J, et al. Association of LETM1 and MRPL36 contributes to the regulation of mitochondrial ATP production and necrotic cell death[J]. Cancer Res, 2009, 69(8): 3397-3404. doi: 10.1158/0008-5472.CAN-08-3235
[17] CHEN Y C, CHANG M Y, SHIAU A L, et al. Mitochondrial ribosomal protein S36 delays cell cycle progression in association with p53 modification and p21(WAF1/CIP1) expression[J]. J Cell Biochem, 2007, 100(4): 981-990. doi: 10.1002/jcb.21079
[18] YOO Y A, KIM M J, PARK J K, et al. Mitochondrial ribosomal protein L41 suppresses cell growth in association with p53 and p27Kip1[J]. Mol Cell Biol, 2005, 25(15): 6603-6616. doi: 10.1128/MCB.25.15.6603-6616.2005
[19] TANIUE K, HAYASHI T, KAMOSHIDA Y, et al. UHRF1-KAT7-mediated regulation of TUSC3 expression via histone methylation/acetylation is critical for the proliferation of colon cancer cells[J]. Oncogene, 2020, 39: 1018-1030. doi: 10.1038/s41388-019-1032-y
[20] CLEVERS H. Wnt/beta-catenin signaling in development and disease[J]. Cell, 2006, 127(3): 469-480. doi: 10.1016/j.cell.2006.10.018
[21] KRAUSOVA M, KORINEK V. Wnt signaling in adult intestinal stem cells and cancer[J]. Cell Signal, 2014, 26(3): 570-579.




 下载:
下载:








 苏公网安备 32100302010246号
苏公网安备 32100302010246号