Mechanism of liver-soothing and stomach-harmonizing recipe alleviating airway inflammation in rats with gastroesophageal reflux disease by regulating PPAR-γ/RXR signaling pathway
-
摘要:目的
探讨疏肝和胃方通过调控过氧化物酶体增殖物激活受体γ/类视黄醇X受体(PPAR-γ/RXR)信号通路缓解胃食管反流病(GERD)大鼠气道炎症的机制。
方法采用食管下端盐酸灌注法构建GERD合并气道炎症大鼠模型。将50只SD雄性大鼠随机分为对照组、模型组、疏肝和胃方低剂量组(10.49 g/kg生药量)、疏肝和胃方高剂量组(20.98 g/kg生药量)和奥美拉唑组(3.67 mg/kg), 每组10只, 灌胃14 d。采用苏木精-伊红(HE)染色观察气管组织的病理学变化; 采用RT-qPCR检测支气管肺泡灌洗液中炎症因子[白细胞介素(IL)-17、IL-33、诱导型一氧化氮合酶(iNOS)]以及抗炎因子[IL-10、克拉拉细胞蛋白16(CC16)、表面活性蛋白-D(SP-D)]的mRNA表达水平; 采用免疫印迹法检测PPAR-γ、RXR-α、核因子-κB(NF-κB)、活化蛋白-1(AP-1)的蛋白相对表达量。
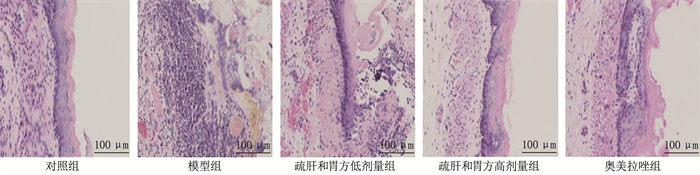
结果HE染色结果显示,模型组可见大量炎症细胞浸润,疏肝和胃方低剂量组、高剂量组和奥美拉唑组炎症细胞浸润明显减少。与对照组比较,模型组支气管肺泡灌洗液中IL-17、IL-33、iNOS的mRNA表达水平升高, IL-10、CC16、SP-D的mRNA表达水平降低, PPAR-γ、RXR-α的蛋白相对表达量升高, NF-κB、AP-1的蛋白相对表达量降低,差异均有统计学意义(P < 0.05)。与模型组比较,疏肝和胃方高剂量组和奥美拉唑组上述指标均有改善,差异有统计学意义(P < 0.05)。
结论疏肝和胃方可以有效缓解GERD大鼠气道炎症,其作用机制可能与激活PPARγ/RXR信号通路有关。
-
关键词:
- 疏肝和胃方 /
- 胃食管反流病 /
- 过氧化物酶体增殖物激活受体 /
- 类视黄醇X受体 /
- 信号通路
Abstract:ObjectiveTo investigate the mechanism of liver-soothing and stomach-harmonizing recipe alleviating airway inflammation in rats with gastroesophageal reflux disease (GERD) by regulating peroxisome proliferator-activated receptor γ/retinoid X receptor (PPAR-γ/RXR) signaling pathway.
MethodsA rat model of GERD with airway inflammation was established by perfusion of hydrochloric acid into the lower esophagus. A total of 50 SD male rats were randomly divided into control group, model group, low-dose liver-soothing and stomach-harmonizing recipe group (10.49 g/kg crude drug dosage), high-dose liver-soothing and stomach-harmonizing recipe group (20.98 g/kg crude drug dosage), and omeprazole group (3.67 mg/kg), with 10 rats in each group. The rats were gavaged for 14 days. Hematoxylin and eosin (HE) staining was used to observe the pathological change in tracheal tissue. RT-qPCR was used to detect the mRNA expression levels of inflammatory cytokines[interleukin (IL)-17, IL-33, inducible nitric oxide synthase (iNOS)]and anti-inflammatory cytokines[IL-10, Clara cell 16-kDa protein (CC16), surfactant protein-D (SP-D)]in bronchoalveolar lavage fluid; the Western blot was used to detect the relative protein expression levels of PPAR-γ, RXR-α, nuclear factor-κB (NF-κB), and activator protein-1 (AP-1).
ResultsThe HE staining results showed that a large number of inflammatory cell infiltrations were observed in the model group, while the inflammatory cell infiltrations were significantly reduced in the low-dose liver-soothing and stomach-harmonizing recipe group, high-dose liver-soothing and stomach-harmonizing recipe group, and omeprazole group. Compared with the control group, the mRNA expression levels of IL-17, IL-33 and iNOS in bronchoalveolar lavage fluid were significantly increased while the mRNA expression levels of IL-10, CC16 and SP-D were significantly decreased in the model group, and the relative protein expression levels of PPAR-γ and RXR-α were significantly increased, while the relative protein expression levels of NF-κB and AP-1 were significantly decreased in the model group (P < 0.05). Compared with the model group, the above indicators were significantly improved in the high-dose liver-soothing and stomach-harmonizing recipe group and omeprazole group (P < 0.05).
ConclusionLiver-soothing and stomach-harmonizing recipe can effectively alleviate airway inflammation in rats with GERD, and its mechanism may be related to the activation of the PPAR-γ/RXR signaling pathway.
-
甲状腺影像报告和数据系统(TI-RADS)在临床上广泛应用,其诊断标准是基于甲状腺结节影像特征[1-2], 不涉及临床危险因素及超声医师的主观判断。在2021年中华医学会超声医学分会提出的中国(超声)甲状腺影像报告和数据系统(C-TI-RADS)分类指南[3-4]中,明确规定超声医师可以修饰TI-RADS分类结果,但在临床实际使用过程中如何修饰,并没有详细规定。甲状腺乳头状癌青年患者趋于活跃,要积极处理,分类可提高;而老年患者发展缓慢,分类可降低,适合主动监测治疗[5]。本研究基于甲状腺临床与超声特征建立预测甲状腺C-TI-RADS分类结果修饰的列线图模型,并分析其临床应用价值,现将结果报告如下。
1. 资料与方法
1.1 一般资料
收集2021年1月—2022年12月在四川省人民医院及四川绵阳四0四医院行甲状腺结节手术切除患者的临床与超声影像资料。纳入标准: ①行甲状腺手术,病理结果明确者; ②术前超声显示甲状腺和颈部淋巴结图像清楚者; ③术前超声报告记录完整准确者; ④基本信息准确者。排除标准: ①行甲状腺手术,但资料不完整者; ②甲状腺术后病理诊断不确切者; ③行甲状腺穿刺活检而未手术切除者; ④术前超声图像不佳而影响判断者。本研究通过伦理委员会的批准[编号: 2023年文章(005)号]。
1.2 临床与超声影像资料分析
四川省人民医院、四川绵阳四0四医院分别由2名超声医学专业初级医师采用双盲法并使用为本研究定制的结构化数据输入表分析超声图像收集的数据,存在分歧时通过协商取得一致结果,所有数据的收集都不考虑最终结果评判。临床数据记录包括患者的性别、年龄,并对年龄进行分组处理。超声影像数据记录内容包括[6]结节大小、数目、实质、回声、钙化、边缘、纵横比、颈部淋巴结(颈部淋巴结包含颈部所有淋巴结,具体实施时按照Ⅰ~Ⅶ区分区)。超声图像分析包括通过计数法对垂直位、实性、极低回声、点状强回声、边缘模糊共5个超声特征进行统分,统分结果参考诊断标准进行C-TI-RADS分类[4](极低回声是与颈前肌肉层回声对比更低的回声)。四川省人民医院2名超声医学专业高级医师采用双盲法结合患者性别、年龄、结节大小、数目、颈部淋巴结和C-TI-RADS分类结果对甲状腺C-TI-RADS分类结果修饰,存在分歧时通过协商取得一致结果,并构建C-TI-RADS分类结果是否需要修饰的列线图预测模型。四川绵阳四0四医院的2名超声医学专业高级医师根据此列线图模型预测本单位C-TI-RADS分类结果是否需要修饰。
1.3 统计学方法
本研究所有试验数据均采用SPSS 26.0和R studio软件进行统计学分析和绘图。计数资料采用[n(%)]表示,组间比较采用χ2检验或Fisher确切概率法。采用单因素回归分析筛选组间差异有统计学意义的预测因子纳入多因素Logistic回归分析中,建立列线图模型并验证。绘制受试者工作特征(ROC)曲线评估模型区分度,模型通过Bootstrap法重抽样1 000次进行内部验证,绘制校准曲线评估模型校准度。P< 0.05(双侧检验)为差异有统计学意义。
2. 结果
2.1 基线资料
本研究训练集中纳入患者841例,平均年龄为(43.6±12.9)岁,其中男234例(27.8%),女607例(72.2%); 甲状腺C-TI-RADS分类修饰发生率为42.1%(354/841),其中老年男性患者较年轻女性患者发生C-TI-RADS分类修饰的概率更大,而甲状腺结节呈多灶、微小结节、颈部淋巴结超声正常者更易发生C-TI-RADS分类修饰, C-TI-RADS分类修饰主要集中在4B类(14.9%)与4C类(18.0%)。外部验证集中纳入患者295例,平均年龄为(44.7±13.5)岁,其中男77例(26.1%), 女218例(73.9%)。甲状腺C-TI-RADS分类修饰发生率为48.1%(142/295), 其中年轻男性患者发生C-TI-RADS分类修饰概率更大,而甲状腺结节呈多灶、微小结节、颈部淋巴结超声正常者同样易发生C-TI-RADS分类修饰, C-TI-RADS分类修饰主要也集中在4B类(15.6%)与4C类(28.1%)。见表 1。
表 1 训练集与外部验证集甲状腺结节患者的临床与超声特征比较[n(%)]临床病理超声特征 分类 训练集 χ2 P 外部验证集 χ2 P 总计(n=841) 修饰(n=354) 非修饰(n=487) 总计(n=295) 修饰(n=142) 非修饰(n=153) 性别 女 607(72.2) 236(66.7) 371(76.2) 9.24 0.002 218(73.9) 96(67.6) 122(79.7) 5.62 0.018 男 234(27.8) 118(33.3) 116(23.8) 77(26.1) 46(32.4) 31(20.3) 年龄 ≤55岁 685(81.5) 256(72.3) 429(88.1) 33.75 <0.001 235(79.7) 123(86.6) 112(73.2) 8.18 0.004 >55岁 156(18.5) 98(27.7) 58(11.9) 60(20.3) 19(13.4) 41(26.8) 结节最大径 ≤10 mm 450(53.5) 246(69.5) 204(41.9) 63.71 <0.001 98(33.2) 61(43.0) 37(24.2) 28.74 <0.001 >10~30 mm 314(37.3) 83(23.4) 231(47.4) 138(46.8) 70(49.3) 68(44.4) >30 mm 77(9.2) 25(7.1) 52(10.7) 59(20.0) 11(7.7) 48(31.3) 结节数目 单灶 598(71.1) 238(67.2) 360(73.9) 4.46 0.035 212(71.9) 93(65.5) 119(77.8) 5.49 0.019 多灶 243(28.9) 116(32.8) 127(26.1) 83(28.1) 49(34.5) 34(22.2) 颈部淋巴结超声异常 否 690(82.0) 331(93.5) 359(73.7) 54.47 <0.001 198(67.1) 85(59.9) 113(73.9) 6.53 0.011 是 151(18.0) 23(6.5) 128(26.3) 97(32.9) 57(40.1) 40(26.1) C-TI-RADS分类 3类 57(6.8) 14(3.9) 43(8.8) 162.80 <0.001 62(21.0) 2(1.4) 60(39.3) 109.29 <0.001 4A类 104(12.4) 54(15.3) 50(10.3) 32(10.8) 8(5.6) 24(15.7) 4B类 145(17.2) 125(35.3) 20(4.1) 50(16.9) 46(32.4) 4(2.6) 4C类 478(56.8) 151(42.7) 327(67.1) 136(46.1) 83(58.5) 53(34.6) 5类 57(6.8) 10(2.8) 47(9.7) 15(5.1) 3(2.1) 12(7.8) 2.2 训练集中单因素及多因素Logistic回归分析结果
单因素分析结果显示,差异有统计学意义的指标有性别、年龄、结节最大径、结节数目、颈部淋巴结超声异常及C-TI-RADS分类,将上述6个预测因子纳入多因素回归分析,结果显示性别、年龄、结节最大径、结节数目、颈部淋巴结超声异常及C-TI-RADS分类均是C-TI-RADS分类修饰发生的独立预测因子(P <0.05)。其中,男性、>55岁、甲状腺结节多灶、结节≤10 mm、颈部淋巴结超声正常、4A~4C类发生C-TI-RADS分类结果修饰的概率较大。见表 2。
表 2 训练集中单因素及多因素Logistic回归分析结果变量 分类 单因素分析 多因素分析 OR(95%CI) P OR(95%CI) P 性别 男性、女性 1.599(1.180~2.167) 0.002 2.152(1.472~3.147) <0.001 年龄 ≤55岁、>55岁 0.353(0.246~0.506) <0.001 0.230(0.145~0.365) <0.001 结节最大径 ≤10 mm 2.508(1.503~4.185) <0.001 4.447(2.166~9.130) <0.001 >10~30 mm 0.747(0.436~1.281) 0.290 1.130(0.565~2.260) 0.729 >30 mm 1 — 1 — 结节数目 多灶、单灶 1.382(1.023~1.865) 0.035 1.595(1.095~2.324) 0.015 颈部淋巴结超声异常 是、否 0.195(0.122~0.311) <0.001 0.328(0.191~0.565) <0.001 C-TI-RADS分类 3类 1.530(0.615~3.805) 0.360 2.428(0.821~7.184) 0.109 4A类 5.076(2.319~11.112) <0.001 7.799(3.192~19.056) <0.001 4B类 29.375(12.811~67.357) <0.001 45.479(17.877~115.703) <0.001 4C类 2.170(1.068~4.411) 0.032 2.961(1.343~6.532) 0.007 5类 1 — 1 — 2.3 列线图模型的构建及评价
基于多因素Logistic回归分析结果,综合性别、年龄、结节最大径、结节数目、颈部淋巴结超声异常及C-TI-RADS分类6个独立预测因子构建列线图模型,将列线图中各预测因子的分值相加所得的总分定位于总分轴上,其所对应的风险系数反映了C-TI-RADS分类结果修饰发生的概率,见图 1。该模型一致性指数(C指数)为0.842(95%CI: 0.816~0.867), ROC曲线的曲线下面积(AUC)为0.842, 模型预测C-TI-RADS分类修饰的最佳截断值为0.292, 相应的敏感度为92.9%, 特异度为63.7%, 准确率为75.9%; 应用1 000次Bootstrap重抽样法对模型进行内部验证,结果显示,列线图模型及其校正模型与理想曲线接近,说明模型的校准度好; 在外部验证集中,运用该模型计算的ROC曲线的AUC为0.869, 基于最佳截断值的敏感度为89.4%, 特异度为69.3%, 准确率为78.9%, 说明该模型具有良好的临床实用性,提高了临床诊断效能。见图 2、图 3、图 4。
3. 讨论
目前,临床上对甲状腺C-TI-RADS分类结果的修饰是建立在超声医师主观经验之上,缺乏统一的临床共识,但性别、年龄、结节大小、结节数目、颈部淋巴结等因素均会改变甲状腺结节治疗的临床决策[7-9], 超声医师在进行C-TI-RADS分类时需考虑上述因素。本研究将这些影响因素全部纳入模型中,男性患者较女性患者、老年人较年轻人发生C-TI-RADS分类结果修饰的概率更高,也符合大部分研究[10-11]显示的男性甲状腺癌患者恶性程度更高、侵袭性更强、复发风险更大,老年甲状腺癌患者病程进展相对缓慢、侵袭性生长相对缓慢的结果;多灶甲状腺结节的C-TI-RADS分类结果较单灶甲状腺结节临床上发生恶性概率不一样,因此需要对C-TI-RADS分类结果修饰; 甲状腺微小结节(≤10 mm)较甲状腺大结节更易发生C-TI-RADS分类结果修饰(29.3%、3.0%), 甲状腺结节较大,最佳处理方式为穿刺活检或手术,而甲状腺微小结节即使是恶性,绝大部分也是恶性程度较低的微小癌[12], 超声医师更倾向降低C-TI-RADS分类结果,从而引导临床减少甲状腺微小结节的穿刺活检或手术; 颈部淋巴结超声正常中39.4%的甲状腺结节患者发生甲状腺C-TI-RADS分类修饰,显著高于颈部淋巴结超声异常的2.7%,其原因是绝大部分甲状腺癌的生物学行为倾向惰性、生长缓慢,在没有出现颈部淋巴结转移时,超声医师倾向降低C-TI-RADS分类结果; 在基于5个恶性征象(实性、极低回声、纵横比>1、微钙化、边缘模糊/不规则或包膜侵犯)构建的C-TI-RADS分类标准中, 4A、4B、4C类发生修饰的概率较高,达39.2%, 其中4B类OR值达45.4, 这符合临床共识中将4B类作为诊断甲状腺结节良恶性的截点[13], 超声医师倾向良性结节就会降低分类(< 4B类),倾向恶性结节就会提高分类(≥4B类)。因此,本研究模型选择预测因子均为与C-TI-RADS分类标准外密切相关的临床危险因素,在超声医师修饰C-TI-RADS分类中具有重要的临床意义。
与其他TI-RADS分类结果修饰的模型相比,本研究在C-TI-RADS分类标准基础上,引入影响超声医师诊断的临床危险因素,更符合超声医师的临床诊断模式。多数研究[14-16]都是基于甲状腺结节超声影像特征建立预测模型,选择预测因子的超声征象数目特征有所不同,基本超声特征有结节位置、大小、实质、回声、形态、边缘、钙化、血流信号和晕征,这些超声特征模型也能避免一部分不必要的甲状腺结节活检,同时保持较高的敏感度和诊断准确性[17]。虽然也有部分预测模型[18-21]是基于TI-RADS分类结合其他影像组学(超声弹性成像、超声造影)、基因检测及实验室指标建立,总体诊断效能较单一TI-RADS分类更准确、更灵敏,但是否符合卫生经济学原则和使患者真正受益还需进一步研究验证。优化C-TI-RADS分类对高危甲状腺结节管理更具临床价值,一项5 162名健康个体随访5年研究[22]中, 4A类及以上的甲状腺结节分类状态变化较多,分类越高提示发生恶性进展风险越大,这需要随访医师及时修饰调整TI-RADS分类。CHEN L等[23]研究表明, TI-RADS结合结节晕征、年龄建立新模型的预测结果具有较高的敏感度(88.4%)和特异度(91.7%), 也提示TI-RADS分类需要结合其他临床危险因素进行修饰优化。本研究构建的列线图模型既考虑了基于甲状腺结节超声特征的C-TI-RADS分类,又综合了临床相关危险因素,体现了超声医师修饰优化价值,分类结果更具有临床实用性。
本研究存在以下局限: ①虽然本研究使用了由训练有素的超声医师收集的常规临床数据及超声图像特征数据,但观察者间的可变性及识别图像的主观性可能会影响模型的有效性。②研究结果为二分类,即修饰与非修饰,并不能确定C-TI-RADS优化结果是升高分类或降低分类。③本研究未纳入其他潜在临床危险因素,如体质量指数、生活环境、就医环境、甲状腺结节位置和患者放射性接触史等因素[24-26], 这些因素的作用仍需后续探讨。
综上所述,本研究构建的列线图模型纳入了甲状腺临床危险因素与超声基本征象,在预测甲状腺C-TI-RADS分类修饰中显示出较高的准确性和区分度,具有潜在的临床应用价值。
-
表 1 各组大鼠支气管肺泡灌洗液中促炎症介质表达水平比较(x±s)
组别 n IL-17 mRNA IL-33 mRNA iNOS mRNA 对照组 10 0.86±0.03 0.63±0.10 0.98±0.12 模型组 10 2.04±0.32* 0.91±0.05* 2.21±0.30* 疏肝和胃方低剂量组 10 1.88±0.14 0.82±0.13 1.78±0.24# 疏肝和胃方高剂量组 10 0.87±0.09# 0.61±0.02# 1.42±0.11# 奥美拉唑组 10 0.94±0.07# 0.65±0.10# 1.57±0.10# IL-17 : 白细胞介素-17; IL-33 : 白细胞介素-33; iNOS: 诱导型一氧化氮合酶。与对照组比较, * P < 0.05; 与模型组比较, #P < 0.05。 表 2 各组大鼠支气管肺泡灌洗液中抗炎症介质表达水平比较(x±s)
组别 n IL-10 mRNA CC16 mRNA SP-D mRNA 对照组 10 0.94±0.19 1.07±0.16 0.96±0.08 模型组 10 0.38±0.04* 0.44±0.06* 0.43±0.07* 疏肝和胃方低剂量组 10 0.60±0.10# 0.53±0.07 0.46±0.05 疏肝和胃方高剂量组 10 0.79±0.20# 0.87±0.13# 0.82±0.05# 奥美拉唑组 10 0.71±0.23# 0.84±0.10# 0.75±0.09# IL-10 : 白细胞介素-10; CC16 : 克拉拉细胞蛋白16; SP-D: 表面活性蛋白-D。与对照组比较, * P < 0.05; 与模型组比较, #P < 0.05。 表 3 各组大鼠支气管肺泡灌洗液中PPAR-γ、RXR-α、NF-κB、AP-1蛋白相对表达量比较(x±s)
组别 n PPAR-γ RXR-α NF-κB AP-1 对照组 10 0.20±0.02 0.57±0.06 0.38±0.02 0.22±0.03 模型组 10 0.05±0.01* 0.14±0.02* 0.89±0.13* 1.02±0.25* 疏肝和胃方低剂量组 10 0.13±0.01# 0.35±0.07# 0.65±0.06# 0.71±0.12# 疏肝和胃方高剂量组 10 0.20±0.05# 0.60±0.07# 0.53±0.09# 0.43±0.08# 奥美拉唑组 10 0.19±0.06# 0.56±0.10# 0.58±0.05# 0.33±0.06# PPAR-γ: 过氧化物酶体增殖物激活受体γ; RXR-α: 类视黄醇X受体α; NF-κB: 核因子-κB; AP-1: 活化蛋白-1。与对照组比较, * P < 0.05; 与模型组比较, #P < 0.05。 -
[1] MARET-OUDA J, MARKAR S R, LAGERGREN J. Gastroesophageal reflux disease: a review[J]. JAMA, 2020, 324(24): 2536-2547. doi: 10.1001/jama.2020.21360
[2] JOHNSTON N, ONDREY F, ROSEN R, et al. Airway reflux[J]. Ann N Y Acad Sci, 2016, 1381(1): 5-13. doi: 10.1111/nyas.13080
[3] DUNBAR K B, AGOSTON A T, ODZE R D, et al. Association of acute gastroesophageal reflux disease with esophageal histologic changes[J]. JAMA, 2016, 315(19): 2104-2112. doi: 10.1001/jama.2016.5657
[4] NGUYEN P A, ISLAM M, GALVIN C J, et al. Meta-analysis of proton pump inhibitors induced risk of community-acquired pneumonia[J]. Int J Qual Health Care, 2020, 32(5): 292-299. doi: 10.1093/intqhc/mzaa041
[5] EUSEBI L H, RABITTI S, ARTESIANI M L, et al. Proton pump inhibitors: risks of long-term use[J]. J Gastroenterol Hepatol, 2017, 32(7): 1295-1302. doi: 10.1111/jgh.13737
[6] JACKSON M A, GOODRICH J K, MAXAN M E, et al. Proton pump inhibitors alter the composition of the gut microbiota[J]. Gut, 2016, 65(5): 749-756. doi: 10.1136/gutjnl-2015-310861
[7] 孙永顺, 朱生樑, 王宏伟, 等. 疏肝和胃方治疗难治性胃食管反流病的临床观察[J]. 时珍国医国药, 2016, 27(10): 2457-2459. [8] STARK J M, COQUET J M, TIBBITT C A. The role of PPAR-γ in allergic disease[J]. Curr Allergy Asthma Rep, 2021, 21(11): 45. doi: 10.1007/s11882-021-01022-x
[9] 刘春丽, 赖克方, 陈如冲, 等. 盐酸灌注豚鼠食管反流性疾病模型的建立[J]. 中国病理生理杂志, 2006, 22(3): 620-621, 624. doi: 10.3321/j.issn:1000-4718.2006.03.049 [10] FASS R, BOECKXSTAENS G E, EL-SERAG H, et al. Gastro-oesophageal reflux disease[J]. Nat Rev Dis Primers, 2021, 7(1): 55. doi: 10.1038/s41572-021-00287-w
[11] EL-SERAG H B, SWEET S, WINCHESTER C C, et al. Update on the epidemiology of gastro-oesophageal reflux disease: a systematic review[J]. Gut, 2014, 63(6): 871-880. doi: 10.1136/gutjnl-2012-304269
[12] MEHTA R S, NGUYEN L H, MA W J, et al. Association of diet and lifestyle with the risk of gastroesophageal reflux disease symptoms in US women[J]. JAMA Intern Med, 2021, 181(4): 552-554. doi: 10.1001/jamainternmed.2020.7238
[13] LI Z, TAO L, ZHANG S S, et al. Modified Xiaochaihu Decoction for gastroesophageal reflux disease: a randomized double-simulation controlled trial[J]. World J Gastroenterol, 2021, 27(28): 4710-4721. doi: 10.3748/wjg.v27.i28.4710
[14] SONG S Z, ZHANG Y S, ZHANG J W, et al. Efficacy evaluation and exploratory analysis of influencing factors of Banxia Houpu Decoction in the treatment of refractory gastroesophageal reflux disease[J]. Medicine, 2024, 103(24): e38045. doi: 10.1097/MD.0000000000038045
[15] CHENG Y, KOU F S, ZHANG X S, et al. Network pharmacology analysis of hewei jiangni granule for gastroesophageal reflux disease and experimental verification of its anti-neurogenic inflammation mechanism[J]. Drug Des Devel Ther, 2022, 16: 1349-1363. doi: 10.2147/DDDT.S348985
[16] 杜梦蝶, 王玮, 付文尚, 等. 疏肝和胃方通过抑制NF-κB通路调控M1巨噬细胞极化对反流性食管炎大鼠食管黏膜炎症的影响[J]. 上海中医药杂志, 2024, 58(5): 66-72. [17] 张晓轩, 翟超, 李光璨, 等. 子宫内膜容受性与白血病抑制因子的相关性[J]. 国际生殖健康计划生育杂志, 2022, 41(4): 327-331. [18] KURAMOTO K, MORISHIMA Y, YOSHIDA K, et al. Nrf2 deficiency accelerates IL-17-dependent neutrophilic airway inflammation in asthmatic mice[J]. Antioxidants, 2024, 13(7): 818. doi: 10.3390/antiox13070818
[19] MIYAOKA C, WATANABE M, NAKAMOTO K, et al. Association of IL-33 in modeling type-2 airway inflammation and pulmonary emphysema in mice[J]. Immun Inflamm Dis, 2024, 12(4): e1252. doi: 10.1002/iid3.1252
[20] HAN X, CHAI R N, QI F F, et al. Natural helper cells mediate respiratory syncytial virus-induced airway inflammation by producing type 2 cytokines in an IL-33-dependent manner[J]. Immunotherapy, 2017, 9(9): 715-722. doi: 10.2217/imt-2017-0037
[21] NADEEM A, SIDDIQUI N, ALHARBI N O, et al. Acute glutathione depletion leads to enhancement of airway reactivity and inflammation via p38MAPK-iNOS pathway in allergic mice[J]. Int Immunopharmacol, 2014, 22(1): 222-229. doi: 10.1016/j.intimp.2014.06.030
[22] WILSON M S, ELNEKAVE E, MENTINK-KANE M M, et al. IL-13Ralpha2 and IL-10 coordinately suppress airway inflammation, airway-hyperreactivity, and fibrosis in mice[J]. J Clin Invest, 2007, 117(10): 2941-2951. doi: 10.1172/JCI31546
[23] LIU M X, LU J J, ZHANG Q, et al. Clara cell 16 KDa protein mitigates house dust mite-induced airway inflammation and damage via regulating airway epithelial cell apoptosis in a manner dependent on HMGB1-mediated signaling inhibition[J]. Mol Med, 2021, 27(1): 11.
[24] WANG J Y, REID K B M. The immunoregulatory roles of lung surfactant collectins SP-A, and SP-D, in allergen-induced airway inflammation[J]. Immunobiology, 2007, 212(4/5): 417-425.
[25] XU J, ZHU Y T, WANG G Z, et al. The PPARγ agonist, rosiglitazone, attenuates airway inflammation and remodeling via heme oxygenase-1 in murine model of asthma[J]. Acta Pharmacol Sin, 2015, 36(2): 171-178. doi: 10.1038/aps.2014.128
[26] UCHIMURA K, NAKAMUTA M, ENJOJI M, et al. Activation of retinoic X receptor and peroxisome proliferator-activated receptor-gamma inhibits nitric oxide and tumor necrosis factor-alpha production in rat Kupffer cells[J]. Hepatology, 2001, 33(1): 91-99. doi: 10.1053/jhep.2001.21145
[27] HAYDEN M S, GHOSH S. Shared principles in NF-kappaB signaling[J]. Cell, 2008, 132(3): 344-362. doi: 10.1016/j.cell.2008.01.020
[28] KUSIAK A, BRADY G. Bifurcation of signalling in human innate immune pathways to NF-κB and IRF family activation[J]. Biochem Pharmacol, 2022, 205: 115246. doi: 10.1016/j.bcp.2022.115246
[29] MIRZA A Z, ALTHAGAFI I I, SHAMSHAD H. Role of PPAR receptor in different diseases and their ligands: physiological importance and clinical implications[J]. Eur J Med Chem, 2019, 166: 502-513. doi: 10.1016/j.ejmech.2019.01.067
[30] DE SOUZA BASSO B, HAUTE G V, ORTEGA-RIBERA M, et al. Methoxyeugenol deactivates hepatic stellate cells and attenuates liver fibrosis and inflammation through a PPAR-γ and NF-κB mechanism[J]. J Ethnopharmacol, 2021, 280: 114433. doi: 10.1016/j.jep.2021.114433
[31] WANG N P, VERNA L, CHEN N G, et al. Constitutive activation of peroxisome proliferator-activated receptor-gamma suppresses pro-inflammatory adhesion molecules in human vascular endothelial cells[J]. J Biol Chem, 2002, 277(37): 34176-34181. doi: 10.1074/jbc.M203436200
[32] YAN L, ZHANG J D, WANG B, et al. Quercetin inhibits left ventricular hypertrophy in spontaneously hypertensive rats and inhibits angiotensin Ⅱ-induced H9C2 cells hypertrophy by enhancing PPAR-γ expression and suppressing AP-1 activity[J]. PLoS One, 2013, 8(9): e72548. doi: 10.1371/journal.pone.0072548
[33] MENG X, SUN X R, ZHANG Y H, et al. PPARγ agonist PGZ attenuates OVA-induced airway inflammation and airway remodeling via RGS4 signaling in mouse model[J]. Inflammation, 2018, 41(6): 2079-2089. doi: 10.1007/s10753-018-0851-2
[34] TRIFILIEFF A, BENCH A, HANLEY M, et al. PPAR-α and-γ but not-δ agonists inhibit airway inflammation in a murine model of asthma: in vitro evidence for an NF-κB-independent effect[J]. British J Pharmacology, 2003, 139(1): 163-171. doi: 10.1038/sj.bjp.0705232
[35] KOBAYASHI M, THOMASSEN M J, RAMBASEK T, et al. An inverse relationship between peroxisome proliferator-activated receptor gamma and allergic airway inflammation in an allergen challenge model[J]. Ann Allergy Asthma Immunol, 2005, 95(5): 468-473. doi: 10.1016/S1081-1206(10)61173-8




 下载:
下载:





 苏公网安备 32100302010246号
苏公网安备 32100302010246号