Mechanism of liver-soothing and stomach-harmonizing recipe alleviating airway inflammation in rats with gastroesophageal reflux disease by regulating PPAR-γ/RXR signaling pathway
-
摘要:目的
探讨疏肝和胃方通过调控过氧化物酶体增殖物激活受体γ/类视黄醇X受体(PPAR-γ/RXR)信号通路缓解胃食管反流病(GERD)大鼠气道炎症的机制。
方法采用食管下端盐酸灌注法构建GERD合并气道炎症大鼠模型。将50只SD雄性大鼠随机分为对照组、模型组、疏肝和胃方低剂量组(10.49 g/kg生药量)、疏肝和胃方高剂量组(20.98 g/kg生药量)和奥美拉唑组(3.67 mg/kg), 每组10只, 灌胃14 d。采用苏木精-伊红(HE)染色观察气管组织的病理学变化; 采用RT-qPCR检测支气管肺泡灌洗液中炎症因子[白细胞介素(IL)-17、IL-33、诱导型一氧化氮合酶(iNOS)]以及抗炎因子[IL-10、克拉拉细胞蛋白16(CC16)、表面活性蛋白-D(SP-D)]的mRNA表达水平; 采用免疫印迹法检测PPAR-γ、RXR-α、核因子-κB(NF-κB)、活化蛋白-1(AP-1)的蛋白相对表达量。
结果HE染色结果显示,模型组可见大量炎症细胞浸润,疏肝和胃方低剂量组、高剂量组和奥美拉唑组炎症细胞浸润明显减少。与对照组比较,模型组支气管肺泡灌洗液中IL-17、IL-33、iNOS的mRNA表达水平升高, IL-10、CC16、SP-D的mRNA表达水平降低, PPAR-γ、RXR-α的蛋白相对表达量升高, NF-κB、AP-1的蛋白相对表达量降低,差异均有统计学意义(P < 0.05)。与模型组比较,疏肝和胃方高剂量组和奥美拉唑组上述指标均有改善,差异有统计学意义(P < 0.05)。
结论疏肝和胃方可以有效缓解GERD大鼠气道炎症,其作用机制可能与激活PPARγ/RXR信号通路有关。
-
关键词:
- 疏肝和胃方 /
- 胃食管反流病 /
- 过氧化物酶体增殖物激活受体 /
- 类视黄醇X受体 /
- 信号通路
Abstract:ObjectiveTo investigate the mechanism of liver-soothing and stomach-harmonizing recipe alleviating airway inflammation in rats with gastroesophageal reflux disease (GERD) by regulating peroxisome proliferator-activated receptor γ/retinoid X receptor (PPAR-γ/RXR) signaling pathway.
MethodsA rat model of GERD with airway inflammation was established by perfusion of hydrochloric acid into the lower esophagus. A total of 50 SD male rats were randomly divided into control group, model group, low-dose liver-soothing and stomach-harmonizing recipe group (10.49 g/kg crude drug dosage), high-dose liver-soothing and stomach-harmonizing recipe group (20.98 g/kg crude drug dosage), and omeprazole group (3.67 mg/kg), with 10 rats in each group. The rats were gavaged for 14 days. Hematoxylin and eosin (HE) staining was used to observe the pathological change in tracheal tissue. RT-qPCR was used to detect the mRNA expression levels of inflammatory cytokines[interleukin (IL)-17, IL-33, inducible nitric oxide synthase (iNOS)]and anti-inflammatory cytokines[IL-10, Clara cell 16-kDa protein (CC16), surfactant protein-D (SP-D)]in bronchoalveolar lavage fluid; the Western blot was used to detect the relative protein expression levels of PPAR-γ, RXR-α, nuclear factor-κB (NF-κB), and activator protein-1 (AP-1).
ResultsThe HE staining results showed that a large number of inflammatory cell infiltrations were observed in the model group, while the inflammatory cell infiltrations were significantly reduced in the low-dose liver-soothing and stomach-harmonizing recipe group, high-dose liver-soothing and stomach-harmonizing recipe group, and omeprazole group. Compared with the control group, the mRNA expression levels of IL-17, IL-33 and iNOS in bronchoalveolar lavage fluid were significantly increased while the mRNA expression levels of IL-10, CC16 and SP-D were significantly decreased in the model group, and the relative protein expression levels of PPAR-γ and RXR-α were significantly increased, while the relative protein expression levels of NF-κB and AP-1 were significantly decreased in the model group (P < 0.05). Compared with the model group, the above indicators were significantly improved in the high-dose liver-soothing and stomach-harmonizing recipe group and omeprazole group (P < 0.05).
ConclusionLiver-soothing and stomach-harmonizing recipe can effectively alleviate airway inflammation in rats with GERD, and its mechanism may be related to the activation of the PPAR-γ/RXR signaling pathway.
-
胃食管反流病(GERD)是一种消化系统常见疾病,以胃内容物反流至食道或口腔、气道后继发的食道或邻近器官损伤为临床特征[1]。GERD多出现食管外症状,如慢性咳嗽、哮喘、吸入性肺炎、咽喉炎等,这些症状与气道炎症密切相关[2-3]。GERD在临床治疗上主要依赖抑酸药、黏膜保护剂及促胃肠动力药,但这些药物可能会增高罹患肺炎、骨质疏松、痴呆以及慢性肾脏病的风险,并且不适用于非酸反流的情况[4-6]。中医学认为肝气犯胃、胃失和降是GERD的基本病机。疏肝和胃方是一类具有疏肝解郁、和胃降逆等功效的中药方剂,常用于治疗与情志失调、肝胃不和相关的疾病。研究[7]表明,舒肝和胃方对GERD反流症状的改善效果显著优于传统西药,但其调控机制仍需进一步探讨。
过氧化物酶体增殖物激活受体(PPAR)作为免疫调节剂,通过与靶基因的特定元件结合调节基因转录。在慢性肺部疾病中, PPAR影响炎症反应和组织重塑。其中, PPAR-γ因其具有抗氧化和抗凋亡特性,通常被认为是呼吸系统疾病的关键抗炎靶点。PPAR-γ通过与类视黄醇X受体(RXR)形成异二聚体后被激活, PPAR-γ/RXR异二聚体能够抑制促炎因子的表达,同时促进抗炎因子的生成[8]。针对GERD造成的气道炎症,疏肝和胃方能否通过PPAR-γ/RXR信号通路发挥抗炎作用尚未可知。本研究探讨疏肝和胃方对GERD所致大鼠气道炎症的改善作用,并从PPAR-γ/RXR信号通路探讨其作用机制,现报告如下。
1. 材料与方法
1.1 实验动物
50只健康雄性SPF级SD大鼠,体质量250~300 g, 由遵义医科大学实验动物中心提供,动物生产许可证号为SCXK(黔)2021-0002。动物实验条件: 温度(23±3) ℃, 湿度(55±10) ℃, 光照/黑暗各12 h, 自由采食和饮水。
1.2 实验药物
疏肝和胃方由白芍(15 g)、赭石(15 g)、柴胡(12 g)、枳壳(12 g)、太子参(12 g)、旋覆花(12 g)、郁金(12 g)、甘草(6 g)、黄连(3 g)和吴茱萸(3 g)等多味中药组成,所有饮片均源自上海中医药大学附属医院。采用传统中药煎煮法,煎煮前将疏肝和胃方浸泡1 h, 先煎煮赭石30 min, 再加余药煎煮30 min, 取汁后再煎1次,与第1次汁液合并,浓缩至486 mL作为高剂量,对半稀释为低剂量,置于4 ℃冰箱中备用。西药为奥美拉唑胶囊(20 mg/粒,常州四药制药有限公司,生产批号为20140602), 使用前需将其配制成溶液。
1.3 实验试剂与仪器
苏木精-伊红(HE)染色液购自武汉赛维尔生物科技有限公司; RT-qPCR的总RNA提取试剂盒、逆转录试剂盒以及相关PCR检测试剂均由诺唯赞生物科技股份有限公司提供; PPAR-γ、RXR-α、核因子-κB(NF-κB)、活化蛋白-1(AP-1)抗体由武汉艾美捷科技有限公司提供。
13/30RR型切片机购自德国MEDIS公司; 光学显微镜购自日本Olympus公司; CFX96荧光定量PCR仪购自美国Bio-Rad公司; DYY-12电泳仪购自北京六一生物科技有限公司; Prime扩增仪购自英国Techne公司。
1.4 实验造模、分组及给药
将50只健康SD大鼠随机分为对照组10只和造模组40只。造模组采用食管下端盐酸灌注法制备GERD合并气道炎症大鼠模型[9], 共持续21 d。造模成功后,将造模组大鼠随机分为模型组、疏肝和胃方低剂量组(10.49 g/kg生药量)、疏肝和胃方高剂量组(20.98 g/kg生药量)和奥美拉唑组(3.67 mg/kg), 每组10只。对照组和模型组每天灌胃10 mL/kg蒸馏水,其他组灌胃等量体积的相应药剂, 1次/d, 连续灌胃14 d。
1.5 HE染色观察大鼠食管和气管组织的病理学变化
末次给药后禁食不禁水,次日腹腔注射4%水合氯醛麻醉大鼠。切取气管组织,用4%多聚甲醛固定24 h, 经梯度乙醇脱水、二甲苯透明、石蜡包埋后制成4 μm薄片。切片再经二甲苯脱蜡进行HE染色,包括苏木精染色、盐酸乙醇分色及伊红乙醇复染,最终脱水去乙醇并用中性树胶封片,在光学显微镜下观察组织病理变化。
1.6 RT-qPCR检测大鼠支气管肺泡灌洗液中相关炎症介质mRNA表达水平
采用1 mL生理盐水对各组大鼠左侧肺叶进行3次重复的灌洗操作,随后收集所得的肺泡灌洗液。根据RNA提取试剂盒提取大鼠支气管肺泡灌洗液中的总RNA, 以RNA为模板,应用逆转录试剂盒进行逆转录制备cDNA, 构建PCR体系; 以GAPDH为内参,通过荧光定量PCR技术检测支气管肺泡灌洗液中白细胞介素 (IL)-17 、 IL-33 、诱导型一氧化氮合酶(iNOS)、 IL-10 、克拉拉细胞蛋白16( CC16 )、表面活性蛋白-D(SP-D)的mRNA表达量。PCR在95 ℃下初始变性5 s, 退火,在60 ℃下伸长30 s, 采用2-△△Ct法计算目的基因的相对表达量。
1.7 免疫印迹法检测大鼠支气管肺泡灌洗液中PPAR-γ、RXR-α、NF-κB、AP-1的蛋白相对表达量
取大鼠支气管肺泡灌洗液,采用BCA试剂盒测定蛋白浓度,加样后凝胶电泳、转膜并封闭1 h; 加入PPAR-γ、RXR-α、NF-κB、AP-1一抗(1∶ 1 000)4 ℃孵育过夜,次日TBST洗膜,加二抗(1∶ 5 000)室温孵育1 h; 最后, PVDF膜加ECL显色曝光,采用Image J分析条带灰度值,以β-actin灰度值为对照,计算各目的蛋白的相对表达量。
1.8 统计学分析
采用SPSS 19.0统计软件对数据进行分析。所有数据用(x±s)的形式表示,多组间比较采用单因素方差分析,进一步两两比较采用t检验。P < 0.05为差异有统计学意义。
2. 结果
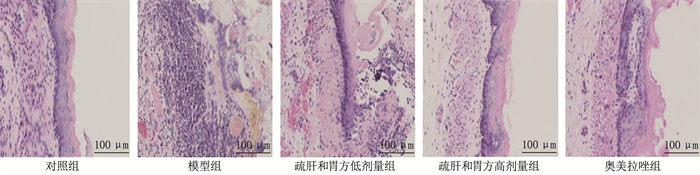
2.1 各组大鼠气管组织的病理学变化
对照组黏膜结构清晰,黏膜下纤维结缔组织疏松; 与对照组相比,模型组出现纤毛增生、纤维细胞增殖,并有大量炎症细胞浸润; 与模型组相比,疏肝和胃方低剂量组、高剂量组和奥美拉唑组纤毛增生与纤维细胞增殖均有减少,炎症细胞浸润明显减轻。见图 1。
2.2 各组大鼠支气管肺泡灌洗液中促炎症介质IL-17、IL-33、iNOS的mRNA表达
与对照组比较,模型组支气管肺泡灌洗液中 IL-17、IL-33 、iNOS的mRNA表达水平升高,差异有统计学意义(P < 0.05); 与模型组比较,疏肝和胃方低剂量组iNOS mRNA表达水平降低,疏肝和胃方高剂量组和奥美拉唑组 IL-17、IL-33 、iNOS的mRNA表达水平降低,差异均有统计学意义(P < 0.05)。见表 1。
表 1 各组大鼠支气管肺泡灌洗液中促炎症介质表达水平比较(x±s)组别 n IL-17 mRNA IL-33 mRNA iNOS mRNA 对照组 10 0.86±0.03 0.63±0.10 0.98±0.12 模型组 10 2.04±0.32* 0.91±0.05* 2.21±0.30* 疏肝和胃方低剂量组 10 1.88±0.14 0.82±0.13 1.78±0.24# 疏肝和胃方高剂量组 10 0.87±0.09# 0.61±0.02# 1.42±0.11# 奥美拉唑组 10 0.94±0.07# 0.65±0.10# 1.57±0.10# IL-17 : 白细胞介素-17; IL-33 : 白细胞介素-33; iNOS: 诱导型一氧化氮合酶。与对照组比较, * P < 0.05; 与模型组比较, #P < 0.05。 2.3 各组大鼠支气管肺泡灌洗液中抗炎症介质 IL-10、CC16 、SP-D的mRNA表达水平
模型组支气管肺泡灌洗液中 IL-10、CC16 、SP-D的mRNA表达水平低于对照组,差异有统计学意义(P < 0.05); 与模型组比较,疏肝和胃方低剂量组 IL-10 mRNA表达水平升高,疏肝和胃方高剂量组和奥美拉唑组 IL-10、CC16 、SP-D的mRNA表达水平升高,差异均有统计学意义(P < 0.05)。见表 2。
表 2 各组大鼠支气管肺泡灌洗液中抗炎症介质表达水平比较(x±s)组别 n IL-10 mRNA CC16 mRNA SP-D mRNA 对照组 10 0.94±0.19 1.07±0.16 0.96±0.08 模型组 10 0.38±0.04* 0.44±0.06* 0.43±0.07* 疏肝和胃方低剂量组 10 0.60±0.10# 0.53±0.07 0.46±0.05 疏肝和胃方高剂量组 10 0.79±0.20# 0.87±0.13# 0.82±0.05# 奥美拉唑组 10 0.71±0.23# 0.84±0.10# 0.75±0.09# IL-10 : 白细胞介素-10; CC16 : 克拉拉细胞蛋白16; SP-D: 表面活性蛋白-D。与对照组比较, * P < 0.05; 与模型组比较, #P < 0.05。 2.4 各组大鼠支气管肺泡灌洗液中PPAR-γ、RXR-α、NF-κB、AP-1蛋白相对表达量
与对照组比较,模型组支气管肺泡灌洗液中PPAR-γ、RXR-α的蛋白相对表达量降低, NF-κB、AP-1的蛋白相对表达量增高,差异均有统计学意义(P < 0.05); 与模型组比较,疏肝和胃方低剂量组、高剂量组和奥美拉唑组PPAR-γ、RXR-α的蛋白相对表达量增高, NF-κB、AP-1的蛋白相对表达量降低,差异有统计学意义(P < 0.05)。见表 3、图 2。
表 3 各组大鼠支气管肺泡灌洗液中PPAR-γ、RXR-α、NF-κB、AP-1蛋白相对表达量比较(x±s)组别 n PPAR-γ RXR-α NF-κB AP-1 对照组 10 0.20±0.02 0.57±0.06 0.38±0.02 0.22±0.03 模型组 10 0.05±0.01* 0.14±0.02* 0.89±0.13* 1.02±0.25* 疏肝和胃方低剂量组 10 0.13±0.01# 0.35±0.07# 0.65±0.06# 0.71±0.12# 疏肝和胃方高剂量组 10 0.20±0.05# 0.60±0.07# 0.53±0.09# 0.43±0.08# 奥美拉唑组 10 0.19±0.06# 0.56±0.10# 0.58±0.05# 0.33±0.06# PPAR-γ: 过氧化物酶体增殖物激活受体γ; RXR-α: 类视黄醇X受体α; NF-κB: 核因子-κB; AP-1: 活化蛋白-1。与对照组比较, * P < 0.05; 与模型组比较, #P < 0.05。 3. 讨论
GERD是一种广泛流行的胃肠道疾病,其典型症状是胃灼热和反流,但也可能会出现各种非典型和食管外表现[10]。GERD全球患病率较高,且发病率逐年攀升[11]。流行病学研究[12]显示, GERD的风险因素包括肥胖、老龄化、吸烟、遗传等。质子泵抑制剂(PPI)被认为是现代医学治疗GERD的首选药物,但会对气道造成损害。传统中药用于治疗GERD疗效显著, LI Z等[13]发现在轻中度GERD患者中,改良版小柴胡汤可增强食管下括约肌收缩力、减少无效吞咽,与奥美拉唑疗效无显著差异; 半夏厚补汤在缓解GERD患者咽喉灼烧感、吞咽困难、频繁打嗝等症状方面优于PPI[14]; 和胃降逆颗粒能够通过抑制炎症细胞因子的过度释放显著改善GERD[15]。疏肝和胃方源自左金丸、柴胡疏肝散及旋覆代赭汤的化裁,方中柴胡主疏肝解郁、升脾阳; 枳壳理气降胃浊,共调脾胃; 柴胡与白芍柔肝; 黄连清肝胃之火,吴茱萸防黄连过寒,两药并用清肝火、降胃气; 旋覆花、赭石止呕; 郁金解郁; 太子参、甘草益气健脾、调和诸药。杜梦蝶等[16]使用该方灌胃反流性食管炎大鼠发现,其可通过调控NF-κB信号通路抑制食管黏膜炎症,减轻反流。本研究发现疏肝和胃方能够显著改善GERD模型大鼠的气道炎症,增加PPAR-γ、RXR的表达,抑制NF-κB、AP-1的表达。
GERD的核心病理机制涉及免疫功能与细胞炎症因子调节系统失衡、细胞凋亡过程异常、肠道菌群失调等诸多方面[17]。其中,炎症反应在GERD气道高反应性和重塑的致病机制中至关重要。本研究结果显示,模型大鼠支气管肺泡灌洗液中IL-17、IL-33、iNOS、IL-10、CC16、SP-D等多种炎症相关因子表达异常。研究[18-20]表明, IL-17参与启动炎症反应,促进气道高反应性及重塑; IL-33已被证实能介导气道炎症,激活肥大细胞,并诱导气道高反应性与重塑。iNOS由巨噬细胞、中性粒细胞和上皮细胞表达,因iNOS激活产生的活性氮物质(RNS)已被证明与气道的支气管收缩和炎症反应有关[21]。动物研究[22]显示, IL-10可通过调节免疫系统来抑制气道炎症。CC16由细支气管Clara细胞分泌,是一种治疗性肺上皮损伤的蛋白质,主要通过抑制磷脂酶A2来减弱氧化应激和炎症反应[23]。SP-D是一种在呼吸道上皮细胞中合成的肺胶原蛋白,是宿主防御系统的主要调节因子,通过调节免疫细胞活性来促进免疫和炎症调节[24]。本研究中,与模型组相比,疏肝和胃方高剂量组和奥美拉唑组大鼠 IL-17、IL-33 、iNOS的mRNA表达水平下降, IL-10、CC16 、SP-D的mRNA表达水平上升,且在气管组织的病理变化中,炎症细胞浸润明显改善,提示疏肝和胃方能够抑制炎症介质的合成与释放,从而起到缓解模型大鼠气道炎症的作用。
PPAR是配体激活的核转录因子超家族成员,涵盖PPAR-α、PPAR-β/δ及PPAR-γ这3种亚型,其中PPAR-γ在介导人和动物气道的炎症介质释放和炎症细胞活化中发挥关键作用[25]。PPAR-γ必须与相应配体结合后才能活化,活化后与RXR形成异二聚体,干扰NF-κB和AP-1转录活性并抑制炎症介质的产生[26]。NF-κB包p50和p65亚基,静息时与抑制蛋白IκBa/b结合并在细胞质内呈无活性态。发生炎症反应时,促炎因子触发IκBa/b使之泛素化降解,释放p50/p65二聚体,此二聚体与p300/CBP结合后入核,与DNA的κB序列结合,诱导炎症介质基因表达,并增强环氧合酶-2(COX-2)活性,促进花生四烯酸转化为前列腺素H2(PGH2), 进而生成前列腺素E2(PGE2), 从而介导炎症介质的生成[27-28]。PPAR-γ可以直接与NF-κB的p65/p50亚基结合,形成转录抑制复合物,降低NF-κB与DNA的结合及表达。同时, PPAR-γ通过竞争性结合p300/CBP, 进一步抑制NF-κB的转录活性[29-30]。AP-1是核转录因子,由c-Jun和c-Fos这2个亚单位组成,参与炎症反应的多种功能,如诱导细胞凋亡、合成炎症因子等。PPAR-γ通过与AP-1竞争CBP和p300并结合,从而抑制AP-1的信号转导途径[31-32]。有关气道相关疾病的研究[33-34]表明, PPAR-γ激动剂能够减轻模型小鼠的气道炎症程度。KOBAYASHI M等[35]研究发现,与健康人不同,哮喘患者肺泡巨噬细胞中PPAR-γ的mRNA和蛋白质水平表达下调,表明PPAR-γ表达上调有助于改善气道炎症程度。本研究结果显示,疏肝和胃方低剂量组、高剂量组和奥美拉唑组PPAR-γ、RXR蛋白表达量显著升高, NF-κB、AP-1蛋白表达量显著降低,说明疏肝和胃方治疗GERD大鼠气道炎症的机制可能与其对PPAR-γ/RXR信号通路的调控有关。
综上所述,疏肝和胃方可能通过调节PPAR-γ/RXR信号通路,抑制NF-κB、AP-1的信号转导,减少炎症介质的合成与释放,进而缓解GERD大鼠气道炎症。
-
表 1 各组大鼠支气管肺泡灌洗液中促炎症介质表达水平比较(x±s)
组别 n IL-17 mRNA IL-33 mRNA iNOS mRNA 对照组 10 0.86±0.03 0.63±0.10 0.98±0.12 模型组 10 2.04±0.32* 0.91±0.05* 2.21±0.30* 疏肝和胃方低剂量组 10 1.88±0.14 0.82±0.13 1.78±0.24# 疏肝和胃方高剂量组 10 0.87±0.09# 0.61±0.02# 1.42±0.11# 奥美拉唑组 10 0.94±0.07# 0.65±0.10# 1.57±0.10# IL-17 : 白细胞介素-17; IL-33 : 白细胞介素-33; iNOS: 诱导型一氧化氮合酶。与对照组比较, * P < 0.05; 与模型组比较, #P < 0.05。 表 2 各组大鼠支气管肺泡灌洗液中抗炎症介质表达水平比较(x±s)
组别 n IL-10 mRNA CC16 mRNA SP-D mRNA 对照组 10 0.94±0.19 1.07±0.16 0.96±0.08 模型组 10 0.38±0.04* 0.44±0.06* 0.43±0.07* 疏肝和胃方低剂量组 10 0.60±0.10# 0.53±0.07 0.46±0.05 疏肝和胃方高剂量组 10 0.79±0.20# 0.87±0.13# 0.82±0.05# 奥美拉唑组 10 0.71±0.23# 0.84±0.10# 0.75±0.09# IL-10 : 白细胞介素-10; CC16 : 克拉拉细胞蛋白16; SP-D: 表面活性蛋白-D。与对照组比较, * P < 0.05; 与模型组比较, #P < 0.05。 表 3 各组大鼠支气管肺泡灌洗液中PPAR-γ、RXR-α、NF-κB、AP-1蛋白相对表达量比较(x±s)
组别 n PPAR-γ RXR-α NF-κB AP-1 对照组 10 0.20±0.02 0.57±0.06 0.38±0.02 0.22±0.03 模型组 10 0.05±0.01* 0.14±0.02* 0.89±0.13* 1.02±0.25* 疏肝和胃方低剂量组 10 0.13±0.01# 0.35±0.07# 0.65±0.06# 0.71±0.12# 疏肝和胃方高剂量组 10 0.20±0.05# 0.60±0.07# 0.53±0.09# 0.43±0.08# 奥美拉唑组 10 0.19±0.06# 0.56±0.10# 0.58±0.05# 0.33±0.06# PPAR-γ: 过氧化物酶体增殖物激活受体γ; RXR-α: 类视黄醇X受体α; NF-κB: 核因子-κB; AP-1: 活化蛋白-1。与对照组比较, * P < 0.05; 与模型组比较, #P < 0.05。 -
[1] MARET-OUDA J, MARKAR S R, LAGERGREN J. Gastroesophageal reflux disease: a review[J]. JAMA, 2020, 324(24): 2536-2547. doi: 10.1001/jama.2020.21360
[2] JOHNSTON N, ONDREY F, ROSEN R, et al. Airway reflux[J]. Ann N Y Acad Sci, 2016, 1381(1): 5-13. doi: 10.1111/nyas.13080
[3] DUNBAR K B, AGOSTON A T, ODZE R D, et al. Association of acute gastroesophageal reflux disease with esophageal histologic changes[J]. JAMA, 2016, 315(19): 2104-2112. doi: 10.1001/jama.2016.5657
[4] NGUYEN P A, ISLAM M, GALVIN C J, et al. Meta-analysis of proton pump inhibitors induced risk of community-acquired pneumonia[J]. Int J Qual Health Care, 2020, 32(5): 292-299. doi: 10.1093/intqhc/mzaa041
[5] EUSEBI L H, RABITTI S, ARTESIANI M L, et al. Proton pump inhibitors: risks of long-term use[J]. J Gastroenterol Hepatol, 2017, 32(7): 1295-1302. doi: 10.1111/jgh.13737
[6] JACKSON M A, GOODRICH J K, MAXAN M E, et al. Proton pump inhibitors alter the composition of the gut microbiota[J]. Gut, 2016, 65(5): 749-756. doi: 10.1136/gutjnl-2015-310861
[7] 孙永顺, 朱生樑, 王宏伟, 等. 疏肝和胃方治疗难治性胃食管反流病的临床观察[J]. 时珍国医国药, 2016, 27(10): 2457-2459. [8] STARK J M, COQUET J M, TIBBITT C A. The role of PPAR-γ in allergic disease[J]. Curr Allergy Asthma Rep, 2021, 21(11): 45. doi: 10.1007/s11882-021-01022-x
[9] 刘春丽, 赖克方, 陈如冲, 等. 盐酸灌注豚鼠食管反流性疾病模型的建立[J]. 中国病理生理杂志, 2006, 22(3): 620-621, 624. doi: 10.3321/j.issn:1000-4718.2006.03.049 [10] FASS R, BOECKXSTAENS G E, EL-SERAG H, et al. Gastro-oesophageal reflux disease[J]. Nat Rev Dis Primers, 2021, 7(1): 55. doi: 10.1038/s41572-021-00287-w
[11] EL-SERAG H B, SWEET S, WINCHESTER C C, et al. Update on the epidemiology of gastro-oesophageal reflux disease: a systematic review[J]. Gut, 2014, 63(6): 871-880. doi: 10.1136/gutjnl-2012-304269
[12] MEHTA R S, NGUYEN L H, MA W J, et al. Association of diet and lifestyle with the risk of gastroesophageal reflux disease symptoms in US women[J]. JAMA Intern Med, 2021, 181(4): 552-554. doi: 10.1001/jamainternmed.2020.7238
[13] LI Z, TAO L, ZHANG S S, et al. Modified Xiaochaihu Decoction for gastroesophageal reflux disease: a randomized double-simulation controlled trial[J]. World J Gastroenterol, 2021, 27(28): 4710-4721. doi: 10.3748/wjg.v27.i28.4710
[14] SONG S Z, ZHANG Y S, ZHANG J W, et al. Efficacy evaluation and exploratory analysis of influencing factors of Banxia Houpu Decoction in the treatment of refractory gastroesophageal reflux disease[J]. Medicine, 2024, 103(24): e38045. doi: 10.1097/MD.0000000000038045
[15] CHENG Y, KOU F S, ZHANG X S, et al. Network pharmacology analysis of hewei jiangni granule for gastroesophageal reflux disease and experimental verification of its anti-neurogenic inflammation mechanism[J]. Drug Des Devel Ther, 2022, 16: 1349-1363. doi: 10.2147/DDDT.S348985
[16] 杜梦蝶, 王玮, 付文尚, 等. 疏肝和胃方通过抑制NF-κB通路调控M1巨噬细胞极化对反流性食管炎大鼠食管黏膜炎症的影响[J]. 上海中医药杂志, 2024, 58(5): 66-72. [17] 张晓轩, 翟超, 李光璨, 等. 子宫内膜容受性与白血病抑制因子的相关性[J]. 国际生殖健康计划生育杂志, 2022, 41(4): 327-331. [18] KURAMOTO K, MORISHIMA Y, YOSHIDA K, et al. Nrf2 deficiency accelerates IL-17-dependent neutrophilic airway inflammation in asthmatic mice[J]. Antioxidants, 2024, 13(7): 818. doi: 10.3390/antiox13070818
[19] MIYAOKA C, WATANABE M, NAKAMOTO K, et al. Association of IL-33 in modeling type-2 airway inflammation and pulmonary emphysema in mice[J]. Immun Inflamm Dis, 2024, 12(4): e1252. doi: 10.1002/iid3.1252
[20] HAN X, CHAI R N, QI F F, et al. Natural helper cells mediate respiratory syncytial virus-induced airway inflammation by producing type 2 cytokines in an IL-33-dependent manner[J]. Immunotherapy, 2017, 9(9): 715-722. doi: 10.2217/imt-2017-0037
[21] NADEEM A, SIDDIQUI N, ALHARBI N O, et al. Acute glutathione depletion leads to enhancement of airway reactivity and inflammation via p38MAPK-iNOS pathway in allergic mice[J]. Int Immunopharmacol, 2014, 22(1): 222-229. doi: 10.1016/j.intimp.2014.06.030
[22] WILSON M S, ELNEKAVE E, MENTINK-KANE M M, et al. IL-13Ralpha2 and IL-10 coordinately suppress airway inflammation, airway-hyperreactivity, and fibrosis in mice[J]. J Clin Invest, 2007, 117(10): 2941-2951. doi: 10.1172/JCI31546
[23] LIU M X, LU J J, ZHANG Q, et al. Clara cell 16 KDa protein mitigates house dust mite-induced airway inflammation and damage via regulating airway epithelial cell apoptosis in a manner dependent on HMGB1-mediated signaling inhibition[J]. Mol Med, 2021, 27(1): 11.
[24] WANG J Y, REID K B M. The immunoregulatory roles of lung surfactant collectins SP-A, and SP-D, in allergen-induced airway inflammation[J]. Immunobiology, 2007, 212(4/5): 417-425.
[25] XU J, ZHU Y T, WANG G Z, et al. The PPARγ agonist, rosiglitazone, attenuates airway inflammation and remodeling via heme oxygenase-1 in murine model of asthma[J]. Acta Pharmacol Sin, 2015, 36(2): 171-178. doi: 10.1038/aps.2014.128
[26] UCHIMURA K, NAKAMUTA M, ENJOJI M, et al. Activation of retinoic X receptor and peroxisome proliferator-activated receptor-gamma inhibits nitric oxide and tumor necrosis factor-alpha production in rat Kupffer cells[J]. Hepatology, 2001, 33(1): 91-99. doi: 10.1053/jhep.2001.21145
[27] HAYDEN M S, GHOSH S. Shared principles in NF-kappaB signaling[J]. Cell, 2008, 132(3): 344-362. doi: 10.1016/j.cell.2008.01.020
[28] KUSIAK A, BRADY G. Bifurcation of signalling in human innate immune pathways to NF-κB and IRF family activation[J]. Biochem Pharmacol, 2022, 205: 115246. doi: 10.1016/j.bcp.2022.115246
[29] MIRZA A Z, ALTHAGAFI I I, SHAMSHAD H. Role of PPAR receptor in different diseases and their ligands: physiological importance and clinical implications[J]. Eur J Med Chem, 2019, 166: 502-513. doi: 10.1016/j.ejmech.2019.01.067
[30] DE SOUZA BASSO B, HAUTE G V, ORTEGA-RIBERA M, et al. Methoxyeugenol deactivates hepatic stellate cells and attenuates liver fibrosis and inflammation through a PPAR-γ and NF-κB mechanism[J]. J Ethnopharmacol, 2021, 280: 114433. doi: 10.1016/j.jep.2021.114433
[31] WANG N P, VERNA L, CHEN N G, et al. Constitutive activation of peroxisome proliferator-activated receptor-gamma suppresses pro-inflammatory adhesion molecules in human vascular endothelial cells[J]. J Biol Chem, 2002, 277(37): 34176-34181. doi: 10.1074/jbc.M203436200
[32] YAN L, ZHANG J D, WANG B, et al. Quercetin inhibits left ventricular hypertrophy in spontaneously hypertensive rats and inhibits angiotensin Ⅱ-induced H9C2 cells hypertrophy by enhancing PPAR-γ expression and suppressing AP-1 activity[J]. PLoS One, 2013, 8(9): e72548. doi: 10.1371/journal.pone.0072548
[33] MENG X, SUN X R, ZHANG Y H, et al. PPARγ agonist PGZ attenuates OVA-induced airway inflammation and airway remodeling via RGS4 signaling in mouse model[J]. Inflammation, 2018, 41(6): 2079-2089. doi: 10.1007/s10753-018-0851-2
[34] TRIFILIEFF A, BENCH A, HANLEY M, et al. PPAR-α and-γ but not-δ agonists inhibit airway inflammation in a murine model of asthma: in vitro evidence for an NF-κB-independent effect[J]. British J Pharmacology, 2003, 139(1): 163-171. doi: 10.1038/sj.bjp.0705232
[35] KOBAYASHI M, THOMASSEN M J, RAMBASEK T, et al. An inverse relationship between peroxisome proliferator-activated receptor gamma and allergic airway inflammation in an allergen challenge model[J]. Ann Allergy Asthma Immunol, 2005, 95(5): 468-473. doi: 10.1016/S1081-1206(10)61173-8




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号