Correlations of plasma Alarin level with glucose and lipid metabolism and chronic inflammation in newly diagnosed type 2 diabetic patients with obesity
-
摘要:目的 探讨初诊2型糖尿病合并肥胖患者血浆Alarin水平与糖脂代谢及慢性炎症的相关性。方法 选取300例糖尿病患者为研究对象,根据肥胖情况分为T2DM肥胖组(n=128例)和T2DM非肥胖组(n=172),另选同期健康体检的100例健康人员为对照组。采用酶联免疫吸附法(ELISA)检测各组血浆Alarin水平;比较各组空腹胰岛素(FINS)、餐后2 h胰岛素(2 hINS)、胰岛素抵抗指数(HOMA-IR)、血清糖化血红蛋白(HbAlc)、空腹血糖(FPG)、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、血清白细胞介素6(IL-6)、C反应蛋白(CRP)及肿瘤坏死因子-α(TNF-α)水平。结果 T2DM肥胖组血浆Alarin水平高于T2DM非肥胖组和对照组,差异有统计学意义(P < 0.05);T2DM非肥胖组血浆Alarin水平高于对照组,差异有统计学意义(P < 0.05)。T2DM肥胖组FINS、2 hINS及HOMA-IR水平高于T2DM非肥胖组和对照组,差异有统计学意义(P < 0.05);T2DM非肥胖组FINS、2 hINS及HOMA-IR水平高于对照组,差异有统计学意义(P < 0.05)。T2DM肥胖组HbAlc、FPG、TC、TG、LDL-C水平高于T2DM非肥胖组和对照组,HDL-C水平低于T2DM非肥胖组和对照组(P < 0.05);T2DM非肥胖组HbAlc、FPG、TC、TG、LDL-C水平高于对照组,HDL-C水平低于对照组,差异有统计学意义(P < 0.05)。T2DM肥胖组CRP、IL-6和TNF-α水平高于T2DM非肥胖组和对照组,,差异有统计学意义(P < 0.05)。T2DM非肥胖组CRP、IL-6和TNF-α水平高于对照组,差异有统计学意义(P < 0.05)。Pearson相关性分析表明,T2DM患者血浆Alarin与FINS、2hINS、HOMA-IR、HbAlc、FPG、TC、TG、LDL-C、CRP、IL-6和TNF-α水平呈正相关,与HDL-C水平呈负相关(P < 0.05)。结论 初诊2型糖尿病患者血浆Alarin水平明显升高,且与肥胖、糖脂代谢紊乱、胰岛素抵抗以及慢性炎症反应密切相关,血浆Alarin水平随代谢异常危险因素的增加而增高。Abstract:Objective To explore the correlations of plasma Alarin level and lipid metabolism, chronic inflammation in newly diagnosed type 2 diabetes patients with obesity.Methods A total of 300 patients with diabetes were selected as study subjects. According to the obesity situation, they were divided into T2DM obese group (n=128) and T2DM non-obese group (n=172). Another 100 healthy population who underwent physical examinations during the same period were selected as control group. Plasma Alarin levels were detected by enzyme linked immunosorbent assay (ELISA). Fasting insulin (FINS), 2 h postprandial insulin (2 hINS), insulin resistance index (HOMA-IR) and serum glycosylated hemoglobin (HbAlc), fasting plasma glucose (FPG), total cholesterol (TC), triglyceride (TG), low density lipoprotein cholesterol (LDL-C), high density lipoprotein cholesterol (HDL-C), serum interleukin 6 (IL-6) and C-reaction protein (CRP) and tumor necrosis factor-α(TNF-α) of different groups were compared.Results The plasma Alarin level of the T2DM obese group was significantly higher than that in the T2DM non-obese group and control group (P < 0.05), and was higher in the T2DM non-obese group than that in the control group (P < 0.05). The levels of FINS, 2 hINS and HOMA-IR in the T2DM obese group were significantly higher than those in the non-obese group and the control group, and were significantly higher in the T2DM non-obese group than those in the control group (P < 0.05). The levels of HbAlc, FPG, TC, TG and LDL-C in the T2DM obese group were significantly higher than those of the T2DM non-obese group and the control group, HDL-C level was significantly lower than that of the T2DM non-obese group and the control group (P < 0.05). The levels of HbAlc, FPG, TC, TG and LDL-C in the T2DM non-obese group were significantly higher than those of the control group, HDL-C level was significantly lower than the control group (P < 0.05). The levels of CRP, IL-6 and TNF-α in the T2DM obesity group were significantly higher than those in T2DM non-obesity group and control group, and were significantly higher in the T2DM non-obesity group than those in the control group (P < 0.05). Pearson correlation analysis showed that plasma Alarin was positively correlated with FINS, 2 hINS, HOMA-IR, HbAlc, FPG, TC, TG, LDL-C, CRP, IL-6 and TNF-α levels in T2DM patients (P < 0.05), and negatively correlated with HDL-C levels (P < 0.05).Conclusion The plasma Alarin level in newly diagnosed type 2 diabetic patients is significantly increased, which is closely related to obesity, glucose and lipid metabolism disorder, insulin resistance and chronic inflammatory response. Plasma Alarin level is increased with the increase of risk factors of metabolic abnormalities.
-
Keywords:
- newly diagnosed type 2 diabetes /
- obesity /
- Alarin /
- glycolipid metabolism /
- inflammatory response
-
2型糖尿病(T2DM)是一种以高血糖为特征的代谢紊乱性疾病,是多种遗传因素和环境因素相互作用的结果,主要表现为葡萄糖耐受不良[1]。2型糖尿病主要发病机制是胰岛素抵抗和胰岛细胞损伤,而胰岛素抵抗是T2DM发生和发展的关键原因[2]。Alarin是一种由25个氨基酸组成的神经肽,是从人类神经母细胞中分离出来的甘丙氨酸肽家族的最新成员[3], 可增强食欲,降低胰岛素敏感性和骨骼肌葡萄糖的摄取,被认为是与胰岛素抵抗和能量稳态相关的细胞因子[4]。本研究探讨初诊2型糖尿病合并肥胖患者血浆Alarin水平,并分析其与糖脂代谢及慢性炎症的相关性,旨在为进一步了解糖尿病发生和发展的作用机制提供参考依据。
1. 资料与方法
1.1 一般资料
选取2019年1—12月杨园社区卫生服务中心自愿接受管理的300例糖尿病患者为研究对象。T2DM的诊断参照中华医学会糖尿病学分会制定的《中国2型糖尿病防治指南(2013年版)》[5], 所有患者均符合T2DM的相关诊断标准。①患者有糖尿病症状,随机血糖≥11.1 mmol/L; ②空腹血糖≥7.0 mmol/L者; ③口服葡萄糖耐量试验2 h血糖≥11.1 mmol/L者。所测血糖均指静脉血浆葡萄糖,符合上述任意一项标准,经再次验证后T2DM诊断才能成立。纳入标准: ①患者均初次诊断为2型糖尿病; ② T2DM临床症状<1年者; ③未进行任何相关药物治疗者; ④社区65岁以上老年人免费体检人员、糖尿病慢病管理体检人员和“甜蜜人生”糖尿病社区沙龙活动符合要求的患者。排除标准: ① 1型糖尿病、妊娠糖尿病及其他类型糖尿病者; ②合并心、肝、肾等严重系统性疾病者; ③合并分泌系统疾病、恶性肿瘤者; ④合并精神病、感染性、自身免疫性疾病者; ⑤合并甲状腺功能低下者; ⑥因其他原因导致肥胖者。将300例患者根据肥胖情况分为T2DM肥胖组(n=128例)和T2DM非肥胖组(n=172例)。肥胖诊断标准: 根据中国成年人肥胖症的诊断标准,以体质量指数18.5~<24 kg/m2者为非肥胖,以体质量指数≥28 kg/m2者为肥胖。另选同期体检的100例健康人员作为对照组,正常对照进行口服葡萄糖耐量试验(OGTT)和胰岛素释放试验(IRT),空腹血糖负荷后2 h血糖均正常。所有入组对象均无耳科疾病史、糖尿病史、眼底病变及眩晕史。
1.2 方法
清晨采集各组空腹静脉血5 mL, 3 000转/min离心10 min, 待测。采用酶联免疫吸附法(ELISA)检测各组血浆Alarin水平,试剂盒购置美国Phoenix Pharmaceuticals公司。检测各组空腹胰岛素(FINS)、餐后2 h胰岛素(2 hINS)及胰岛素抵抗指数(HOMA-IR)。采用高压液相色谱法测定血清糖化血红蛋白(HbAlc); 采用AU680型全自动生化分析仪及配套试剂盒(美国贝克曼库尔特公司)检测空腹血糖(FPG)、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)。采用ELISA检测血清白细胞介素-6(IL-6)、C反应蛋白(CRP)及肿瘤坏死因子-α(TNF-α)水平,所用试剂盒购置美国BIOTANG公司。
1.3 统计学分析
采用SPSS 21.0进行数据处理与分析,计数资料以率表示,采用χ2检验; 计量资料以(x±s)表示,采用方差分析,相关性分析采用Pearson检验,检验水准为α= 0.05, P<0.05表示差异有统计学意义。
2. 结果
2.1 各组一般资料比较
3组除体质量指数外的一般资料比较,差异无统计学意义(P>0.05), 具有可比性,见表 1。
表 1 3组一般资料比较(x±s)组别 男 女 年龄/岁 体质量指数/(kg/m2) 收缩压/mmHg 舒张压/mmHg 对照组(n=100) 41 59 65.40±1.35 20.10±1.30 126.00±9.00 76.00±4.00 T2DM非肥胖组(n=172) 76 96 66.70±1.21 22.50±1.50* 125.00±6.00 74.00±6.00 T2DM肥胖组(n=128) 53 75 67.30±1.73 30.70±1.60*# 127.00±8.00 75.00±5.00 与对照组比较, * P<0.05; 与T2DM非肥胖组比较, #P<0.05。 2.2 各组血浆Alarin水平比较
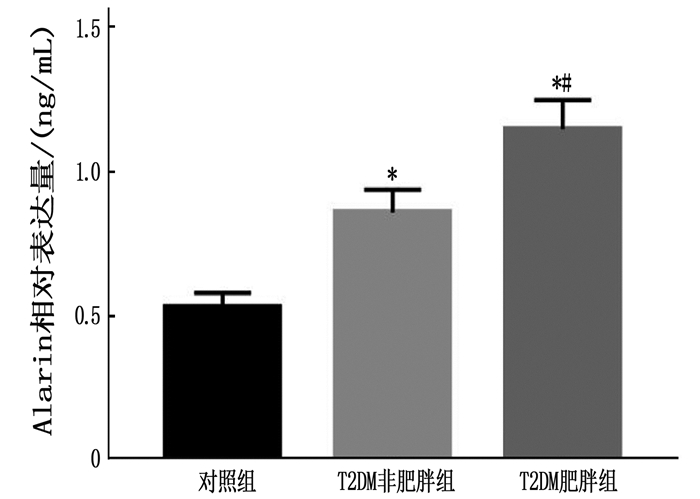
T2DM肥胖组血浆Alarin水平高于T2DM非肥胖组和对照组,差异有统计学意义(P<0.05); T2DM非肥胖组血浆Alarin水平高于对照组,差异有统计学意义(P<0.05),见图 1。
2.3 各组胰岛功能水平比较
T2DM肥胖组FINS、2 hINS及HOMA-IR水平高于T2DM非肥胖组和对照组,差异有统计学意义(P<0.05); T2DM非肥胖组FINS、2 hINS及HOMA-IR水平高于对照组,差异有统计学意义(P<0.05), 见表 2。
表 2 各组胰岛功能水平比较(x±s)组别 n FINS/(mU/L) 2 hINS/(mU/L) HOMA-IR 对照组 100 4.51±0.79 8.03±1.25 1.08±0.13 T2DM非肥胖组 172 8.69±1.01* 16.41±2.57* 4.11±0.72* T2DM肥胖组 128 12.36±1.87*# 22.34±2.95*# 6.56±1.62*# FINS: 空腹胰岛素; 2 hINS: 餐后2 h胰岛素; HOMA-IR: 胰岛素抵抗指数。
与对照组比较, * P<0.05; 与T2DM非肥胖组比较, #P<0.05。2.4 各组糖脂代谢水平比较
T2DM肥胖组HbAlc、FPG、TC、TG、LDL-C水平高于T2DM非肥胖组和对照组, HDL-C水平低于T2DM非肥胖组和对照组,差异有统计学意义(P<0.05); T2DM非肥胖组HbAlc、FPG、TC、TG、LDL-C水平高于对照组, HDL-C水平低于对照组,差异有统计学意义(P<0.05), 见表 3。
表 3 各组糖脂代谢水平比较(x±s)组别 n HbAlc/% FPG/(mmol/L) TC/(mmol/L) TG/(mmol/L) LDL-C/(mmol/L) HDL-C/(mmol/L) 对照组 100 5.03±0.24 4.65±0.41 4.19±0.31 1.06±0.11 2.38±0.25 1.54±0.16 T2DM非肥胖组 172 9.37±1.26* 8.48±0.82* 5.06±0.37* 2.03±0.24* 3.26±0.33* 1.23±0.23* T2DM肥胖组 128 11.23±1.59*# 9.47±0.93*# 5.34±0.39*# 2.64±0.29*# 3.87±0.37*# 1.12±0.26*# HbAlc: 糖化血红蛋白; FPG: 空腹血糖; TC: 总胆固醇; TG: 三酰甘油; LDL-C: 低密度脂蛋白胆固醇; HDL-C: 高密度脂蛋白胆固醇。
与对照组比较, * P<0.05; 与T2DM非肥胖组比较, #P<0.05。2.5 各组炎性因子水平比较
T2DM肥胖组CRP、IL-6和TNF-α水平高于T2DM非肥胖组和对照组,差异有统计学意义(P<0.05); T2DM非肥胖组CRP、IL-6和TNF-α水平高于对照组,差异有统计学意义(P<0.05),见表 4。
表 4 各组炎性因子水平比较(x±s)组别 n CRP/(mg/L) IL-6/(ng/L) TNF-α/(ng/L) 对照组 100 2.48±0.26 6.72±0.69 31.34±2.17 T2DM非肥胖组 172 5.46±1.33* 9.75±1.05* 49.56±2.68* T2DM肥胖组 128 9.18±1.59*# 15.21±2.04*# 69.47±5.56*# IL-6: 白细胞介素-6; CRP: C反应蛋白; TNF-α: 肿瘤坏死因子-α。与对照组比较, * P<0.05; 与T2DM非肥胖组比较, #P<0.05。 2.6 血浆Alarin与胰岛功能、糖脂代谢及炎性因子水平的相关性分析
Pearson相关性分析表明, T2DM患者血浆Alarin与FINS、2 hINS、HOMA-IR、HbAlc、FPG、TC、TG、LDL-C、CRP、IL-6和TNF-α水平呈正相关(P<0.05), 与HDL-C水平呈负相关(P<0.05), 见表 5。
表 5 血浆Alarin与胰岛功能、糖脂代谢及炎性因子水平的相关性分析指标 血浆Alarin r P 空腹胰岛素 0.608 <0.001 餐后2 h胰岛素 0.643 <0.001 胰岛素抵抗指数 0.597 <0.001 糖化血红蛋白 0.554 <0.001 空腹血糖 0.612 <0.001 总胆固醇 0.701 <0.001 三酰甘油 0.527 <0.001 低密度脂蛋白胆固醇 0.614 <0.001 高密度脂蛋白胆固醇 -0.503 <0.001 C反应蛋白 0.574 <0.001 白细胞介素-6 0.609 <0.001 肿瘤坏死因子-α 0.598 <0.001 3. 讨论
近年来,2型糖尿病的发病率不断升高,且趋于年轻化态势[6]。遗传因素、饮食习惯等因素导致肥胖和胰岛素抵抗,这是T2DM形成级联事件的关键机制[7], 肥胖患者常伴有高胰岛素血症,是造成胰岛素抵抗的重要原因之一。肥胖是一种能源内稳态失衡的结果,是能量摄入超过能量消耗,多余的能量储存在脂肪,进而导致肥胖[8]。脂肪组织在体内以甘油三酯的形式储存,当膳食摄取的能量持续超过能量消耗时,脂肪组织会通过现有脂肪细胞的增厚和新脂肪细胞的产生而扩张,导致肥胖[9]。异常肥大的脂肪细胞可分泌多种脂肪因子,可进一步干扰糖脂代谢,促进炎性细胞因子的表达和分泌,降低胰岛素敏感性,从而导致胰岛素抵抗[10]。本研究表明, T2DM肥胖组FINS、2 hINS、HOMA-IR、HbAlc、FPG、TC、TG、LDL-C、CRP、IL-6和TNF-α水平高于T2DM非肥胖组和对照组, T2DM非肥胖组FINS、2 hINS、HOMA-IR、HbAlc、FPG、TC、TG、LDL-C、CRP、IL-6和TNF-α水平高于对照组, T2DM肥胖组HDL-C水平低于T2DM非肥胖组和对照组, T2DM非肥胖组HDL-C水平低于对照组,差异均有统计学意义(P<0.05)。可见,肥胖的T2DM患者胰岛功能、糖脂代谢及慢性炎症变化程度更加明显,原因可能与胰岛素抵抗有关。
脂肪细胞因子来源于脂肪组织,在调节葡萄糖、脂质和能量代谢方面的重要性已得到了广泛的证明,而脂肪因子分泌失调对人类代谢疾病(如肥胖、动脉粥样硬化、T2DM)的发病起着重要作用[11]。既往研究[12]表明,脂肪因子与肥胖的发病机制密切相关,但新型脂肪因子与肥胖及糖尿病发生的关系仍缺乏研究。Alarin是一种由25个氨基酸组成的血管活性肽[13]。据报道,在小鼠模型中, Alarin可刺激黄体生成素和促性腺激素释放激素的分泌,促进食欲[14]。另有研究[15-16]指出,Alarin作为一种饮食调节因子对促进食欲、增加体质量有重要作用。饮食调节因子在糖尿病的发生和发展中扮演着重要角色,如由白色脂肪产生的瘦素主要作用于下丘脑,能够抑制食欲,并通过激活交感神经系统来间接调节糖脂代谢[17-18]。此外, Alarin在代谢障碍患者中表达明显升高,且与胰岛素抵抗显著相关。本研究同样发现,T2DM肥胖组血浆Alarin水平高于T2DM非肥胖组和对照组, T2DM非肥胖组血浆Alarin水平高于对照组。由此可见, Alarin是一种与胰岛素抵抗和能量稳态相关的细胞因子。Pearson相关性分析表明, T2DM患者血浆Alarin与FINS、2 hINS、HOMA-IR、HbAlc、FPG、TC、TG、LDL-C、CRP、IL-6和TNF-α水平呈正相关,与HDL-C水平呈负相关。可见,血浆Alarin与糖尿病患者的糖脂代谢水平、胰岛素抵抗及慢性炎症程度密切相关,可能在T2DM的发生和发展中扮演重要角色。
综上所述,初诊T2DM患者血浆Alarin水平明显升高,且与肥胖、糖脂代谢紊乱、胰岛素抵抗以及慢性炎症反应密切相关,血浆Alarin水平随代谢异常危险因素的增加而增高。深入研究具体作用机制有助于为防治T2DM合并肥胖患者提供新的药物靶点。
-
表 1 3组一般资料比较(x±s)
组别 男 女 年龄/岁 体质量指数/(kg/m2) 收缩压/mmHg 舒张压/mmHg 对照组(n=100) 41 59 65.40±1.35 20.10±1.30 126.00±9.00 76.00±4.00 T2DM非肥胖组(n=172) 76 96 66.70±1.21 22.50±1.50* 125.00±6.00 74.00±6.00 T2DM肥胖组(n=128) 53 75 67.30±1.73 30.70±1.60*# 127.00±8.00 75.00±5.00 与对照组比较, * P<0.05; 与T2DM非肥胖组比较, #P<0.05。 表 2 各组胰岛功能水平比较(x±s)
组别 n FINS/(mU/L) 2 hINS/(mU/L) HOMA-IR 对照组 100 4.51±0.79 8.03±1.25 1.08±0.13 T2DM非肥胖组 172 8.69±1.01* 16.41±2.57* 4.11±0.72* T2DM肥胖组 128 12.36±1.87*# 22.34±2.95*# 6.56±1.62*# FINS: 空腹胰岛素; 2 hINS: 餐后2 h胰岛素; HOMA-IR: 胰岛素抵抗指数。
与对照组比较, * P<0.05; 与T2DM非肥胖组比较, #P<0.05。表 3 各组糖脂代谢水平比较(x±s)
组别 n HbAlc/% FPG/(mmol/L) TC/(mmol/L) TG/(mmol/L) LDL-C/(mmol/L) HDL-C/(mmol/L) 对照组 100 5.03±0.24 4.65±0.41 4.19±0.31 1.06±0.11 2.38±0.25 1.54±0.16 T2DM非肥胖组 172 9.37±1.26* 8.48±0.82* 5.06±0.37* 2.03±0.24* 3.26±0.33* 1.23±0.23* T2DM肥胖组 128 11.23±1.59*# 9.47±0.93*# 5.34±0.39*# 2.64±0.29*# 3.87±0.37*# 1.12±0.26*# HbAlc: 糖化血红蛋白; FPG: 空腹血糖; TC: 总胆固醇; TG: 三酰甘油; LDL-C: 低密度脂蛋白胆固醇; HDL-C: 高密度脂蛋白胆固醇。
与对照组比较, * P<0.05; 与T2DM非肥胖组比较, #P<0.05。表 4 各组炎性因子水平比较(x±s)
组别 n CRP/(mg/L) IL-6/(ng/L) TNF-α/(ng/L) 对照组 100 2.48±0.26 6.72±0.69 31.34±2.17 T2DM非肥胖组 172 5.46±1.33* 9.75±1.05* 49.56±2.68* T2DM肥胖组 128 9.18±1.59*# 15.21±2.04*# 69.47±5.56*# IL-6: 白细胞介素-6; CRP: C反应蛋白; TNF-α: 肿瘤坏死因子-α。与对照组比较, * P<0.05; 与T2DM非肥胖组比较, #P<0.05。 表 5 血浆Alarin与胰岛功能、糖脂代谢及炎性因子水平的相关性分析
指标 血浆Alarin r P 空腹胰岛素 0.608 <0.001 餐后2 h胰岛素 0.643 <0.001 胰岛素抵抗指数 0.597 <0.001 糖化血红蛋白 0.554 <0.001 空腹血糖 0.612 <0.001 总胆固醇 0.701 <0.001 三酰甘油 0.527 <0.001 低密度脂蛋白胆固醇 0.614 <0.001 高密度脂蛋白胆固醇 -0.503 <0.001 C反应蛋白 0.574 <0.001 白细胞介素-6 0.609 <0.001 肿瘤坏死因子-α 0.598 <0.001 -
[1] 郭哲, 宁金月, 王玉沙. 2型糖尿病患者BMI与HbAlc、胰岛素抵抗及肾损害指标的相关性分析[J]. 川北医学院学报, 2020, 35(2): 297-300. doi: 10.3969/j.issn.1005-3697.2020.02.031 [2] WEI X, GU N, FENG N, et al. Inhibition of p38 mitogen-activated protein kinase exerts a hypoglycemic effect by improving β cell function via inhibition of β cell apoptosis in db/db mice[J]. J Enzyme Inhib Med Chem, 2018, 33(1): 1494-1500. doi: 10.1080/14756366.2018.1477138
[3] HU W, FAN X, ZHOU B, et al. Circulating alarin concentrations are high in patients with type 2 diabetes and increased by glucagon-like peptide-1 receptor agonist treatment: an Consort-compliant study[J]. Medicine: Baltimore, 2019, 98(28): e16428. doi: 10.1097/MD.0000000000016428
[4] FANG X, ZHANG T, YANG M, et al. High circulating alarin levels are associated with presence of metabolic syndrome[J]. Cell Physiol Biochem, 2018, 51(5): 2041-2051. doi: 10.1159/000495823
[5] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版)[J]. 中华内分泌代谢杂志, 2021, 37(4): 311-398. doi: 10.3760/cma.j.cn311282-20210304-00142 [6] LI M, HE Q, CHEN Y, et al. Xuezhikang capsule for type 2 diabetes with hyperlipemia: a systematic review and meta-analysis of randomized clinical trails[J]. Evid Based Complement Alternat Med, 2015, 2015: 468520. http://europepmc.org/articles/PMC4515518?pdf=render
[7] CIGROVSKI BERKOVIC M, VIROVIC-JUKIC L, BILIC-CURCIC I, et al. Post-transplant diabetes mellitus and preexisting liver disease-a bidirectional relationship affecting treatment and management[J]. World J Gastroenterol, 2020, 26(21): 2740-2757. doi: 10.3748/wjg.v26.i21.2740
[8] ZHANG C, HE X, SHENG Y, et al. Allicin regulates energy homeostasis through brown adipose tissue[J]. iScience, 2020, 23(5): 101113. doi: 10.1016/j.isci.2020.101113
[9] HUANG J Y, CHIANG M T, CHAU L Y. Adipose overexpression of heme oxygenase-1 does not protect against high fat diet-induced insulin resistance in mice[J]. PLoS One, 2013, 8(2): e55369. doi: 10.1371/journal.pone.0055369
[10] LI Y, LIU B, LI Y, et al. Epicardial fat tissue in patients with diabetes mellitus: a systematic review and meta-analysis[J]. Cardiovasc Diabetol, 2019, 18(1): 3. doi: 10.1186/s12933-019-0807-3
[11] PARK S, SON H K, CHANG H C, et al. Effects of Cabbage-Apple Juice Fermented by Lactobacillus plantarum EM on Lipid Profile Improvement and Obesity Amelioration in Rats[J]. Nutrients, 2020, 12(4): 1135. doi: 10.3390/nu12041135
[12] OHLSSON B, ROTH B, LARSSON E, et al. Calprotectin in serum and zonulin in serum and feces are elevated after introduction of a diet with lower carbohydrate content and higher fiber, fat and protein contents[J]. Biomed Rep, 2017, 6(4): 411-422. doi: 10.3892/br.2017.865
[13] JUSZCZAK F, CARON N, MATHEW A V, et al. Critical Role for AMPK in Metabolic Disease-Induced Chronic Kidney Disease[J]. Int J Mol Sci, 2020, 21(21): 7994. doi: 10.3390/ijms21217994
[14] EBERHARD N, MAYER C, SANTIC R, et al. Distribution of alarin immunoreactivity in the mouse brain[J]. J Mol Neurosci, 2012, 46(1): 18-32. doi: 10.1007/s12031-011-9546-y
[15] MIKÓA, BALLA P, TENK J, et al. Thermoregulatory effect of alarin, a new member of the galanin peptide family[J]. Temperature: Austin, 2014, 1(1): 51-56. doi: 10.4161/temp.29790
[16] 谢芳, 李强, 赵爱国, 等. 外周血LncRNA-p3134表达水平在妊娠期糖尿病诊断中的价值[J]. 实用临床医药杂志, 2021, 25(20): 106-110. doi: 10.7619/jcmp.20211287 [17] EL-ASRAR M A, ELBARBARY N S, ISMAIL E A, et al. Serum YKL-40 in young patients with β-thalassemia major: Relation to hepatitis C virus infection, liver stiffness by transient elastography and cardiovascular complications[J]. Blood Cells Mol Dis, 2016, 56(1): 1-8. doi: 10.1016/j.bcmd.2015.09.006
[18] 刘建丽, 刘力铭, 杨晓莹. 3种胰岛自身抗体与1型糖尿病患儿并发肾损害的关系研究[J]. 实用临床医药杂志, 2021, 25(21): 119-123. doi: 10.7619/jcmp.20212482 -
期刊类型引用(5)
1. 叶晓晓,杨清敏. 司美格鲁肽联合短期胰岛素强化治疗初诊2型糖尿病并肥胖症的临床效果. 临床医学研究与实践. 2025(05): 49-52 .  百度学术
百度学术
2. 康艳艳,薛萍,和旭丽. Apo A5、Alarin、C5a在单纯肥胖儿童高胰岛素血症中评估价值及临床意义. 遵义医科大学学报. 2024(02): 174-179 .  百度学术
百度学术
3. 张凤杰,曹亮,朱晓亮. 2型糖尿病合并肥胖患者肠道菌群分布及其与糖脂代谢和炎症指标的相关性. 中国微生态学杂志. 2024(02): 180-184+190 .  百度学术
百度学术
4. 张臣臣,刘艳玲. 急性生理学与慢性健康状况评分系统Ⅱ评分联合血清糖化血红蛋白、乳酸脱氢酶水平评估急性胰腺炎患者病情严重程度及预后的价值. 实用临床医药杂志. 2024(17): 62-67 .  本站查看
本站查看
5. 朱会娟,孙铁峰,齐振勇. 2型糖尿病脂质代谢水平与下肢血管病变的相关性分析. 糖尿病新世界. 2023(03): 171-173+181 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号