Correlations of serum glucose-dependent insulin releasing peptide and fibroblast growth factor-23 levels with abnormal postpartum glucose metabolism in patients with gestational diabetes mellitus
-
摘要:目的
探讨妊娠期糖尿病(GDM)患者血清葡萄糖依赖性促胰岛素释放肽(GIP)、成纤维细胞生长因子-23(FGF23)水平与产后糖代谢异常的关系。
方法选取82例确诊GDM患者为研究对象, 并采集静脉血检测血清GIP、FGF23水平。产后12周采用75 g葡萄糖耐量试验(OGTT)评估患者糖代谢状态,并根据结果将GDM患者分为糖代谢正常组66例和糖代谢异常组16例。采用多因素Logistic回归模型分析影响GDM患者产后糖代谢异常的因素; 采用受试者工作特征(ROC)曲线分析血清GIP、FGF23预测GDM患者产后糖代谢异常的价值。
结果糖代谢异常组血清GIP水平低于糖代谢正常组, FGF23水平高于糖代谢正常组,差异有统计学意义(P < 0.01)。孕前高体质量指数(BMI)、高FGF23是GDM患者产后糖代谢异常的危险因素(P < 0.05), 高GIP是保护因素(P < 0.05)。GIP、FGF23、孕前BMI预测GDM患者产后糖代谢异常的曲线下面积(AUC)分别为0.717、0.625、0.699, GIP、FGF23、孕前BMI联合预测GDM患者产后糖代谢异常的AUC为0.890, 高于GIP、FGF23、孕前BMI单独预测价值(P < 0.05)。
结论GDM产后糖代谢紊乱患者血清GIP水平降低, FGF23水平增高,且与产后糖代谢异常有关。血清GIP和FGF23可预测GDM患者产后糖代谢异常风险。
-
关键词:
- 妊娠期糖尿病 /
- 葡萄糖依赖性促胰岛素释放肽 /
- 成纤维细胞生长因子-23 /
- 产后糖代谢异常
Abstract:ObjectiveTo explore the correlations of serum glucose-dependent insulin releasing peptide (GIP) and fibroblast growth factor-23 (FGF23) levels with abnormal postpartum glucose metabolism in patients with gestational diabetes mellitus (GDM).
MethodsA total of 82 patients with GDM were selected as research objects, and they were conducted with venous blood collection for detection of serum GIP and FGF23 levels. At 12 weeks after delivery, the 75 g oral glucose tolerance test (OGTT) was used to evaluate glucose metabolism status, and the GDM patients were divided into normal glucose metabolism group (n=66) and abnormal glucose metabolism group (n=16) according to the result of OGTT. Multivariate Logistic regression model was used to analyze the factors affecting abnormal postpartum glucose metabolism in GDM patients; the receiver operating characteristic (ROC) curve was used to analyze the values of serum GIP and FGF23 in predicting abnormal postpartum glucose metabolism in GDM patients.
ResultsThe serum GIP level in the abnormal glucose metabolism group was significantly lower than that in the normal glucose metabolism group, while the FGF23 level was significantly higher than that in the normal glucose metabolism group (P < 0.05). High pre-pregnancy body mass index (BMI) and high FGF23 were the risk factors for abnormal postpartum glucose metabolism in GDM patients, while high GIP was a protective factor (P < 0.05). The values of area under the curve (AUC) of GIP, FGF23 and pre-pregnancy BMI in predicting abnormal postpartum glucose metabolism in GDM patients were 0.717, 0.625 and 0.699 respectively, and the AUC of GIP combined with FGF23 and pre-pregnancy BMI in predicting abnormal postpartum glucose metabolism in GDM patients was 0.890, which was significantly higher than that of GIP, pre-pregnancy BMI or FGF23 alone (P < 0.05).
ConclusionIn GDM patients with abnormal postpartum glucose metabolism, serum GIP level reduces while FGF23 level increases, and these two indexes are related to abnormal postpartum glucose metabolism. Serum GIP and FGF23 can predict the risk of abnormal postpartum glucose metabolism in GDM patients.
-
妊娠期糖尿病(GDM)是妊娠中期或晚期发病或首次诊断的葡萄糖耐受不良,是产后发生2型糖尿病(T2DM)的危险因素,与无GDM病史的产妇相比, GDM患者产后患T2DM的风险增高7倍[1]。为降低产后T2DM的患病风险,建议GDM产妇产后进行终身的糖代谢评估,但产后T2DM筛查存在各种影响因素,患者对T2DM筛查建议的依从性不足,若能有效筛查出产后糖代谢异常的高危人群,可提高GDM患者产后糖代谢评估依从性,降低T2DM风险[2]。葡萄糖依赖性促胰岛素释放肽(GIP)是一种肠促胰岛素激素,通过肠道内分泌细胞对营养物质消耗的反应而分泌,参与餐后代谢,可增加胰岛素分泌并维持正常的葡萄糖耐量[3]。成纤维细胞生长因子-23(FGF23)是一种由骨细胞产生和分泌的糖蛋白,属于内分泌成纤维细胞生长因子的一个亚家族,参与维生素D代谢和血磷水平的调节,与胰岛素抵抗也存在密切关系[4]。本研究检测GDM患者血清GIP、FGF23水平,分析其与GDM患者产后糖代谢异常的关联性,现报告如下。
1. 资料与方法
1.1 一般资料
选取2017年6月—2022年8月收治的82例GDM患者为研究对象。纳入标准: ①妊娠24~28周接受葡萄糖耐量筛查者,筛查前晚餐后禁食至少8 h; ②经葡萄糖耐量试验证实为GDM者,符合《妊娠合并糖尿病诊治指南(2014)》[5]相关诊断标准; ③书面知情同意本研究者。排除标准: ①试管婴儿或人工授精受孕者; ②多胎妊娠者; ③孕前糖尿病或合并妊娠期高血压疾病、妊娠期肝内胆汁淤积等合并症者; ④合并甲亢、甲减、肾上腺皮质疾病等其他内分泌疾病者; ⑤产后服用糖皮质激素、利尿剂、解热镇痛药等影响糖代谢分泌的药物者; ⑥产后12周内再次受孕者。所有患者产后12周门诊复查,采用75 g葡萄糖耐量试验(OGTT)评估糖代谢状态,糖代谢状态包括糖代谢正常(空腹血糖 < 6.1 mmol/L, 糖负荷后2 h血糖 < 7.8 mmol/L)、空腹血糖受损(空腹血糖≥6.1~ < 7.0 mmol/L, 糖负荷后2 h血糖 < 7.8 mmol/L)、糖耐量受损(空腹血糖 < 7.0 mmol/L, 糖负荷后2 h血糖≥7.8~ < 11.1 mmol/L)、T2DM(空腹血糖≥7.0 mmol/L, 糖负荷后2 h血糖≥11.1 mmol/L)[6]。将糖代谢正常者纳入糖代谢正常组(n=66), 空腹血糖受损、糖耐量受损和T2DM者纳入糖代谢异常组(n=16)。本研究已经获得医院伦理委员会批准。
1.2 方法
1.2.1 临床资料收集
收集患者年龄、孕前和产后体质量指数(BMI)、收缩压、舒张压、糖尿病家族史、孕次、产次、是否使用胰岛素、新生儿体质量、产后喂养方式。另收集诊断GDM时检测的空腹血糖、糖负荷后1 h血糖、糖负荷后2 h血糖、空腹胰岛素、总胆固醇、甘油三酯、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇。血糖采用葡萄糖氧化酶法测定,血脂采用AU5800全自动生化分析仪(美国贝克曼库尔特公司)测定,空腹胰岛素采用化学发光免疫法测定。
1.2.2 血清GIP、FGF23水平检测
诊断GDM时采集清晨空腹静脉血3 mL, 注入干燥试管,室温静置后取上层液离心(3 000转/min离心5 min, 离心半径15 cm), 提取上层血清保存于-80 ℃环境中备检。采用酶联免疫吸附试验检测血清GIP、FGF23水平, GIP试剂盒购自上海酶联生物科技有限公司(货号ml027994), FGF23试剂盒购自上海科艾博生物科技有限公司(货号CB14924-Hu), GIP、FGF23试剂盒组内变异系数分别为2.47、4.04, 组间变异系数分别为3.08、5.46。仪器为Elx800酶标仪(美国Biotek公司),测定450 nm波长下的吸光度,通过标准曲线计算样品中GIP、FGF23的水平。
1.3 统计学分析
采用SPSS 25.00进行数据分析,计量资料符合正态分布以(x±s)表示,比较采用独立样本t检验。计数资料以[n(%)]表示,比较采用χ2检验。采用多因素Logistic回归模型分析影响GDM患者产后糖代谢异常的因素,采用受试者工作特征(ROC)曲线分析血清GIP、FGF23预测GDM患者产后糖代谢异常的价值。检验水准α=0.05, P < 0.05为差异有统计学意义。
2. 结果
2.1 糖代谢正常组与糖代谢异常组基线资料比较
糖代谢异常组的孕前BMI、空腹血糖、糖负荷后2 h血糖高于糖代谢正常组,母乳喂养比率低于糖代谢正常组,差异有统计学意义(P < 0.01); 2组年龄、产后BMI、收缩压、舒张压、糖尿病家族史、孕次、产次、是否使用胰岛素、新生儿体质量比较,差异无统计学意义(P>0.05), 见表 1。
表 1 糖代谢正常组与糖代谢异常组基线资料比较(x±s)[n(%)]基线资料 分类 糖代谢异常组(n=16) 糖代谢正常组(n=66) t/χ2 P 年龄/岁 30.65±5.19 29.72±4.98 0.665 0.508 体质量指数/(kg/m2) 孕前 24.65±1.65 23.06±1.27 4.228 < 0.001 产后 23.21±1.02 23.09±1.13 0.387 0.700 收缩压/mmHg 126.35±13.65 125.04±12.74 0.364 0.717 舒张压/mmHg 76.35±9.29 75.04±9.38 0.502 0.617 糖尿病家族史 有 5(31.25) 19(28.79) 0.038 0.846 无 11(68.75) 47(71.21) 孕次/次 2.35±0.43 2.26±0.39 0.812 0.419 产次/次 1.02±0.28 0.96±0.24 0.868 0.388 使用胰岛素治疗 是 7(43.75) 23(34.85) 0.440 0.507 否 9(56.25) 43(65.15) 新生儿体质量/g 3 302.35±236.59 3 298.15±241.07 0.063 0.950 产后喂养方式 母乳喂养 4(25.00) 42(63.64) 7.806 0.005 人工喂养 12(75.00) 24(36.36) 空腹血糖/(mmol/L) 6.95±1.03 5.12±0.69 8.581 < 0.001 糖负荷后1 h血糖/(mmol/L) 9.42±2.16 9.26±2.03 0.279 0.781 糖负荷后2 h血糖/(mmol/L) 9.02±2.07 7.12±0.43 6.982 < 0.001 空腹胰岛素/(mmol/L) 15.12±2.35 14.06±2.19 1.713 0.091 总胆固醇/(mmol/L) 5.12±0.53 5.09±0.49 0.216 0.829 低密度脂蛋白胆固醇/(mmol/L) 3.16±0.42 3.10±0.37 0.567 0.572 甘油三酯/(mmol/L) 1.96±0.35 1.95±0.42 0.088 0.930 高密度脂蛋白胆固醇/(mmol/L) 2.05±0.37 2.10±0.39 0.464 0.644 2.2 糖代谢正常组与糖代谢异常组血清GIP、FGF23水平比较
糖代谢异常组血清GIP水平低于糖代谢正常组, FGF23水平高于糖代谢正常组,差异有统计学意义(P < 0.01), 见表 2。
表 2 糖代谢正常组与糖代谢异常组血清GIP、FGF23水平比较(x±s)组别 n GIP/(pg/mL) FGF23/(ng/L) 糖代谢异常组 16 76.35±21.07** 102.35±26.09** 糖代谢正常组 66 132.54±32.46 45.35±12.17 GIP: 葡萄糖依赖性促胰岛素释放肽;
FGF23: 成纤维细胞生长因子-23。
与糖代谢正常组比较, * * P < 0.01。2.3 GDM患者产后糖代谢异常的危险因素
以孕前BMI、空腹血糖、糖负荷后2 h血糖、GIP、FGF23、喂养方式(赋值: 0=母乳喂养, 1=人工喂养)为自变量,以GDM患者产后糖代谢异常为因变量(赋值: 0=否, 1=是),向后逐步法排除无关变量,孕前高BMI、高FGF23是GDM患者产后糖代谢异常的危险因素(P < 0.05), 高GIP是保护因素(P < 0.05), 见表 3。
表 3 GDM患者产后糖代谢异常的危险因素因素 β SE Wald χ2 OR(95%CI) P 常数项 6.352 2.468 6.624 — 0.012 孕前BMI 1.057 0.342 9.552 2.878(1.472~5.626) < 0.001 GIP -0.421 0.163 6.671 0.656(0.477~0.903) 0.010 FGF23 0.651 0.217 9.000 1.917(1.253~2.933) < 0.001 2.4 GIP、FGF23预测GDM患者产后糖代谢异常的价值
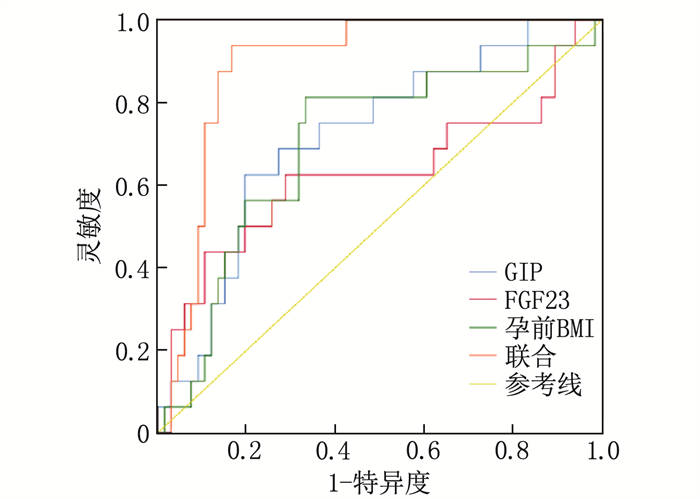
GIP、FGF23、孕前BMI预测GDM患者产后糖代谢异常的曲线下面积(AUC)分别为0.717、0.625、0.699, GIP、FGF23、孕前BMI联合预测GDM患者产后糖代谢异常的AUC为0.890, 高于GIP、FGF23、孕前BMI单独预测的价值(Z=2.701、2.845、2.579, P < 0.05), 见表 4、图 1。
表 4 GIP、FGF23、孕前BMI预测GDM患者产后糖代谢异常的价值因素 AUC(95%CI) 临界值 灵敏度/% 特异度/% 约登指数 GIP 0.717(0.607~0.811) 101.35 pg/mL 68.75 72.73 0.414 8 FGF23 0.625(0.511~0.730) 72.94 ng/L 62.50 69.70 0.322 0 孕前BMI 0.699(0.588~0.795) 23.51 kg/m2 75.00 68.18 0.431 8 联合 0.890(0.802~0.949) — 93.75 83.33 0.770 8 3. 讨论
GDM是妊娠期间母体β细胞对胰岛素反应缺陷导致的糖耐受不良,虽然GDM产妇糖耐量通常在分娩后恢复正常,但GDM与持续长期代谢功能障碍和显性糖尿病的风险升高有关, GDM女性分娩后胰岛β细胞分泌能力和胰岛素敏感性的恶化速度更快,有GDM病史的女性发生产后T2DM及其并发症的风险较高,并且可能比无GDM的女性更早发生T2DM[7]。GDM女性产后T2DM的患病率为2.6%~70.0%, 与一般人群相比, GDM女性患T2DM的年龄相对较轻,患心血管疾病、非酒精性脂肪肝、肾脏疾病和发生早期死亡的风险更高[8]。因此,有必要探讨GDM向T2DM转变的潜在原因,临床多通过产后6~12周75 g OGTT筛查糖代谢异常风险,但空腹血糖和OGTT后2 h血浆葡萄糖水平的鉴别能力有限,且具有滞后性,不能早期预测糖代谢异常风险,故而需要一种简化的和更准确的标志物对GDM患者产后的糖代谢异常风险进行分层,以提高对糖代谢异常的识别效能。
GIP是一种由十二指肠和空肠黏膜上皮K细胞合成并分泌的肽激素,属于胃肠调节肽家族的一员, GIP基因位于染色体17q21.3~q22, 具有显著的促胰岛素分泌活性,高脂和高碳水化合物膳食能刺激GIP的表达和分泌, GIP通过与胰岛细胞膜上的GIP受体(GIPR)特异性结合激活腺苷酸环化酶-环磷酸腺苷-蛋白激酶A通路,开放钙通道,促使钙离子内流,继而刺激胰岛素原基因转录,促使胰岛素β细胞分泌胰岛素,发挥降血糖的作用[9]。GIP在妊娠后血糖调节中起重要作用,既往研究[10]显示GDM患者血清GIP水平显著下降,较低的GIP与GDM发病风险增加有关。本研究发现GIP与GDM患者产后糖代谢异常也有关,糖代谢异常组血清GIP水平低于糖代谢正常组, GIP是GDM产后糖代谢异常的保护性因素,表明GIP的正常分泌可能维持分娩后正常的糖耐量,降低糖代谢异常风险, GIP表达降低则使其促胰岛素分泌作用减弱,因此糖代谢异常风险增加。分析可能的机制为: 首先, GIP可直接增强外周靶组织对胰岛素的敏感性,增加胰岛素的降糖作用[11]; 其次, GIP也被证明以旁分泌的方式作用于邻近β细胞并促进β细胞存活,并刺激胰岛α细胞释放胰高血糖素样肽-1,改善葡萄糖代谢[12]; 最后, GIP可通过激活5′-磷酸腺苷(AMP)依赖的蛋白激酶/磷脂酰肌醇3-激酶/蛋白激酶B信号通路,减少活性氧的产生,抑制氧化应激反应,减少炎症细胞因子的释放,改善胰岛素抵抗状态[13],降低产后糖代谢异常风险。ROC曲线显示,血清GIP水平可预测GDM患者产后糖代谢异常的风险,提示临床通过检测孕中后期血清GIP水平可能识别产后糖代谢异常高危人群,对指导临床GDM治疗和产后糖代谢评估有重要的意义。
FGF23是一种骨髓来源的激素,在磷酸盐和钙代谢的调节过程中发挥重要作用, FGF23由成骨细胞和骨细胞分泌以应对磷酸盐水平升高,防止磷酸盐在肾近端小管再摄取。FGF23还是维生素D激素产生的有效抑制因子,可通过抑制1-α-羟化酶活性阻止25-羟基维生素D向活性形式的转化,反之当维生素D和磷酸盐水平增加时可刺激骨细胞FGF23的产生[14]。研究[15]显示FGF23与糖尿病及其并发症密切相关,糖尿病患者血清FGF23水平增高与糖尿病肾病进展有关, FGF23水平增高是T2DM患者颈动脉内-中膜厚度增加、动脉粥样硬化的危险因素[16]。GDM患者血清FGF23水平也显著增高,且与血脂血糖水平增高以及胰岛素抵抗有关[17]。本研究发现GDM患者血清FGF23水平增高是产后发生糖代谢异常的危险因素,说明FGF23水平增高可能提示产后糖代谢紊乱风险,对临床预防产后糖代谢异常有着积极的意义。FGF23参与GDM产后糖代谢异常的机制尚不清楚,推测可能是磷酸盐和钙代谢异常与糖代谢紊乱有关,血清磷酸盐水平降低可导致静息细胞内钙浓度增高,胰岛三磷酸腺苷的生成和胰岛素分泌减少,引起血糖水平增高和糖代谢紊乱,而补充磷酸盐有助于增加胰岛素的敏感性,降低血糖[18]。另外, FGF23与胰岛素抵抗也存在密切关系, FGF23通过激活磷酸肌苷3激酶/蛋白激酶B/信号转导因子叉头盒蛋白O1负向调控胰岛素水平,增加血糖水平,导致胰岛素抵抗[4]。由此可见, FGF23水平增高可能抑制胰岛素分泌,增加胰岛素抵抗,进而增加产后糖代谢紊乱的风险。ROC曲线分析显示, FGF23预测GDM患者产后糖代谢紊乱的AUC为0.625, 表明FGF23可作为GDM患者产后糖代谢紊乱的标志物,为临床产后糖代谢紊乱预测提供参考。
回归分析结果显示产前高BMI与GDM患者产后糖代谢异常也有关,说明肥胖可能增加产后糖代谢异常以及罹患T2DM风险,这与肥胖导致糖脂代谢紊乱和胰岛素抵抗有关。ROC曲线显示,联合GIP、FGF23和产前BMI可提高对GDM患者产后糖代谢紊乱的预测价值,表明GIP水平降低、FGF23水平增高且BMI增加预示更高的糖代谢紊乱风险。
综上所述, GDM产后糖代谢紊乱患者血清GIP水平降低, FGF23水平增高,低水平GIP和高水平FGF23与产后糖代谢异常有关,检测血清GIP和FGF23水平有助于预测GDM患者产后糖代谢异常的风险。
-
表 1 糖代谢正常组与糖代谢异常组基线资料比较(x±s)[n(%)]
基线资料 分类 糖代谢异常组(n=16) 糖代谢正常组(n=66) t/χ2 P 年龄/岁 30.65±5.19 29.72±4.98 0.665 0.508 体质量指数/(kg/m2) 孕前 24.65±1.65 23.06±1.27 4.228 < 0.001 产后 23.21±1.02 23.09±1.13 0.387 0.700 收缩压/mmHg 126.35±13.65 125.04±12.74 0.364 0.717 舒张压/mmHg 76.35±9.29 75.04±9.38 0.502 0.617 糖尿病家族史 有 5(31.25) 19(28.79) 0.038 0.846 无 11(68.75) 47(71.21) 孕次/次 2.35±0.43 2.26±0.39 0.812 0.419 产次/次 1.02±0.28 0.96±0.24 0.868 0.388 使用胰岛素治疗 是 7(43.75) 23(34.85) 0.440 0.507 否 9(56.25) 43(65.15) 新生儿体质量/g 3 302.35±236.59 3 298.15±241.07 0.063 0.950 产后喂养方式 母乳喂养 4(25.00) 42(63.64) 7.806 0.005 人工喂养 12(75.00) 24(36.36) 空腹血糖/(mmol/L) 6.95±1.03 5.12±0.69 8.581 < 0.001 糖负荷后1 h血糖/(mmol/L) 9.42±2.16 9.26±2.03 0.279 0.781 糖负荷后2 h血糖/(mmol/L) 9.02±2.07 7.12±0.43 6.982 < 0.001 空腹胰岛素/(mmol/L) 15.12±2.35 14.06±2.19 1.713 0.091 总胆固醇/(mmol/L) 5.12±0.53 5.09±0.49 0.216 0.829 低密度脂蛋白胆固醇/(mmol/L) 3.16±0.42 3.10±0.37 0.567 0.572 甘油三酯/(mmol/L) 1.96±0.35 1.95±0.42 0.088 0.930 高密度脂蛋白胆固醇/(mmol/L) 2.05±0.37 2.10±0.39 0.464 0.644 表 2 糖代谢正常组与糖代谢异常组血清GIP、FGF23水平比较(x±s)
组别 n GIP/(pg/mL) FGF23/(ng/L) 糖代谢异常组 16 76.35±21.07** 102.35±26.09** 糖代谢正常组 66 132.54±32.46 45.35±12.17 GIP: 葡萄糖依赖性促胰岛素释放肽;
FGF23: 成纤维细胞生长因子-23。
与糖代谢正常组比较, * * P < 0.01。表 3 GDM患者产后糖代谢异常的危险因素
因素 β SE Wald χ2 OR(95%CI) P 常数项 6.352 2.468 6.624 — 0.012 孕前BMI 1.057 0.342 9.552 2.878(1.472~5.626) < 0.001 GIP -0.421 0.163 6.671 0.656(0.477~0.903) 0.010 FGF23 0.651 0.217 9.000 1.917(1.253~2.933) < 0.001 表 4 GIP、FGF23、孕前BMI预测GDM患者产后糖代谢异常的价值
因素 AUC(95%CI) 临界值 灵敏度/% 特异度/% 约登指数 GIP 0.717(0.607~0.811) 101.35 pg/mL 68.75 72.73 0.414 8 FGF23 0.625(0.511~0.730) 72.94 ng/L 62.50 69.70 0.322 0 孕前BMI 0.699(0.588~0.795) 23.51 kg/m2 75.00 68.18 0.431 8 联合 0.890(0.802~0.949) — 93.75 83.33 0.770 8 -
[1] VOUNZOULAKI E, KHUNTI K, ABNER S C, et al. Progression to type 2 diabetes in women with a known history of gestational diabetes: systematic review and meta-analysis[J]. BMJ, 2020, 369: m1361.
[2] YOU H X, HU J, LIU Y, et al. Risk of type 2 diabetes mellitus after gestational diabetes mellitus: a systematic review & meta-analysis[J]. Indian J Med Res, 2021, 154(1): 62-77. doi: 10.4103/ijmr.IJMR_852_18
[3] NAUCK M A, QUAST D R, WEFERS J, et al. The evolving story of incretins (GIP and GLP-1) in metabolic and cardiovascular disease: a pathophysiological update[J]. Diabetes Obes Metab, 2021, 23(Suppl 3): 5-29.
[4] 韩蓓, 韩俊岭, 曹靖昊, 等. 全段成纤维细胞生长因子23与维持性血液透析患者肾性贫血的相关性研究[J]. 实用临床医药杂志, 2021, 25(21): 114-118. doi: 10.7619/jcmp.20213812 [5] 中华医学会妇产科学分会产科学组, 中华医学会围产医学分会妊娠合并糖尿病协作组. 妊娠合并糖尿病诊治指南(2014)[J]. 中华围产医学杂志, 2014, 17(8): 537-545. https://www.cnki.com.cn/Article/CJFDTOTAL-GWVC202206020.htm [6] Chinese Diabetes Society. 中国2型糖尿病防治指南(2017年版)[J]. 中国实用内科杂志, 2018, 38(4): 292-344. https://www.cnki.com.cn/Article/CJFDTOTAL-HBYX202112018.htm [7] MOON J H, KWAK S H, JANG H C. Prevention of type 2 diabetes mellitus in women with previous gestational diabetes mellitus[J]. Korean J Intern Med, 2017, 32(1): 26-41. doi: 10.3904/kjim.2016.203
[8] KHAN S R, MOHAN H, LIU Y, et al. The discovery of novel predictive biomarkers and early-stage pathophysiology for the transition from gestational diabetes to type 2 diabetes[J]. Diabetologia, 2019, 62(4): 687-703. doi: 10.1007/s00125-018-4800-2
[9] 郭筱楠, 朱惠娟, 龚凤英. 葡萄糖依赖性促胰岛素释放肽-受体信号通路与肥胖症的研究进展[J]. 中华糖尿病杂志, 2021, 13(6): 640-644. [10] MOSAVAT M, OMAR S Z, JAMALPOUR S, et al. Serum glucose-dependent insulinotropic polypeptide (GIP) and glucagon-like peptide-1 (GLP-1) in association with the risk of gestational diabetes: a prospective case-control study[J]. J Diabetes Res, 2020, 2020: 9072492.
[11] HEISE T, MARI A, DEVRIES J H, et al. Effects of subcutaneous tirzepatide versus placebo or semaglutide on pancreatic islet function and insulin sensitivity in adults with type 2 diabetes: a multicentre, randomised, double-blind, parallel-arm, phase 1 clinical trial[J]. Lancet Diabetes Endocrinol, 2022, 10(6): 418-429.
[12] KHAN R, TOMAS A, RUTTER G A. Effects on pancreatic Beta and other Islet cells of the glucose-dependent insulinotropic polypeptide[J]. Peptides, 2020, 125: 170201.
[13] WANG Y, CAI F, LI G, et al. Novel dual glucagon-like peptide-1/glucose-dependent insulinotropic polypeptide receptor agonist attenuates diabetes and myocardial injury through inhibiting hyperglycemia, inflammation and oxidative stress in rodent animals[J]. Bioengineered, 2022, 13(4): 9184-9196.
[14] CORNELISSEN A, FLORESCU R, KNEIZEH K, et al. Fibroblast growth factor 23 and outcome prediction in patients with acute myocardial infarction[J]. J Clin Med, 2022, 11(3): 601.
[15] 杨涵雯, 王耀献, 陈振杰, 等. α-Klotho蛋白、FGF-23与糖尿病肾脏病进展相关性临床研究[J]. 中国中西医结合肾病杂志, 2020, 21(8): 693-696. https://www.cnki.com.cn/Article/CJFDTOTAL-JXSB202008016.htm [16] 潘娟, 王炜城. 老年2型糖尿病患者血清成纤维细胞生长因子23与颈动脉内-中膜厚度的相关性分析[J]. 国际老年医学杂志, 2020, 41(1): 9-12. https://www.cnki.com.cn/Article/CJFDTOTAL-GWLL202001003.htm [17] 赵云, 关雪岩, 肖莹. 妊娠期糖尿病患者血清FGF-23、PGRN水平与糖脂代谢及胰岛素抵抗的关系[J]. 海南医学, 2021, 32(6): 714-717. https://www.cnki.com.cn/Article/CJFDTOTAL-HAIN202106010.htm [18] KHATTAB M, ABI-RASHED C, GHATTAS H, et al. Phosphorus ingestion improves oral glucose tolerance of healthy male subjects: a crossover experiment[J]. Nutr J, 2015, 14: 112.
-
期刊类型引用(4)
1. 赵梓彤,张楠,刘峰舟,王瀚. 极低热量生酮饮食的管理及临床应用. 生理科学进展. 2024(01): 66-72 .  百度学术
百度学术
2. 刘柳,张园园,何珍,吴贝,徐洋,曹蔚. 中链甘油三酯的生酮饮食在化疗3个月以上乳腺癌患者中的随机对照研究. 肿瘤代谢与营养电子杂志. 2024(02): 195-200 .  百度学术
百度学术
3. 苏晓明,钱玉良,严冬. 生酮饮食用于心脏疾病的研究综述. 实用临床医药杂志. 2024(09): 139-143+148 .  本站查看
本站查看
4. 黄璐璐,韦伟,李瑞玲,黄文贞,高敏,杜宇,娄慧慧,季亚洁. 生酮饮食在2型糖尿病合并肥胖患者中的研究进展. 广西医学. 2024(12): 1945-1949 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号