Mechanism of liver-soothing and stomach-harmonizing recipe alleviating airway inflammation in rats with gastroesophageal reflux disease by regulating PPAR-γ/RXR signaling pathway
-
摘要:目的
探讨疏肝和胃方通过调控过氧化物酶体增殖物激活受体γ/类视黄醇X受体(PPAR-γ/RXR)信号通路缓解胃食管反流病(GERD)大鼠气道炎症的机制。
方法采用食管下端盐酸灌注法构建GERD合并气道炎症大鼠模型。将50只SD雄性大鼠随机分为对照组、模型组、疏肝和胃方低剂量组(10.49 g/kg生药量)、疏肝和胃方高剂量组(20.98 g/kg生药量)和奥美拉唑组(3.67 mg/kg), 每组10只, 灌胃14 d。采用苏木精-伊红(HE)染色观察气管组织的病理学变化; 采用RT-qPCR检测支气管肺泡灌洗液中炎症因子[白细胞介素(IL)-17、IL-33、诱导型一氧化氮合酶(iNOS)]以及抗炎因子[IL-10、克拉拉细胞蛋白16(CC16)、表面活性蛋白-D(SP-D)]的mRNA表达水平; 采用免疫印迹法检测PPAR-γ、RXR-α、核因子-κB(NF-κB)、活化蛋白-1(AP-1)的蛋白相对表达量。
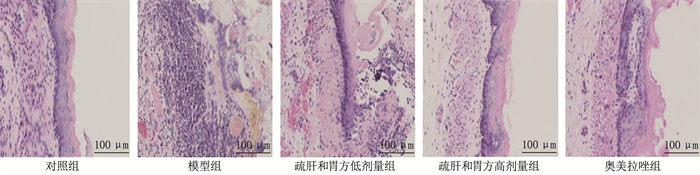
结果HE染色结果显示,模型组可见大量炎症细胞浸润,疏肝和胃方低剂量组、高剂量组和奥美拉唑组炎症细胞浸润明显减少。与对照组比较,模型组支气管肺泡灌洗液中IL-17、IL-33、iNOS的mRNA表达水平升高, IL-10、CC16、SP-D的mRNA表达水平降低, PPAR-γ、RXR-α的蛋白相对表达量升高, NF-κB、AP-1的蛋白相对表达量降低,差异均有统计学意义(P < 0.05)。与模型组比较,疏肝和胃方高剂量组和奥美拉唑组上述指标均有改善,差异有统计学意义(P < 0.05)。
结论疏肝和胃方可以有效缓解GERD大鼠气道炎症,其作用机制可能与激活PPARγ/RXR信号通路有关。
-
关键词:
- 疏肝和胃方 /
- 胃食管反流病 /
- 过氧化物酶体增殖物激活受体 /
- 类视黄醇X受体 /
- 信号通路
Abstract:ObjectiveTo investigate the mechanism of liver-soothing and stomach-harmonizing recipe alleviating airway inflammation in rats with gastroesophageal reflux disease (GERD) by regulating peroxisome proliferator-activated receptor γ/retinoid X receptor (PPAR-γ/RXR) signaling pathway.
MethodsA rat model of GERD with airway inflammation was established by perfusion of hydrochloric acid into the lower esophagus. A total of 50 SD male rats were randomly divided into control group, model group, low-dose liver-soothing and stomach-harmonizing recipe group (10.49 g/kg crude drug dosage), high-dose liver-soothing and stomach-harmonizing recipe group (20.98 g/kg crude drug dosage), and omeprazole group (3.67 mg/kg), with 10 rats in each group. The rats were gavaged for 14 days. Hematoxylin and eosin (HE) staining was used to observe the pathological change in tracheal tissue. RT-qPCR was used to detect the mRNA expression levels of inflammatory cytokines[interleukin (IL)-17, IL-33, inducible nitric oxide synthase (iNOS)]and anti-inflammatory cytokines[IL-10, Clara cell 16-kDa protein (CC16), surfactant protein-D (SP-D)]in bronchoalveolar lavage fluid; the Western blot was used to detect the relative protein expression levels of PPAR-γ, RXR-α, nuclear factor-κB (NF-κB), and activator protein-1 (AP-1).
ResultsThe HE staining results showed that a large number of inflammatory cell infiltrations were observed in the model group, while the inflammatory cell infiltrations were significantly reduced in the low-dose liver-soothing and stomach-harmonizing recipe group, high-dose liver-soothing and stomach-harmonizing recipe group, and omeprazole group. Compared with the control group, the mRNA expression levels of IL-17, IL-33 and iNOS in bronchoalveolar lavage fluid were significantly increased while the mRNA expression levels of IL-10, CC16 and SP-D were significantly decreased in the model group, and the relative protein expression levels of PPAR-γ and RXR-α were significantly increased, while the relative protein expression levels of NF-κB and AP-1 were significantly decreased in the model group (P < 0.05). Compared with the model group, the above indicators were significantly improved in the high-dose liver-soothing and stomach-harmonizing recipe group and omeprazole group (P < 0.05).
ConclusionLiver-soothing and stomach-harmonizing recipe can effectively alleviate airway inflammation in rats with GERD, and its mechanism may be related to the activation of the PPAR-γ/RXR signaling pathway.
-
慢性乙型肝炎(CHB)是临床高发疾病之一,主要是指患者感染乙型肝炎病毒(HBV)后,机体内病毒持续6个月仍未被彻底清除。临床流行病学研究可知,慢性HBV感染率约为10%, 中国现有约2 000万CHB患者。临床CHB患者多会出现乏力、肝区疼痛、腹胀及恶心等明显症状,病情严重者甚至会出现慢性肝病面容、肝功能异常或脾大等病变,严重威胁患者的身心健康与生命安全。绝大多数CHB患者在进展后期可恶化发展成为肝硬化或肝衰竭,甚至引起原发性肝癌等严重性疾病。中华医学会感染病学分会的大样本研究[1]结论显示,体内谷丙转氨酶(ALT)水平过高是导致肝硬化和原发性肝癌发生的危险因素之一,因此有效控制CHB患者病情需在抗病毒治疗的同时予以抑制肝脏炎症等保肝治疗。聚乙二醇干扰素作为临床治疗CHB的特效药之一,其抗病毒疗效有限,应答率为20%~30%[2], 而恩替卡韦作为核苷类抗病毒药物,可通过抑制HBV复制而达到控制CHB病情发展的治疗目的。本研究将恩替卡韦联合聚乙二醇干扰素治疗方案应用于CHB患者,现将相关结果报告如下。
1. 资料与方法
1.1 一般资料
随机选取2012年1月—2018年5月收治的120例慢性乙型肝炎患者作为研究对象,男76例、女44例,平均年龄(30.34±3.16)岁,平均病程(9.28±1.75)年,患者均有不同程度的乏力、失眠、肝区疼痛及黄疸等临床症状。本次研究经医学伦理会同意,所有患者及家属知情了解并签署同意书。按随机数表法将患者分为2组,各60例。对照组中,男37例、女23例,平均年龄(29.84±2.73)岁,平均病程(9.19±1.52)年; 观察组中,男39例、女21例,平均年龄(31.17±3.22)岁,平均病程(9.41±2.03)年。2组患者一般资料组间比较,差异无统计学意义(P>0.05), 具有可比性。纳入标准: 根据《慢性乙型肝炎防治指南(2010年版)》[3]中的诊断标准,诊断为慢性乙型肝炎; 乙型肝炎5项检测结果为乙型肝炎表面抗原(HBsAg)阳性,乙型肝炎E抗原(HBeAg)或乙型肝炎E抗体(HBeAb)阳性,乙型肝炎核心抗体(HBcAb)阳性; 病历资料完整。排除标准: 既往接受过抗病毒治疗或免疫治疗; 合并肝脏肿瘤侵润或其他肝炎病毒感染; 合并代谢性肝病、失代偿性肝硬化或自身免疫性肝病; 对本次研究药物过敏者。
1.2 研究方法
2组患者均接受保肝治疗,在此基础上对照组予以聚乙二醇干扰素治疗,观察组予以恩替卡韦联合聚乙二醇干扰素治疗。2组患者均接受常规西药治疗以保肝降酶。予还原型谷胱甘肽1.80 g, 1次/d, 静脉滴注; 葡醛酸钠3支, 1次/d, 静脉滴注; 维生素C注射液2 g, 1次/d, 静脉滴注; 联苯双脂滴丸15 mg, 3次/d, 口服。连续治疗24周。对照组予以聚乙二醇抗生素(上海罗氏制药公司生产,国药准字J20070055, 0.5 mL: 180 μg)1支, 180μg/次, 1次/周,皮下注射,连续治疗24周。观察组皮下注射聚乙二醇抗生素的同时,予恩替卡韦(中美上海施贵宝制药有限公司生产,国药准字H20080798, 0.50 mg)1片, 0.50 mg/次, 1次/d, 口服,连续治疗24周。
1.3 观察指标
比较2组患者的疗效与治疗期间的ALT复常率、HBeAg转阴率、HBeAb转换率及病毒学突破率,同时观察患者治疗期间的不良反应发生情况,比较2组患者的疗效。①由4名经验丰富的检测人员于治疗前、治疗不同时期(治疗6、12、24周后)对患者进行肝功能检查,检测仪器采用全自动生物化学分析仪, 2组患者均于清晨空腹时进行肘部外周静脉采血5 mL, 采用酶联免疫吸附法检测血清中ALT水平, ALT复常即为血清中ALT水平降到40 IU/L以下; 于治疗前、治疗后不同时期(治疗6、12、24周后)采用电化学发光法全定量检测2组患者HBeAg, 再以半定量检测HBeAb。ALT复常率=ALT复常例数/总例数×100%, HBeAg转阴率=HBeAg转阴例数/总例数×100%, HBeAb转换率=HBeAb转换例数/总例数×100%; 采用聚合酶链反应法检测2组患者HBV DNA水平,病毒学突破即为HBV DNA水平比最低值升高超过1 log10 IU/mL[4], 病毒学突破率=病毒学突破例数/总例数×100%; 于治疗前后检测2组患者外周血Th1/Th2细胞水平因子,包括血清干扰素-γ(INF-γ)、肿瘤坏死因子-α(TNF-α)、白细胞介素-4(IL-4)、白细胞介素-6(IL-6)。②疗效判断[5]: 根据中华医学会全国病毒性肝炎及肝病学术会议内容进行疗效划分。显效,指患者乏力、失眠、肝区疼痛以及黄疸等临床症状均消失, ALT水平恢复正常,血清HBeAg和HBV DNA均转阴性,肝脏肿大情况完全恢复或维持不变; 有效,指患者各临床症状均好转或减轻,血清ALT水平下降至50%或以下, HBeAg与HBV DNA中有1项转阴性,肝脏肿大情况恢复正常或维持不变; 无效,指患者未出现以上任何情况好转。临床治疗总有效率=(显效例数+有效例数)/总例数×100%。
1.4 统计学处理
本研究采用SPSS 19.0统计软件进行数据处理,计数资料以[n(%)]表示,组间比较采用χ2检验,正态分布计量资料用(x±s)表示,组间比较采用t检验,疗效为等级资料,组间比较使用Z检验,以P < 0.05为差异有统计学意义。
2. 结果
2.1 2组患者治疗疗效比较
治疗24周后,观察组临床疗效总有效率显著高于对照组(P < 0.05), 见表 1。
表 1 2组患者治疗疗效比较[n(%)]组别 n 无效 有效 显效 总有效 对照组 60 15(25.00) 27(45.00) 18(30.00) 45(75.00) 观察组 60 6(10.00) 31(51.67) 23(38.33) 54(90.00)* 与对照组比较, *P < 0.05。 2.2 2组患者生化指标血清ALT水平比较
治疗前, 2组ALT水平无显著差异(P>0.05); 治疗6、12、24周后, 2组血清ALT水平均较治疗前显著改善(P < 0.05); 2组间治疗后的血清ALT水平差异无统计学意义(P>0.05)。见表 2。
表 2 2组患者生化指标血清ALT水平比较(x±s)U/L 组别 n 治疗前 治疗6周后 治疗12周后 治疗24周后 对照组 60 199.15±4.96 124.11±7.13* 48.72±3.84* 39.24±4.79* 观察组 60 191.72±7.33 127.32±4.68* 41.66±4.16* 31.4±3.33* ALT: 谷丙转氨酶。与治疗前比较, *P < 0.05。 2.3 2组患者治疗后不同时期ALT复常率、HBeAg转阴率、HBeAb转换率及病毒学突破率比较
治疗6周后, 2组间ALT复常率、HBeAg转阴率、HBeAb转换率及病毒学突破率比较,差异无统计学意义(P>0.05); 治疗12、24周后,观察组ALT复常率、HBeAg转阴率、HBeAb转换率均显著高于对照组(P < 0.05), 病毒学突破率均显著低于对照组(P < 0.05)。见表 3。
表 3 2组患者治疗后ALT复常率、HBeAg转阴率、HBeAb转换率及病毒学突破率比较[n(%)]组别 时点 ALT复常 HBeAg转阴 HBeAb转换 病毒学突破 对照组(n=60) 治疗6周后 16(26.67) 20(33.33) 14(23.33) 2(3.33) 治疗12周后 21(35.00) 26(43.33) 20(33.33) 4(6.67) 治疗24周后 39(65.00) 32(53.33) 36(60.00) 5(8.33) 观察组(n=60) 治疗6周后 18(30.00) 21(35.00) 15(25.00) 1(1.67) 治疗12周后 27(45.00)* 31(51.67)* 29(48.33)* 2(3.33)* 治疗24周后 55(91.67)* 53(88.33)* 41(68.33)* 3(5.00)* ALT: 谷丙转氨酶; HBeAg: 乙型肝炎E抗原; HBeAb: 乙型肝炎E抗体。与对照组比较, *P < 0.05。 2.4 2组患者Th1/Th2型细胞因子水平比较
治疗前, 2组Th1/Th2型细胞因子水平无显著差异(P>0.05); 治疗24周后, 2组Th1/Th2型细胞因子水平均较治疗前显著改善(P < 0.05), 且观察组INF-γ、IL-6均显著优于对照组(P < 0.05); 2组治疗后的TNF-α、IL-4水平无显著差异(P>0.05)。见表 4。
表 4 2组患者Th1/Th2型细胞因子水平比较(x±s)IU/mL 组别 时点 INF-γ TNF-α IL-4 IL-6 对照组(n=60) 治疗前 27.54±3.21 9.48±6.04 20.97±19.34 8.52±5.54 治疗24周后 18.60±1.98 6.75±4.52 31.74±15.90 14.76±6.29 观察组(n=60) 治疗前 27.45±3.17 8.59±5.13 21.63±16.20 7.88±6.45 治疗24周后 15.42±2.16* 5.48±4.56 36.25±13.43 17.92±4.76* INF-γ: 干扰素-γ; TNF-α: 肿瘤坏死因子α; IL-4: 白细胞介素-4; IL-6: 白细胞介素-6。与对照组比较, *P < 0.05。 2.5 2组患者治疗期间的不良反应情况比较
2组患者治疗期间均未发生明显的严重不良反应,观察组仅发生1例(1.67%)发热、2例(3.33%)乏力、1例(1.67%)食欲不振、3例(5.00%)白细胞下降,总不良反应发生率为11.67%; 观察组仅发生2例(3.33%)发热、1例(1.67%)乏力、1例(1.67%)食欲不振、2例(3.33%)白细胞下降,总不良反应发生率为10.00%。2组总不良反应发生率无显著差异(P>0.05), 患者不良反应较轻,经治疗后不影响后续抗病毒治疗。
3. 讨论
临床流行病学研究[6]可见, CHB主要以血液传播、母婴传播作为传播途径,是目前全球性的公共卫生问题之一,严重损害患者的身心健康。携带HBV的患者中有约30%会成为CHB患者,且部分CHB患者甚至病情恶化进展为肝硬化、肝癌等,据全球多项相关研究[7-8]统计可知,每年约35万HBsAg携带者最终发展为肝癌。HBV属于DNA病毒科,其对外界抵抗力较强,能够导致机体出现急性或慢性肝炎,故CHB患者主要表现为HBsAg阳性、HBeAg或HBeAb阳性、HBcAb阳性。目前,临床尚未完全明确HBV引发感染的发病机理,因其抗原特性,患者感染后会引发体内发生免疫介导反应,而HBV持续复制与免疫反应是导致CHB患者肝细胞炎性坏死和肝纤维化进展的主要因素。此外,多位学者[9-10]认为CHB的发病机制与机体细胞免疫应答相关,HBV通过激活机体免疫应答,进而引发肝细胞肿胀、坏死。《慢性乙型肝炎防治指南(2010年版)》[3]指出,针对HBV表面抗原阳性患者需应用药物进行持续抗病毒治疗,并根据患者具体病情决定停药时间。因此, CHB患者的治疗关键在于抗病毒,通过最大程度降低或抑制HBV DNA复制,减轻肝脏损害,一定程度改善CHB患者的生活质量,延长其生存期。
临床上常用干扰素和核苷类似物治疗CHB患者,通过抑制HBV DNA的复制,防治病情恶化,主要有普通干扰素、聚乙二醇干扰素、拉米夫定、恩替卡韦以及替诺福韦酯等抗病毒药物,但干扰素与核苷类似物两者的作用靶点存在不同。聚乙二醇干扰素是一类由聚乙二醇与重组干扰素结合而成的长效干扰素[11], 通过作用于细胞表面的相应特异性受体,相互结合后激活细胞内信号传递通路,并通过该通路激活基因转录与调节等其他生物效用,经过级联反应诱导蛋白酶体中抗病毒蛋白产生,作用于乙肝病毒的核心颗粒,进而有效抑制肝细胞内病毒的复制和增殖,其还可增强辅助T细胞的免疫功能,促使产生的细胞因子抑制感染细胞内HBV的复制和增殖。但国外多项研究[12-13]发现,临床应用聚乙二醇干扰素治疗CHB患者疗效有限,尤其针对肝细胞中整合型的HBV, 难以发挥明显抗病毒药物作用,主要是因为HBV病毒侵入宿主细胞后,可在DNA聚合酶作用下生成完整闭合环状结构的环状DNA分子,而聚乙二醇干扰素仅可抑制机体产生HBV蛋白,无法抑制环状DNA分子生成。本研究联合应用环戊酰鸟嘌呤核苷类似物,即高选择性的恩替卡韦,其具有抗HBV活性高、耐受性好、安全性优等优势,可广泛联合应用于CHB的治疗。Chan等[14]研究表明,恩替卡韦主要是通过作用后磷酸化为高活性的三磷酸盐,从而与HBV多聚酶的天然底物(即三磷酸脱氧鸟嘌呤核苷)进行竞争结合,阻断HBV DNA正链合成,最终可发挥选择性抑制病毒复制的作用。本研究中,治疗24周后,观察组临床疗效总有效率为90.00%, 显著高于对照组75.00%, 这与王洪旗等[15]研究结论相符,提示恩替卡韦联合聚乙二醇干扰素治疗CHB患者疗效显著,可长期抑制HBV复制,有效调控体内细胞免疫应答,协同发挥抗病毒作用,最终有效清除HBV。
机体感染HBV病毒后会对多种抗原产生免疫应答,主要会产生抗HBs、抗HBc及抗HBe抗体,而抗原HBeAg是一种包埋于HBcAg中的可溶性蛋白, HBcAg出现裂解时, HBeAg会即刻释放入血清,尤其在CHB患者乙肝活动期检出率较高。目前临床抗病毒治疗的有效重点[16-17]为HBV DNA转阴、ALT复常、HBeAg转阴以及HBeAb转换。本研究结果显示,治疗12、24周后,观察组ALT复常率、HBeAg转阴率以及HBeAb转换率均显著高于对照组,而病毒学突破率均显著低于对照组,这说明将具高效抗病毒作用的恩替卡韦与兼具免疫调节及抗病毒双重作用的聚乙二醇干扰素联合使用具有协同作用。聚乙二醇干扰素的药代动力学水平稳定,具有较高的HBeAg转化率和表面抗原转阴率,联合恩替卡韦抑制耐药位点,再次发挥对HBV病毒株强力抑制能力,进而协同发挥较高的HBeAg血清转化率作用,且耐药屏障良好。林文等[18]研究显示,血清中ALT水平是用于预测HBeAg血清转换的重要指标之一,在CHB等多种肝脏疾病的疗效评价中具有重要价值,如ALT水平升高则提示患者肝脏功能异常,治疗过程中CHB患者激活机体免疫应答清除HBV,致感染HBV的肝细胞损伤,发生肝损害后会引起ALT水平明显升高。本研究结果显示, 2组治疗6、12、24周后血清ALT水平均较治疗前显著改善,但2组间无显著差异,提示恩替卡韦联合聚乙二醇干扰素治疗可在多环节或多靶位上发挥抗肝损伤作用,进而有效降低ALT水平的表达,降低CHB患者肝损伤指数,联合作用后可在抑制HBV活性的同时稳定患者病情、降低肝硬化或感染等的发生率,与相关研究[19-20]结论相符。
Th1型细胞主要包括INF-γ、TNF-α等细胞因子,其与肝细胞炎症密切相关,而Th2型细胞因子包括IL-4、IL-6, 可减轻机体炎症程度,并促进肝细胞再生,有助于肝损伤修复。本研究结果显示, 2组治疗24周后的Th1/Th2型细胞因子水平均较治疗前显著改善,且观察组INF-γ、IL-6指标均显著优于对照组,这是因为恩替卡韦联合聚乙二醇干扰素治疗可在激活炎症反应的同时,抑制HBV病毒的复制,同时因聚乙二醇干扰素具有改善调节机体免疫状态的作用,可在炎症转归过程中明显抑制INF-γ, 进而促使肝脏细胞合成急性期反应蛋白以加快损伤恢复。本研究中,2组患者均在治疗期间出现白细胞下降情况,及时发现并给予对症治疗后,所有患者白细胞计数保持在聚乙二醇干扰素可用范围。2组总不良反应发生率无显著差异,且患者反应较轻,经治疗后不影响后续抗病毒治疗,提示恩替卡韦联合聚乙二醇干扰素安全性高,可广泛应用于CHB患者的临床治疗中。
综上所述,恩替卡韦联合聚乙二醇干扰素应用于临床治疗CHB患者疗效良好,可抑制HBV复制,有效调控体内细胞免疫应答,协同发挥抗病毒作用,耐受性好,安全性高。
-
表 1 各组大鼠支气管肺泡灌洗液中促炎症介质表达水平比较(x±s)
组别 n IL-17 mRNA IL-33 mRNA iNOS mRNA 对照组 10 0.86±0.03 0.63±0.10 0.98±0.12 模型组 10 2.04±0.32* 0.91±0.05* 2.21±0.30* 疏肝和胃方低剂量组 10 1.88±0.14 0.82±0.13 1.78±0.24# 疏肝和胃方高剂量组 10 0.87±0.09# 0.61±0.02# 1.42±0.11# 奥美拉唑组 10 0.94±0.07# 0.65±0.10# 1.57±0.10# IL-17 : 白细胞介素-17; IL-33 : 白细胞介素-33; iNOS: 诱导型一氧化氮合酶。与对照组比较, * P < 0.05; 与模型组比较, #P < 0.05。 表 2 各组大鼠支气管肺泡灌洗液中抗炎症介质表达水平比较(x±s)
组别 n IL-10 mRNA CC16 mRNA SP-D mRNA 对照组 10 0.94±0.19 1.07±0.16 0.96±0.08 模型组 10 0.38±0.04* 0.44±0.06* 0.43±0.07* 疏肝和胃方低剂量组 10 0.60±0.10# 0.53±0.07 0.46±0.05 疏肝和胃方高剂量组 10 0.79±0.20# 0.87±0.13# 0.82±0.05# 奥美拉唑组 10 0.71±0.23# 0.84±0.10# 0.75±0.09# IL-10 : 白细胞介素-10; CC16 : 克拉拉细胞蛋白16; SP-D: 表面活性蛋白-D。与对照组比较, * P < 0.05; 与模型组比较, #P < 0.05。 表 3 各组大鼠支气管肺泡灌洗液中PPAR-γ、RXR-α、NF-κB、AP-1蛋白相对表达量比较(x±s)
组别 n PPAR-γ RXR-α NF-κB AP-1 对照组 10 0.20±0.02 0.57±0.06 0.38±0.02 0.22±0.03 模型组 10 0.05±0.01* 0.14±0.02* 0.89±0.13* 1.02±0.25* 疏肝和胃方低剂量组 10 0.13±0.01# 0.35±0.07# 0.65±0.06# 0.71±0.12# 疏肝和胃方高剂量组 10 0.20±0.05# 0.60±0.07# 0.53±0.09# 0.43±0.08# 奥美拉唑组 10 0.19±0.06# 0.56±0.10# 0.58±0.05# 0.33±0.06# PPAR-γ: 过氧化物酶体增殖物激活受体γ; RXR-α: 类视黄醇X受体α; NF-κB: 核因子-κB; AP-1: 活化蛋白-1。与对照组比较, * P < 0.05; 与模型组比较, #P < 0.05。 -
[1] MARET-OUDA J, MARKAR S R, LAGERGREN J. Gastroesophageal reflux disease: a review[J]. JAMA, 2020, 324(24): 2536-2547. doi: 10.1001/jama.2020.21360
[2] JOHNSTON N, ONDREY F, ROSEN R, et al. Airway reflux[J]. Ann N Y Acad Sci, 2016, 1381(1): 5-13. doi: 10.1111/nyas.13080
[3] DUNBAR K B, AGOSTON A T, ODZE R D, et al. Association of acute gastroesophageal reflux disease with esophageal histologic changes[J]. JAMA, 2016, 315(19): 2104-2112. doi: 10.1001/jama.2016.5657
[4] NGUYEN P A, ISLAM M, GALVIN C J, et al. Meta-analysis of proton pump inhibitors induced risk of community-acquired pneumonia[J]. Int J Qual Health Care, 2020, 32(5): 292-299. doi: 10.1093/intqhc/mzaa041
[5] EUSEBI L H, RABITTI S, ARTESIANI M L, et al. Proton pump inhibitors: risks of long-term use[J]. J Gastroenterol Hepatol, 2017, 32(7): 1295-1302. doi: 10.1111/jgh.13737
[6] JACKSON M A, GOODRICH J K, MAXAN M E, et al. Proton pump inhibitors alter the composition of the gut microbiota[J]. Gut, 2016, 65(5): 749-756. doi: 10.1136/gutjnl-2015-310861
[7] 孙永顺, 朱生樑, 王宏伟, 等. 疏肝和胃方治疗难治性胃食管反流病的临床观察[J]. 时珍国医国药, 2016, 27(10): 2457-2459. [8] STARK J M, COQUET J M, TIBBITT C A. The role of PPAR-γ in allergic disease[J]. Curr Allergy Asthma Rep, 2021, 21(11): 45. doi: 10.1007/s11882-021-01022-x
[9] 刘春丽, 赖克方, 陈如冲, 等. 盐酸灌注豚鼠食管反流性疾病模型的建立[J]. 中国病理生理杂志, 2006, 22(3): 620-621, 624. doi: 10.3321/j.issn:1000-4718.2006.03.049 [10] FASS R, BOECKXSTAENS G E, EL-SERAG H, et al. Gastro-oesophageal reflux disease[J]. Nat Rev Dis Primers, 2021, 7(1): 55. doi: 10.1038/s41572-021-00287-w
[11] EL-SERAG H B, SWEET S, WINCHESTER C C, et al. Update on the epidemiology of gastro-oesophageal reflux disease: a systematic review[J]. Gut, 2014, 63(6): 871-880. doi: 10.1136/gutjnl-2012-304269
[12] MEHTA R S, NGUYEN L H, MA W J, et al. Association of diet and lifestyle with the risk of gastroesophageal reflux disease symptoms in US women[J]. JAMA Intern Med, 2021, 181(4): 552-554. doi: 10.1001/jamainternmed.2020.7238
[13] LI Z, TAO L, ZHANG S S, et al. Modified Xiaochaihu Decoction for gastroesophageal reflux disease: a randomized double-simulation controlled trial[J]. World J Gastroenterol, 2021, 27(28): 4710-4721. doi: 10.3748/wjg.v27.i28.4710
[14] SONG S Z, ZHANG Y S, ZHANG J W, et al. Efficacy evaluation and exploratory analysis of influencing factors of Banxia Houpu Decoction in the treatment of refractory gastroesophageal reflux disease[J]. Medicine, 2024, 103(24): e38045. doi: 10.1097/MD.0000000000038045
[15] CHENG Y, KOU F S, ZHANG X S, et al. Network pharmacology analysis of hewei jiangni granule for gastroesophageal reflux disease and experimental verification of its anti-neurogenic inflammation mechanism[J]. Drug Des Devel Ther, 2022, 16: 1349-1363. doi: 10.2147/DDDT.S348985
[16] 杜梦蝶, 王玮, 付文尚, 等. 疏肝和胃方通过抑制NF-κB通路调控M1巨噬细胞极化对反流性食管炎大鼠食管黏膜炎症的影响[J]. 上海中医药杂志, 2024, 58(5): 66-72. [17] 张晓轩, 翟超, 李光璨, 等. 子宫内膜容受性与白血病抑制因子的相关性[J]. 国际生殖健康计划生育杂志, 2022, 41(4): 327-331. [18] KURAMOTO K, MORISHIMA Y, YOSHIDA K, et al. Nrf2 deficiency accelerates IL-17-dependent neutrophilic airway inflammation in asthmatic mice[J]. Antioxidants, 2024, 13(7): 818. doi: 10.3390/antiox13070818
[19] MIYAOKA C, WATANABE M, NAKAMOTO K, et al. Association of IL-33 in modeling type-2 airway inflammation and pulmonary emphysema in mice[J]. Immun Inflamm Dis, 2024, 12(4): e1252. doi: 10.1002/iid3.1252
[20] HAN X, CHAI R N, QI F F, et al. Natural helper cells mediate respiratory syncytial virus-induced airway inflammation by producing type 2 cytokines in an IL-33-dependent manner[J]. Immunotherapy, 2017, 9(9): 715-722. doi: 10.2217/imt-2017-0037
[21] NADEEM A, SIDDIQUI N, ALHARBI N O, et al. Acute glutathione depletion leads to enhancement of airway reactivity and inflammation via p38MAPK-iNOS pathway in allergic mice[J]. Int Immunopharmacol, 2014, 22(1): 222-229. doi: 10.1016/j.intimp.2014.06.030
[22] WILSON M S, ELNEKAVE E, MENTINK-KANE M M, et al. IL-13Ralpha2 and IL-10 coordinately suppress airway inflammation, airway-hyperreactivity, and fibrosis in mice[J]. J Clin Invest, 2007, 117(10): 2941-2951. doi: 10.1172/JCI31546
[23] LIU M X, LU J J, ZHANG Q, et al. Clara cell 16 KDa protein mitigates house dust mite-induced airway inflammation and damage via regulating airway epithelial cell apoptosis in a manner dependent on HMGB1-mediated signaling inhibition[J]. Mol Med, 2021, 27(1): 11.
[24] WANG J Y, REID K B M. The immunoregulatory roles of lung surfactant collectins SP-A, and SP-D, in allergen-induced airway inflammation[J]. Immunobiology, 2007, 212(4/5): 417-425.
[25] XU J, ZHU Y T, WANG G Z, et al. The PPARγ agonist, rosiglitazone, attenuates airway inflammation and remodeling via heme oxygenase-1 in murine model of asthma[J]. Acta Pharmacol Sin, 2015, 36(2): 171-178. doi: 10.1038/aps.2014.128
[26] UCHIMURA K, NAKAMUTA M, ENJOJI M, et al. Activation of retinoic X receptor and peroxisome proliferator-activated receptor-gamma inhibits nitric oxide and tumor necrosis factor-alpha production in rat Kupffer cells[J]. Hepatology, 2001, 33(1): 91-99. doi: 10.1053/jhep.2001.21145
[27] HAYDEN M S, GHOSH S. Shared principles in NF-kappaB signaling[J]. Cell, 2008, 132(3): 344-362. doi: 10.1016/j.cell.2008.01.020
[28] KUSIAK A, BRADY G. Bifurcation of signalling in human innate immune pathways to NF-κB and IRF family activation[J]. Biochem Pharmacol, 2022, 205: 115246. doi: 10.1016/j.bcp.2022.115246
[29] MIRZA A Z, ALTHAGAFI I I, SHAMSHAD H. Role of PPAR receptor in different diseases and their ligands: physiological importance and clinical implications[J]. Eur J Med Chem, 2019, 166: 502-513. doi: 10.1016/j.ejmech.2019.01.067
[30] DE SOUZA BASSO B, HAUTE G V, ORTEGA-RIBERA M, et al. Methoxyeugenol deactivates hepatic stellate cells and attenuates liver fibrosis and inflammation through a PPAR-γ and NF-κB mechanism[J]. J Ethnopharmacol, 2021, 280: 114433. doi: 10.1016/j.jep.2021.114433
[31] WANG N P, VERNA L, CHEN N G, et al. Constitutive activation of peroxisome proliferator-activated receptor-gamma suppresses pro-inflammatory adhesion molecules in human vascular endothelial cells[J]. J Biol Chem, 2002, 277(37): 34176-34181. doi: 10.1074/jbc.M203436200
[32] YAN L, ZHANG J D, WANG B, et al. Quercetin inhibits left ventricular hypertrophy in spontaneously hypertensive rats and inhibits angiotensin Ⅱ-induced H9C2 cells hypertrophy by enhancing PPAR-γ expression and suppressing AP-1 activity[J]. PLoS One, 2013, 8(9): e72548. doi: 10.1371/journal.pone.0072548
[33] MENG X, SUN X R, ZHANG Y H, et al. PPARγ agonist PGZ attenuates OVA-induced airway inflammation and airway remodeling via RGS4 signaling in mouse model[J]. Inflammation, 2018, 41(6): 2079-2089. doi: 10.1007/s10753-018-0851-2
[34] TRIFILIEFF A, BENCH A, HANLEY M, et al. PPAR-α and-γ but not-δ agonists inhibit airway inflammation in a murine model of asthma: in vitro evidence for an NF-κB-independent effect[J]. British J Pharmacology, 2003, 139(1): 163-171. doi: 10.1038/sj.bjp.0705232
[35] KOBAYASHI M, THOMASSEN M J, RAMBASEK T, et al. An inverse relationship between peroxisome proliferator-activated receptor gamma and allergic airway inflammation in an allergen challenge model[J]. Ann Allergy Asthma Immunol, 2005, 95(5): 468-473. doi: 10.1016/S1081-1206(10)61173-8
-
期刊类型引用(8)
1. 田美莉. 氨甲环酸联合葡萄糖酸钙治疗产后出血的临床效果. 妇儿健康导刊. 2024(04): 90-92 .  百度学术
百度学术
2. 李相茹. 氨甲环酸联合麦角新碱预防剖宫产产后出血的效果. 中国民康医学. 2024(07): 71-74 .  百度学术
百度学术
3. 郭丽平,陈秋连,陈琳. 氨甲环酸联合缩宫素预防瘢痕子宫再次分娩后恶露不尽的效果及对凝血功能的影响. 中国医学创新. 2024(17): 145-148 .  百度学术
百度学术
4. 刘伟,曹玉枝,田润芝,曹晨,李桂青. 悬浮红细胞与新鲜冰冻血浆不同比例输注联合氨甲环酸治疗产后出血的效果对比. 中国妇幼保健. 2024(16): 3034-3037 .  百度学术
百度学术
5. 王晨. 氨甲环酸联合麦角新碱对产后出血产妇的治疗效果. 实用中西医结合临床. 2024(12): 35-37+128 .  百度学术
百度学术
6. 张美琳,于楠楠. 麦角新碱联合氨甲环酸治疗产后宫缩乏力性出血的临床效果以及对子宫复旧、凝血功能的影响. 中国当代医药. 2024(33): 88-91 .  百度学术
百度学术
7. 符海萍. 氨甲环酸联合缩宫素对预防剖宫产产后出血的效果及改善凝血功能的临床研究. 现代医学与健康研究电子杂志. 2023(17): 56-58 .  百度学术
百度学术
8. 彭玲玲,郝然,吴俞萱,李娟,谌艳. 局部应用氨甲环酸联合磺胺嘧啶银脂质水胶敷料对骨科大手术后切口渗血的影响. 中国当代医药. 2023(36): 46-50 .  百度学术
百度学术
其他类型引用(1)




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号
