Effectiveness and external validation of a prognostic prediction model for diffuse large B-cell lymphoma
-
摘要:目的
分析影响弥漫性大B细胞淋巴瘤(DLBCL)患者预后的相关因素, 并建立列线图预测DLBCL患者的预后。
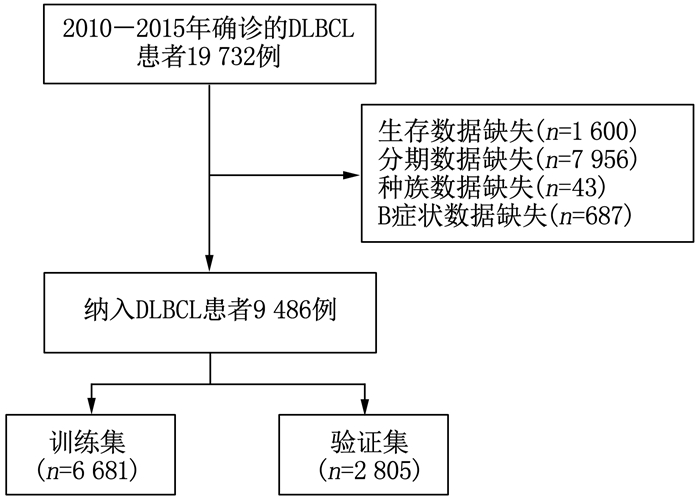
方法利用美国国家癌症研究所监测、流行病学和最终结果数据库(SEER数据库)提取9 486例DLBCL患者的基线资料, 将SEER数据按照7:3比例随机分为SEER训练集6 681例和SEER验证集2 805例。采用单因素、多因素Cox回归分析确定影响DLBCL患者预后的危险因素, 并在此基础上建立列线图; 采用一致性指数(C-index)、受试者工作特征(ROC)曲线的曲线下面积(AUC)以及校准曲线评价模型的区分度及其预测效能。选取2013年1月-2017年12月本院血液内科及肿瘤科的120例DLBCL患者作为外部验证集, 对列线图进行外部验证并分析其影响因素。
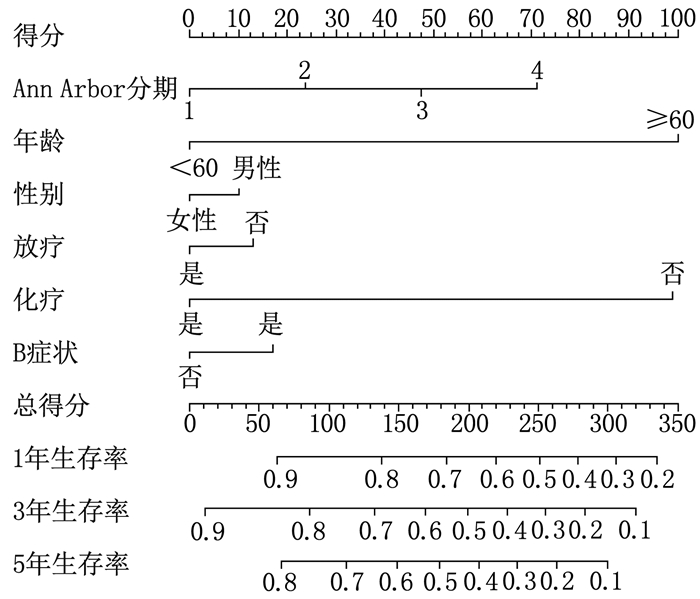
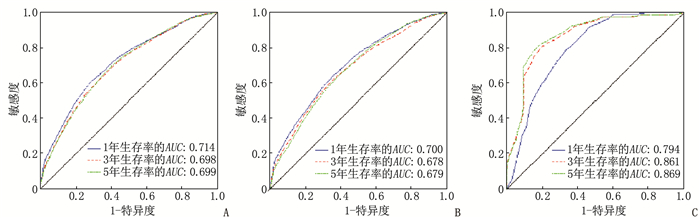
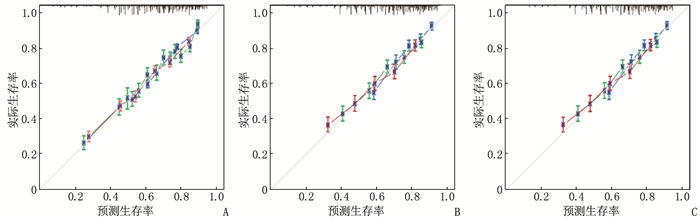
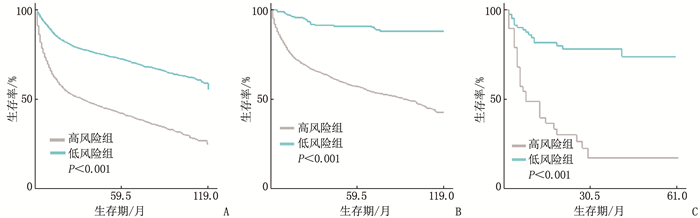
结果多因素Cox回归分析结果显示, 年龄≥ 60岁、男性、Ann Arbor分期高、有B症状、未接受放疗、未接受化疗是影响DLBCL预后的危险因素(P < 0.05), 同时将上述因素纳入列线图模型。SEER训练集、验证集以及外部验证集的C-index分别为0.681、0.669、0.817, SEER训练集、验证集以及外部验证集ROC曲线预测DLBCL患者5年生存率的AUC分别为0.699、0.678、0.869。校准曲线显示列线图预测模型结果与实际结果具有良好的一致性。计算患者的风险评分并将其分为低风险组(< 170分)和高风险组(≥ 170分), 低风险组的5年生存率在SEER训练集、SEER验证集以及外部验证集中均为最高。
结论男性、年龄≥ 60岁、Ann Arbor分期高、未接受放疗、未接受化疗、存在B症状是影响DLBCL患者预后的独立危险因素。基于上述因素建立的列线图预测模型具有良好的预测效能, 可对DLBCL患者预后进行个体化风险评估和预测。
-
关键词:
- 弥漫性大B细胞淋巴瘤 /
- 校准曲线 /
- 美国国家癌症研究所监测、流行病学和最终结果数据库 /
- 列线图 /
- 放疗 /
- 化疗
Abstract:ObjectiveTo analyze the related factors affecting the prognosis of patients with diffuse large B-cell lymphoma (DLBCL), and to establish a Nomogram for prediction of the prognosis of patients with DLBCL.
MethodsThe baseline data of 9 486 patients with DLBCL were extracted from the Surveillance, Epidemiology, and End Results (SEER) Program of the National Cancer Institute, and the SEER data were randomly divided into SEER training set (n=6 681) and SEER validation set (n=2 805) according to the ratio of 7 to 3. Univariate and multivariate Cox regression analyses were used to determine the risk factors affecting the prognosis of patients with DLBCL, and on this basis, a Nomogram was established; the discrimination and prediction efficiency of the model were evaluated by consistency index (C-index), area under the curve (AUC) of receiver operating characteristic (ROC) curve and calibration curve. A total of 120 patients with DLBCL in the Department of Hematology and Department of Oncology in authors' hospital from January 2013 to December 2017 were selected as external validation set, and the external validation was performed to verify the Nomogram and analyze its influencing factors.
ResultsMultivariate Cox regression analysis showed that age ≥ 60 years old, male, high stages of Ann Arbor staging, presence of B symptoms, lack of radiotherapy and lack of chemotherapy were the risk factors affecting the prognosis of DLBCL (P < 0.05), and the above factors were included in the Nomogram model. The C-index values of SEER training set, validation set and external validation set were 0.681, 0.669 and 0.817 respectively, and the AUC values of ROC curves of SEER training set, validation set and external validation set for predicting 5-year survival rate of DLBCL patients were 0.699, 0.678 and 0.869 respectively. The calibration curve showed that the result of the Nomogram prediction model was in good consistency with the actual result. Patients were divided into low-risk group (< 170 points) and high-risk group (≥ 170 points) according to the calculated risk scores, and the 5-year survival rate of the low-risk group was the highest in the SEER training set, validation set and external validation set.
ConclusionMale, age ≥ 60 years old, high stages of Ann Arbor staging, lack of radiotherapy, lack of chemotherapy and presence of B symptoms are the independent risk factors affecting the prognosis of patients with DLBCL. The Nomogram prediction model established based on the above factors has good predictive performance, and can be used for personalized risk assessment and prediction of the prognosis of patients with DLBCL.
-
终末期肾病(ESRD)是全球范围内日益严重的公共健康问题之一,血液透析是其主要替代治疗方式[1]。随着血液净化技术的提升,维持性血液透析(MHD)患者的寿命已明显延长,然而MHD所致慢性并发症仍会显著降低患者的生存质量[2]。肌少症是尿毒症患者的常见合并症,主要表现为骨骼肌质量、力量和功能的进行性下降[3]。目前,尿毒症肌少症尚无统一诊断标准,不同检测方法、目标人群和诊断标准下的研究结果差异较大[4]。随着透析时间的延长、尿毒症毒素的累积及相关并发症的发生, MHD患者骨骼肌肌量减少及功能下降会加速,容易引发肌少症,并导致身体功能障碍、生活质量下降和死亡风险增加[5]。相关研究[6]证实,与无肌少症的MHD患者相比,患有肌少症的MHD患者表现出更高的死亡风险和住院率。本研究调查MHD患者肌少症发生现状,并观察个体化营养干预对患者肌少症及生存质量的影响,旨在为临床防治肌少症和提高MHD患者生存质量提供参考依据。
1. 对象与方法
1.1 研究对象
选取2022年1—12月在南京市高淳人民医院血透中心行规律血液透析治疗的102例患者作为研究对象。纳入标准: ①年龄18~80岁者; ②血液透析治疗时间≥6个月(3次/周, 4 h/次),抗凝剂为低分子肝素,血管通路为动静脉内瘘或长期导管者; ③具有一定理解能力并能较好地配合治疗者; ④对本研究知情并签署知情同意书者。排除标准: ①近1个月发生急性感染、腹泻、心血管意外或手术等事件者; ②伴自身免疫病或使用激素治疗者; ③伴消化性溃疡、严重肝病或恶性肿瘤等疾病者; ④不能配合营养干预者。本研究经南京市高淳人民医院伦理委员会审核批准后实施。
1.2 研究方法
1.2.1 一般资料收集
记录患者的年龄、性别、原发病、透析龄等资料,嘱患者透析结束后10~20 min测量净身高、体质量,计算体质量指数(BMI), BMI=体质量(kg)/身高(m)2。
1.2.2 实验室检查
抽取患者透析当日上机前静脉血,送检验科检测血清白蛋白(Alb)、血红蛋白(Hb)、血尿素氮(BUN)、血肌酐(Scr)、血钙、血磷、甲状旁腺激素(iPTH)、超敏C反应蛋白(hs-CRP)等指标水平,并计算尿素清除指数(Kt/V)。
1.2.3 骨骼肌质量测量
以骨骼肌质量指数(SMI)表示骨骼肌质量,于患者透析结束后使用人体成分分析仪进行分析,采用生物电阻抗法测量骨骼肌肌肉质量[7]。
SMI=骨骼肌肌肉质量(kg)/身高(m)2。
1.2.4 肌肉力量评估
通过手握力评估肌肉力量,握力测量使用香山家用电子握力器(型号EH101)。嘱患者取坐姿,手肘弯曲90°, 用非造瘘手使劲握住握力器,重复测量3次,每次测量间隔60 s以上,取最大值。
1.2.5 肌肉功能评估
通过日常步速评估肌肉功能,可使用辅助工具协助完成。患者以日常步速在6 m直线上行走,每人走2次,以用时较少的一次计算步速。
1.2.6 肌少症诊断
采用亚洲肌少症工作组(AWGS)的肌少症诊断标准,满足下列第l项和后2项中的1项即诊断为肌少症[8]。①生物电阻抗分析显示SMI < 7.0 kg/m2(男性)或 < 5.7 kg/m2(女性); ②手握力 < 26 kg (男性)或 < 18 kg (女性); ③日常步速 < 0.8 m/s。
1.2.7 生存质量评估
采用SF-36量表评估患者的生存质量。SF-36量表涵盖生理健康、心理健康2个领域共8个维度,生理健康领域包括生理机能、生理职能、躯体疼痛和一般健康状况这4种维度,心理健康领域包括精神健康、情感职能、社会功能和精力这4种维度。计算各维度得分和总分,最高100分,评分越高表示生存质量越好[9]。
1.2.8 营养干预
在常规基础医学治疗的基础上,对患者进行个体化营养干预。首先评估患者的营养状况,再结合患者的饮食习惯、劳动强度、血生化指标结果等制订个体化食谱,食谱中包含食物的种类、数量、交换份额等[10]。干预期间每半个月随访1次,落实患者执行情况。遵循原则: ①蛋白质摄入量以1.2~1.5 g/(kg·d)为宜,建议50%以上为优质蛋白(鱼肉、瘦肉、虾、鸡蛋等),若患者不能接受高蛋白饮食,可予等量蛋白粉替代; ②摄入热量一般为30 kcal/(kg·d), 老年人和体力劳动明显减少者则以25 kcal/(kg·d) 为宜,热量主要来源为主食和脂肪; ③电解质摄入量根据有无水肿及高血压调整,盐摄入量以3~5 g/d为宜,限制含钾、含磷食物摄入; ④水分摄入量以透析间期体质量增加 < 5%为宜; ⑤膳食纤维摄入量以20 g/d为宜。
1.3 统计学分析
采用SPSS 23.0软件对本研究数据进行统计学分析。正态分布的计量资料以(x±s)表示, 2组间比较采用独立样本t检验,治疗前后比较采用配对样本t检验; 非正态分布的计量资料以[M(P25, P75)]表示, 2组间比较采用非参数检验,治疗前后比较采用配对秩和检验; 计数资料以[n(%)]表示,比较采用χ2检验。P < 0.05为差异有统计学意义。
2. 结果
2.1 临床资料比较
本研究共纳入102例MHD患者,肌少症发生率为27.45%(28/102)。根据有无肌少症,将患者分为肌少症组28例和无肌少症组74例。2组患者年龄、性别、BMI、Alb、hs-CRP、BUN、Scr比较,差异有统计学意义(P < 0.05); 2组患者透析龄、原发病、Hb、血钙、血磷、iPTH、Kt/V比较,差异无统计学意义(P>0.05), 见表 1。
表 1 2组患者临床资料比较(x±s)[n(%)][M(P25, P75)]指标 分类 无肌少症组(n=74) 肌少症组(n=28) χ2/t/Z P 年龄/岁 50.39±11.16 63.00±13.79 -4.764 < 0.001 透析龄/年 7.55±4.18 8.74±4.96 -1.210 0.229 性别 男 31(41.89) 18(64.29) 4.081 0.043 女 43(58.11) 10(35.71) 原发病 慢性肾炎 48(64.86) 15(53.57) 1.097 0.295 糖尿病肾病 9(12.16) 5(17.85) 0.556 0.456 高血压肾病 6(8.11) 4(14.29) 0.877 0.349 其他 11(14.87) 4(14.29) 0.005 0.941 BMI/(kg/m2) 20.37±2.46 17.11±2.55 5.908 < 0.001 实验室指标 Kt/V 1.40±0.20 1.42±0.28 -0.507 0.613 Hb/(g/L) 99.96±19.37 95.25±21.29 1.066 0.289 Alb/(g/L) 41.34±2.61 39.16±3.73 3.326 0.001 血钙/(mmol/L) 2.32±0.22 2.28±0.25 0.750 0.455 血磷/(mmol/L) 1.90±0.53 1.75±0.38 1.355 0.179 iPTH/(pg/mL) 293.35(121.37, 547.22) 202.75(139.87, 357.17) 0.922 0.356 hs-CRP/(mg/L) 2.21(0.85, 4.04) 3.25(1.24, 6.53) -2.002 0.045 BUN/(mmol/L) 26.73±5.89 23.92±6.16 2.125 0.036 Scr/(μmol/L) 1 081.40±259.34 901.78±222.31 3.240 0.002 BMI: 体质量指数; Kt/V: 尿素清除指数; Hb: 血红蛋白; Alb: 白蛋白; iPTH: 甲状旁腺激素; hs-CRP: 超敏C反应蛋白; BUN: 血尿素氮; Scr: 血肌酐。 2.2 生存质量比较
治疗前,肌少症组患者的生理机能、躯体疼痛、一般健康状况维度评分和生理健康领域总分、SF-36量表总分均低于无肌少症组,差异有统计学意义(P < 0.05), 见表 2。
表 2 2组患者治疗前生存质量评分比较(x±s)[M(P25, P75)]分 项目 无肌少症组(n=74) 肌少症组(n=28) t/Z P 生理机能维度评分 88.04±9.50 75.54±19.55 4.334 < 0.001 生理职能维度评分 75(50, 75) 50(25, 75) 1.898 0.061 躯体疼痛维度评分 83.98±20.88 72.14±27.75 2.327 0.022 一般健康状况维度评分 53.98±19.27 41.43±17.84 2.996 0.003 精神健康维度评分 68.32±15.83 64.29±15.00 1.166 0.246 情感职能维度评分 67(67, 100) 67(67, 100) 0.079 0.937 社会功能维度评分 66.74±18.81 61.64±23.11 1.146 0.255 精力维度评分 64.39±16.36 57.86±19.31 1.711 0.090 生理健康领域总分 72.97±15.22 61.12±18.33 3.315 0.001 心理健康领域总分 69.04±14.43 65.02±17.40 1.185 0.239 SF-36量表总分 71.01±13.99 62.33±18.18 2.566 0.012 2.3 肌少症相关指标比较
治疗过程中患者因住院或依从性差等脱失11例(肌少症组6例、无肌少症组5例),最终共91例患者按要求完成3个月营养干预治疗,其中肌少症组22例,无肌少症组69例。治疗后, 2组患者骨骼肌质量指数、握力均大于治疗前,且肌少症组骨骼肌质量指数、握力的治疗前后差值大于非肌少症组,差异有统计学意义(P < 0.05); 2组患者治疗前后日常步速差异无统计学意义(P>0.05), 见表 3。
表 3 2组患者治疗前后肌少症相关指标比较(x±s)[M(P25, P75)]指标 时点 无肌少症组(n=69) 肌少症组(n=22) 骨骼肌质量指数/(kg/m2) 治疗前 7.95±1.02 5.78±0.50 治疗后 8.18±1.01* 6.15±0.51* 治疗前后差值 0.20(0.02, 0.42) 0.39(0.19, 0.50)# 握力/kg 治疗前 25.01±5.25 18.68±3.84 治疗后 25.60±5.37* 19.84±3.83* 治疗前后差值 0.47(0.01, 1.56) 1.25(0.42, 1.57)# 日常步速/(m/s) 治疗前 1.02±0.17 0.77±0.17 治疗后 1.03±0.18 0.78±0.17 治疗前后差值 0.01(0, 0.02) 0.01(0, 0.03) 与治疗前比较, * P < 0.05; 与无肌少症组比较, #P < 0.05。 2.4 治疗前后生存质量比较
接受个体化营养干预治疗后, MHD患者的生理职能、一般健康状况、精力维度评分和生理健康领域总分、SF-36量表总分均高于治疗前,差异有统计学意义(P < 0.05), 见表 4。
表 4 91例MHD患者治疗前后生存质量评分比较(x±s)分 项目 治疗前 治疗后 t P 生理机能维度评分 85.27±13.55 86.10±11.10 -1.267 0.208 生理职能维度评分 64.83±23.86 67.86±23.06 -3.317 0.001 躯体疼痛维度评分 82.10±22.20 83.12±17.84 -1.048 0.297 一般健康状况维度评分 51.21±18.95 53.02±16.63 -2.744 0.007 精神健康维度评分 67.82±15.49 68.26±13.30 -0.566 0.573 情感职能维度评分 77.76±22.81 77.79±21.09 -0.576 0.565 社会功能维度评分 66.20±19.30 66.77±17.10 -0.809 0.421 精力维度评分 63.46±16.74 65.11±15.37 -2.058 0.042 生理健康领域总分 70.85±16.18 72.52±13.39 -3.185 0.002 心理健康领域总分 68.81±14.73 69.48±12.52 -1.216 0.227 SF-36量表总分 69.75±14.69 70.75±12.29 -2.226 0.028 3. 讨论
“肌肉减少症”概念最初由ROSENBERG I H[11]提出,是一种随年龄增长出现的以骨骼肌质量减少、肌力下降、功能减退为特征的退行性病变。慢性肾脏病(CKD)患者的肌少症发病率高于普通人群,且随着CKD的进展而增高,尤其值得注意的是,肌少症可极大增加ESRD患者的死亡风险和医疗费用[12-13]。目前,人们对于MHD患者肌少症的认识尚不全面,早期识别并干预对改善患者生存质量和延长生存期具有重要意义。
本研究中, MHD患者肌少症发病率为27.45%(28/102), 且女性发病率(18.87%)低于男性(36.73%), 与既往研究[14]结论相似。本研究发现, 2组患者在年龄、性别、BMI、Alb、hs-CRP、BUN、Scr方面比较,差异有统计学意义(P < 0.05)。BMI、蛋白质、透析前尿素、透析前肌酐水平均能反映MHD患者的营养状况,其中蛋白质合成与降解平衡是维持骨骼肌质量的主要因素[15], 肌肉蛋白丢失将直接导致肌肉质量下降及营养缺失,更容易引发肌少症。MHD患者肌少症发病的性别差异考虑与性激素有关,女性MHD患者常存在雌二醇下降及月经稀少,雌激素可通过核受体及G蛋白偶联雌激素受体提高肌力,但并无证据显示其可对骨骼肌量产生影响。相对而言,男性MHD患者普遍伴有睾酮减少,睾酮参与肌肉蛋白质的合成,其缺乏可促进男性骨骼肌质量下降。此外,男性患者可能比女性患者更易发生炎症性肠功能障碍,引起食欲减退,从而导致肌少症发病率增加[16]。动物实验[17]亦显示,肾切除的雄性大鼠会出现贫血和营养不良,但配对的雌性大鼠没有明显变化。微炎症状态在MHD患者中较为常见,既往研究[18]显示高水平肿瘤坏死因子、C反应蛋白可使肌肉蛋白质降解增加和合成减少,从而显著增加肌肉量和肌肉强度丢失的风险。
本研究显示,治疗前,肌少症组患者的生理机能、躯体疼痛、一般健康状况维度评分和生理健康领域总分、SF-36量表总分均显著低于无肌少症组,提示肌少症严重影响MHD患者的生活质量,尤其是身体健康和生理功能方面。分析原因,肌少症可造成患者乏力、易疲劳、肌肉力量下降,甚至出现身体平衡障碍、容易跌倒、骨折、身体残疾等[19-20]。
流行病学研究[21]表明,相当多的因素可能导致MHD患者肌少症发病率增加,包括蛋白质摄入不足、能量缺乏、衰老、运动不足、慢性炎症、激素失衡、尿毒症毒素积聚等。蛋白质摄入和能量水平在CKD患者的饮食治疗中起着关键作用。近期研究[22]发现,对于尿毒症肌少症的治疗,患者更倾向于采取饮食干预措施。目前, MHD患者肌少症的饮食疗法尚未完善,严格遵守任何共性的营养指导均不恰当,临床医师应结合患者个体的疾病活动性、营养风险和依从性等因素综合考虑干预方案。
本研究中,个体化营养干预治疗3个月后, 2组患者SMI、握力均改善,且肌少症组治疗前后差值大于非肌少症组,差异有统计学意义(P < 0.05), 表明营养支持不仅能增加MHD患者的肌肉质量,还能改善患者的肌力,且肌少症组改善更明显,与JU S H等[23]研究结论类似。2组患者治疗前后日常步速差异无统计学意义(P>0.05), 考虑与MHD患者普遍存在活动能力和活动意愿下降有关,联合运动干预或可改善患者的肌肉功能。本研究还发现,治疗后, MHD患者的生理职能、一般健康状况、精力维度评分和生理健康领域总分、SF-36量表总分均高于治疗前,差异有统计学意义(P < 0.05), 表明营养干预可显著提升MHD患者的生存质量。
综上所述, MHD患者的肌少症发病率较高,与年龄、性别、营养状态、微炎症有关,严重影响患者的生存质量。个体化营养干预治疗可减轻MHD患者的肌少症症状,并提高患者的生存质量,建议在临床推广应用。本研究尚存在不足之处,例如入组患者有限,干预时间较短,未同时设立非干预对照组,未来应开展大样本量研究进行长期营养介入和随访进一步验证。
-
表 1 SEER训练集DLBCL患者预后的Cox回归分析
因素 单因素分析 多因素分析 HR(95%CI) P HR(95%CI) P 年龄 < 0.001 < 0.001 < 60岁 1 1 ≥60岁 2.789(2.536~3.066) < 0.001 2.720(2.473~2.992) < 0.001 性别 < 0.001 < 0.001 女 1 1 男 1.259(1.169~1.356) < 0.001 1.336(1.240~1.440) < 0.001 Ann Arbor分期 < 0.001 < 0.001 Ⅰ期 1 1 Ⅱ期 1.107(0.985~1.245) 0.089 1.272(1.129~1.433) < 0.001 Ⅲ期 1.586(1.418~1.775) < 0.001 1.777(1.578~2.000) < 0.001 Ⅳ期 1.850(1.676~2.043) < 0.001 2.036(1.835~2.259) < 0.001 放疗 < 0.001 0.028 是 1 1 否 1.451(1.324~1.590) < 0.001 1.113(1.012~1.223) 0.028 化疗 < 0.001 < 0.001 是 1 1 否 2.519(2.308~2.748) < 0.001 2.677(2.446~2.929) < 0.001 B症状 < 0.001 < 0.001 无 1 1 有 1.182(1.093~1.279) < 0.001 1.171(1.080~1.270) < 0.001 表 2 外部验证集DLBCL患者预后的Cox回归分析
因素 单因素分析 多因素分析 HR(95%CI) P HR(95%CI) P 年龄 0.141 < 60岁 1 — — ≥60岁 1.777(0.827~3.817) 0.141 — — 性别 0.962 女 1 — — 男 1.015(0.561~1.834) 0.962 — — Ann Arbor分期 < 0.001 < 0.001 Ⅰ期 1 1 Ⅱ期 3.03(1.036~8.869) 0.043 2.578(0.876~7.585) 0.085 Ⅲ期 3.806(1.321~10.964) 0.013 3.627(1.259~10.450) 0.017 Ⅳ期 8.285(3.079~22.290) < 0.001 7.216(2.678~19.442) < 0.001 放疗 0.101 是 1 — — 否 2.055(0.869~4.863) 0.101 — — 化疗 < 0.001 < 0.001 是 1 1 否 4.221(2.328~7.653) < 0.001 3.784(2.085~6.868) < 0.001 B症状 0.887 无 1 — — 有 0.940(0.398~2.220) 0.887 — — -
[1] SUKSWAI N, LYAPICHEV K, KHOURY J D, et al. Diffuse large B-cell lymphoma variants: an update[J]. Pathology, 2020, 52(1): 53-67. doi: 10.1016/j.pathol.2019.08.013
[2] LIU Y, BARTA S K. Diffuse large B-cell lymphoma: 2019 update on diagnosis, risk stratification, and treatment[J]. Am J Hematol, 2019, 94(5): 604-616. doi: 10.1002/ajh.25460
[3] TWA D D W, MOTTOK A, SAVAGE K J, et al. The pathobiology of primary testicular diffuse large B-cell lymphoma: implications for novel therapies[J]. Blood Rev, 2018, 32(3): 249-255. doi: 10.1016/j.blre.2017.12.001
[4] International non-Hodgkin's lymphoma prognostic factors project. A predictive model for aggressive non-Hodgkin's lymphoma[J]. N Engl J Med, 1993, 329(14): 987-994. doi: 10.1056/NEJM199309303291402
[5] PAN Y X, CHEN J C, FANG A P, et al. A nomogram predicting the recurrence of hepatocellular carcinoma in patients after laparoscopic hepatectomy[J]. Cancer Commun, 2019, 39(1): 55.
[6] RUPPERT A S, DIXON J G, SALLES G, et al. International prognostic indices in diffuse large B-cell lymphoma: a comparison of IPI, R-IPI, and NCCN-IPI[J]. Blood, 2020, 135(23): 2041-2048. doi: 10.1182/blood.2019002729
[7] CHIAPPELLA A, CASTELLINO A, NICOLOSI M, et al. Diffuse Large B-cell Lymphoma in the elderly: standard treatment and new perspectives[J]. Expert Rev Hematol, 2017, 10(4): 289-297. doi: 10.1080/17474086.2017.1305264
[8] SHAH B K, BISTA A, SHAFII B. Disparities in receipt of radiotherapy and survival by age, sex and ethnicity among patients with stage Ⅰ diffuse large B-cell lymphoma[J]. Leuk Lymphoma, 2015, 56(4): 983-986. doi: 10.3109/10428194.2014.940583
[9] 赵志强, 魏俏俏, 范双龙, 等. 老年弥漫大B细胞淋巴瘤患者预后影响因素分析[J]. 肿瘤研究与临床, 2022, 34(2): 128-131. https://cdmd.cnki.com.cn/Article/CDMD-11810-1022744987.htm [10] 翟淑丹, 朱磊, 张利卜, 等. 18F-FDG PET/CT对弥漫大B细胞淋巴瘤预后的预测价值[J]. 癌症, 2021, 40(9): 404-411. https://www.cnki.com.cn/Article/CJFDTOTAL-AIZH202112005.htm [11] 谭晓虹, 孙洁, 冯荣浩, 等. 153例弥漫性大B细胞淋巴瘤的临床病理特征及预后相关因素分析[J]. 肿瘤预防与治疗, 2020, 33(8): 645-650. https://www.cnki.com.cn/Article/CJFDTOTAL-SCZF202008003.htm [12] 田晨, 任洪涛, 姜成毅, 等. 初治弥漫大B细胞淋巴瘤患者临床、基因特征及预后的影响因素[J]. 中国老年学杂志, 2020, 40(22): 4736-4740. https://www.cnki.com.cn/Article/CJFDTOTAL-ZLXZ202022012.htm [13] HAN Y, QIN Y, HE X H, et al. Retrospective analysis of the clinical features and prognostic factors of 370 patients with advanced-stage diffuse large B-cell lymphoma[J]. Chin J Oncol, 2018, 40(6): 456-461.
[14] LIU P P, WANG K F, JIN J T, et al. Role of radiation therapy in primary breast diffuse large B-cell lymphoma in the Rituximab era: a SEER database analysis[J]. Cancer Med, 2018, 7(5): 1845-1851. doi: 10.1002/cam4.1457
[15] WU J Q, SONG Y P, SU L P, et al. Rituximab plus chemotherapy as first-line treatment in Chinese patients with diffuse large B-cell lymphoma in routine practice: a prospective, multicentre, non-interventional study[J]. BMC Cancer, 2016, 16: 537. doi: 10.1186/s12885-016-2523-7
[16] LIN J Y, ZHENG Y B, HE H M, et al. Clinicopathological Features and Prognostic Factors of DLBCL[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2018, 26(3): 779-783.
[17] 陈雅姝, 刘敏, 王俊. 利妥昔单抗治疗弥漫大B细胞淋巴瘤的疗效及影响患者预后多因素分析[J]. 实用癌症杂志, 2020, 35(6): 1031-1034. https://www.cnki.com.cn/Article/CJFDTOTAL-SYAZ202006043.htm [18] 汪玉芳, 柯金勇, 柯善栋. 原发性胃弥漫大B细胞淋巴瘤患者的生存情况及其影响因素分析[J]. 癌症进展, 2018, 16(8): 1020-1023. https://www.cnki.com.cn/Article/CJFDTOTAL-AZJZ201808027.htm [19] ZUO Z C, ZHANG G C, SONG P, et al. Survival nomogram for stage IB non-small-cell lung cancer patients, based on the SEER database and an external validation cohort[J]. Ann Surg Oncol, 2021, 28(7): 3941-3950.
[20] HAN Y, YANG J L, LIU P, et al. Prognostic nomogram for overall survival in patients with diffuse large B-cell lymphoma[J]. Oncologist, 2019, 24(11): e1251-e1261.
[21] WANG J, ZHOU M, ZHOU R F, et al. Nomogram for predicting the overall survival of adult patients with primary gastrointestinal diffuse large B cell lymphoma: a SEER-based study[J]. Front Oncol, 2020, 10: 1093.
[22] RAMSPEK C L, JAGER K J, DEKKER F W, et al. External validation of prognostic models: what, why, how, when and where[J]. Clin Kidney J, 2021, 14(1): 49-58.
-
期刊类型引用(5)
1. 王一君. 健脾止动汤联合阿立哌唑改善小儿多发性抽动症患儿肌肉功能及行为异常的效果研究. 实用临床医药杂志. 2024(08): 104-108 .  本站查看
本站查看
2. 游睿,曹正江,汤曦,周莉. 维持性血液透析合并肌少症患者临床治疗及营养干预现状. 中国医药. 2024(07): 1113-1116 .  百度学术
百度学术
3. 汪秦,张祥,陶明芬,刘欢. 维持性血液透析患者并发肌少症的影响因素研究. 长治医学院学报. 2024(03): 194-198 .  百度学术
百度学术
4. 陈春梅,张蓉,楚杰,王雪星. 结直肠癌患者营养不良的影响因素及列线图预测模型的价值. 实用临床医药杂志. 2024(17): 20-26 .  本站查看
本站查看
5. 李梅莹,张斯萍. 基于ORTCC模型联合抗阻训练对维持性血液透析肌少症患者握力、依从性和步速的影响. 河北医药. 2024(24): 3745-3749 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
