Causal relationship between gastroesophageal reflux disease and chronic obstructive pulmonary disease based on Mendelian randomization analysis
-
摘要:目的
基于双向两样本孟德尔随机化(MR)方法分析胃食管反流病(GERD)与慢性阻塞性肺疾病(COPD)的因果关系。
方法从全基因组关联研究(GWAS)中获取GERD与COPD的遗传变异信息, 并以此作为工具变量。采用逆方差加权法(IVW)、加权中位数法和MR-Egger回归分析法进行MR分析,并通过敏感性分析验证结果的稳健性。
结果遗传预测的GERD与COPD发生风险具有显著正相关性,而COPD与GERD发生风险无统计学关联。正向IVW结果显示比值比(OR)=1.305 7, 95%置信区间(95%CI)为1.114 4~1.529 8, P=0.000 9; 逆向IVW结果显示OR=0.982 3, 95%CI为0.917 4~1.051 9, P=0.610 4。敏感性分析未发现任何潜在偏倚。
结论MR分析显示GERD是COPD的一个风险因子,治疗GERD可能有助于预防或延缓COPD的进展。
Abstract:ObjectiveTo analyze the causal relationship between gastroesophageal reflux disease (GERD) and chronic obstructive pulmonary disease (COPD) based on the bidirectional two-sample Mendelian randomization (MR).
MethodsGenetic variation information of GERD and COPD was obtained from Genome-Wide Association Studies (GWAS) and used as instrumental variables. Inverse variance-weighted (IVW), weighted median and MR-Egger methods were used for MR analysis, and sensitivity analysis was performed to validate the robustness of the results.
ResultsA significant positive correlation was observed between genetically predicted GERD and the incidence risk of COPD, but there was no statistical association between COPD and the incidence risk of GERD. Positive IVW result showed that the odds ratio (OR) was 1.305 7, the 95% confidence interval (95%CI) was 1.114 4 to 1.529 8, and the P value was 0.000 9; the reverse IVW result showed that the OR was 0.982 3, the 95%CI was 0.917 4 to 1.051 9, and the P value was 0.610 4. Sensitivity analysis did not find any potential bias.
ConclusionMR analysis shows that GERD is a risk factor for COPD, and treating GERD may help prevent or delay the progression of COPD.
-
胃食管反流病(GERD)是一种常见的消化系统疾病,表现为胃内容物逆流入食管,导致包括胃灼烧、反酸和吞咽困难等症状,严重影响患者生活质量。发达国家有约20%的成年人罹患GERD,中国具备典型症状的GERD患病率为2.5%~7.8%[1-2]。长时间受GERD的影响,食管可能发生炎症、糜烂甚至癌变。慢性阻塞性肺疾病(COPD)是一种慢性进行性呼吸系统疾病,特征为气道的持续性狭窄,可导致呼吸困难。研究[3]显示COPD发病率随着年龄的增长而增高,还与吸烟、空气污染和职业暴露等因素有关。
近年来,有研究[4]报道GERD与COPD存在潜在的关联,GERD可能增加COPD的风险或加重其症状,而COPD患者也常常伴随GERD的发生。分析可能的机制包括反流物对气道的刺激、气道炎症以及微误吸事件[5-7]。然而,这些研究常常受到混杂因素的影响,例如吸烟、饮酒、身体活动、饮食和其他健康状况。孟德尔随机化(MR)可利用遗传变异作为工具变量来探讨暴露与结果之间的因果关系,相较于传统的流行病学研究,MR更不容易受到混杂因素的影响,并且可以提供更为确凿的因果证据。本研究应用MR探讨GERD与COPD的潜在因果关系,现报告如下。
1. 材料与方法
1.1 研究设计
本研究采用双向两样本MR研究探讨GERD与COPD之间的因果关系。本研究依赖于全基因组关联研究中公开可用的汇总数据,这些研究是由机构审查委员会从所有原始研究中批准的,因此本研究不再需要经过伦理审查。
1.2 数据来源
1.2.1 GERD数据来源
GERD数据来源于An J等[8]大型的GWAS荟萃分析研究,该数据总样本量为332 601例,其中包括71 522例胃食管反流患者和261 079例对照人群。所有样本人群均为欧洲人种。
1.2.2 COPD数据来源
COPD数据来源于FinnGen数据库r9版本(https://r9.finngen.fi/)。FinnGen数据库是芬兰开展的一项大规模基因组研究项目,收集和分析来自50万名芬兰生物样本库参与者的基因组和健康数据[9]。该数据总样本量为329 552例,其中包括18 266例COPD患者和311 286例对照人群。
1.3 工具变量筛选
两样本MR研究必须满足3大假设: ①关联性假设,遗传变异必须与暴露强相关; ②排他性假设,遗传变异不能与结局相关; ③独立性假设,遗传变异不能与混淆因素相关。
本研究工具变量的筛选按照以下规则进行: ①设置全基因组具有意义的阈值为P<5×10-8, 筛选出潜在的单核苷酸多态性(SNPs), 并通过计算F统计量(F=Beta2/SE2), 排除F<10的SNP以确保强相关。②为了确保SNPs之间的独立性,去除连锁不平衡(LD)SNPs, 具体参数设置为r2=0.001, 遗传距离为10 MB。③通过PhneoScanner(http://www.phenoscanner.medschl.cam.ac.uk/)在线网页检测并去除与结局相关表型对应的SNP, 以满足排他性假设,防止潜在多效性的出现。本研究不使用代理SNP替代在结局数据中丢失的SNP。最终在正向MR分析中共确定18个SNP作为工具变量,在反向MR分析中共确定7个SNP作为工具变量。见表 1。
表 1 工具变量信息暴露 单核苷酸多态性 效应位点 其他位点 P Beta SE F COPD rs11846838 A G 4.67E-08 0.062 2 0.011 4 29.850 8 rs12449174 A G 2.91E-08 0.148 6 0.026 8 30.767 2 rs13270042 G A 2.28E-08 0.098 7 0.017 7 31.242 3 rs28929474 T C 2.06E-18 0.326 6 0.037 3 76.635 5 rs3025383 C T 2.33E-08 -0.084 5 0.015 1 31.195 0 rs7671167 T C 1.88E-08 0.062 9 0.011 2 31.611 1 rs8089390 T C 2.17E-08 -0.070 4 0.012 6 31.332 0 GERD rs111472920 T G 4.47E-08 0.098 7 0.018 0 30.066 9 rs12706746 A G 4.24E-09 0.036 9 0.006 3 34.306 1 rs12939066 T C 3.13E-11 0.041 5 0.006 2 44.803 6 rs13167137 T G 2.82E-08 -0.032 8 0.005 9 30.906 1 rs1473115 T C 3.95E-10 0.039 6 0.006 3 39.510 2 rs15071 T C 1.01E-08 -0.042 8 0.007 5 32.566 0 rs1858828 T G 3.23E-08 0.032 7 0.005 9 30.717 9 rs3072 T C 1.86E-08 -0.034 5 0.006 1 31.987 4 rs62046253 T C 1.30E-08 -0.035 2 0.006 2 32.233 1 rs62442944 T G 3.49E-08 0.041 8 0.007 6 30.250 0 rs6683411 A G 4.82E-08 0.032 4 0.005 9 30.156 9 rs6710685 T C 1.96E-09 0.039 1 0.006 5 36.184 9 rs6762606 T C 4.18E-08 -0.035 9 0.006 5 30.504 4 rs6809836 A G 3.70E-09 0.038 3 0.006 5 34.719 3 rs6991878 T C 2.71E-08 -0.033 8 0.006 1 30.702 5 rs72704785 A G 6.81E-09 0.045 9 0.007 9 33.757 6 rs7552188 T C 1.07E-08 0.041 3 0.007 2 32.903 0 rs769671 T C 9.28E-10 -0.038 5 0.006 3 37.345 7 1.4 统计学分析
本研究使用多种MR方法来评估GERD与COPD之间的因果关系,包括逆方差加权(IVW)、加权中位数法(Weight Median)以及MR-Egger, 其中IVW方法被认为是主要且最可靠的。敏感性分析通过Cochrane′s Q检验评估工具变量的异质性(P<0.05即存在异质性),通过MR-Egger回归评估工具变量的多效性(P<0.05即存在多效性)。此外,孟德尔随机化多态性残差和离群值(MR-PRESSO)检验也被用于评估和纠正水平多效性及离群异常SNP。留一分析用于评估该研究是否受单个SNP的影响而发生偏倚。本研究所有的分析均使用R语言(4.2.3版本)和“TwoSampleMR”分析包(0.5.6版本)进行。
2. 结果
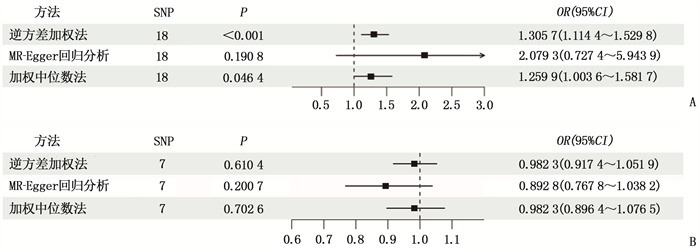
在正向MR分析中, GERD作为暴露,COPD作为结局。IVW结果为OR=1.305 7, 95%CI: 1.114 4~1.529 8, P=0.000 9, 表明遗传预测的GERD与COPD的发病率显著相关; Weight Median结果为OR=1.259 9, 95%CI: 1.003 6~1.581 7, P=0.046 4; MR-Egger结果为OR=2.079 3, 95%CI: 0.727 4~5.943 9,P=0.190 8。在敏感性分析中, MR-Egger-regression结果表明工具变量之间不存在多效性(intercept=-0.017 9, P=0.392 7), Cochrane′s Q检验结果未发现异质性的存在(P=0.393 5), 留一分析未发现正向MR分析结果受单个SNP影响。在反向MR分析中, COPD作为暴露,GERD作为结局。IVW结果为OR=0.982 3, 95%CI: 0.917 4~1.051 9, P=0.610 4; Weight Median结果为OR=0.982 3, 95%CI: 0.896 4~1.076 5, P=0.702 6; MR-Egger结果为OR=0.892 8, 95%CI: 0.767 8~1.038 2, P=0.200 7, 表明遗传预测的COPD与GERD的发病率无显著相关性; 敏感性分析表明遗传变量间不存在异质性与多效性。见表 2、图 1。
表 2 敏感性分析结果暴露 结局 SNPs/个 异质性检验 MR-Egger多效性检验 MR-PRESSO离群值检测 Q P 截距值 P 残差平方和 P 离群SNP GERD COPD 18 17.926 12 0.393 5 -0.017 9 0.392 7 20.311 47 0.404 9 无 COPD GERD 7 5.513 072 0.479 9 0.009 4 0.222 2 7.259 081 0.524 4 无 GERD: 胃食管反流病; COPD: 慢性阻塞性肺疾病; SNPs: 单核苷酸多态性; MR-PRESSO: 孟德尔随机多态性残差和离群值。 3. 讨论
本研究采用MR研究方法对GERD与COPD的因果关联进行分析,可以减少混杂因素的影响,并增强本研究结果的可靠性。正向MR分析结果显示,遗传预测的GERD患者可增加其COPD患病率[IVW结果(OR=1.305 7, 95%CI: 1.114 4~1.529 8, P=0.000 9), Weight Median结果(OR=1.259 9, 95%CI: 1.003 6~1.581 7, P=0.046 4)], 虽然MR-Egger结果(P=0.190 8)不支持该因果关联,但有学者[10-12]认为MR分析中主要结果为阳性时,其他方法中暴露对结局的影响方向与主要结果一致也可认为结果为阳性。反向MR分析结果暂不支持COPD患者与GERD患病存在因果关联。
GRED的发病率呈逐年上升趋势,但通常表现为口腔有酸味、喉咙痛、声音嘶哑、咳嗽、喘息等非典型症状,尤其在没有其他明显原因的情况下,在临床中极易被忽视[13]。近年来,越来越多的证据[4, 13]表明GERD与各种非消化道疾病有一定的关联。有研究[14-15]认为GERD患者长期受胃内容物反流、微误吸的影响,可能导致支气管和肺部组织发生慢性炎症,随着时间的推移而进展为COPD。同时,研究[16-17]表明GERD可导致COPD的进展,并可能加重已存在的COPD病情,造成COPD患者再入院次数增加,而COPD患者近1年内加重次数增多会加重心脏功能损害,导致生活质量进一步下降。GERD还与其他呼吸系统疾病相关联,如慢性咳嗽[18]、哮喘[19]、阻塞性睡眠呼吸暂停综合征[20]等。REYNOLDS C J等[21]和ZHU J等[22]研究明确了GERD是肺纤维化的危险因素,能增加肺纤维化的患病风险。因此,明确GERD在呼吸疾病中潜在的关联及机制有助于预防、管理以及治疗呼吸疾病。
本研究的反向MR分析结果与现有的观察性研究相悖。研究[23]表明COPD患者GERD患病率较高,是COPD的合并症之一,据统计COPD患者GERD患病率为17%~78%。原因可能为: 一方面,COPD患者因呼吸方式的改变,肺部过度充气可能导致胃食管抗反流屏障失衡,促使反流的发生[5, 23]; 另一方面, COPD患者长期服用的药物如皮质类固醇、茶碱、β2受体激动剂、抗毒蕈碱药等本身就能降低食管括约肌压力而促进反流的发生[5, 24-28]。COPD患者因病情反复迁延不愈而易出现焦虑、抑郁等心理问题,进而促进胃酸分泌增多,这也可能影响GERD的发生。研究[29]报道加用氟哌噻吨美利曲辛片联合舒肝解郁胶囊治疗难治性GERD的方案能有效缓解其相关临床症状。殷江龙等[30]通过文献计量分析发现心理负性情绪与GERD的关联研究成了新的热点话题。此外,吸烟作为COPD与GERD的共同危险因素,也影响着二者的关联。
与传统的观察性研究比较,本研究更有效地消除了反向因果关系及混杂因子的影响,尽管MR可以减少混杂,但仍然受到遗传工具变量选择的限制。此外,本研究主要基于欧洲人群的数据,可能不适用于其他人群。同时,本研究也缺乏分层深入讨论。
总之,本研究为GERD与COPD的潜在因果关系提供了证据,为干预提供理论基础, MR研究显示GERD确实是COPD的一个风险因子,治疗GERD可能会有助于预防或延缓COPD的进展。
-
表 1 工具变量信息
暴露 单核苷酸多态性 效应位点 其他位点 P Beta SE F COPD rs11846838 A G 4.67E-08 0.062 2 0.011 4 29.850 8 rs12449174 A G 2.91E-08 0.148 6 0.026 8 30.767 2 rs13270042 G A 2.28E-08 0.098 7 0.017 7 31.242 3 rs28929474 T C 2.06E-18 0.326 6 0.037 3 76.635 5 rs3025383 C T 2.33E-08 -0.084 5 0.015 1 31.195 0 rs7671167 T C 1.88E-08 0.062 9 0.011 2 31.611 1 rs8089390 T C 2.17E-08 -0.070 4 0.012 6 31.332 0 GERD rs111472920 T G 4.47E-08 0.098 7 0.018 0 30.066 9 rs12706746 A G 4.24E-09 0.036 9 0.006 3 34.306 1 rs12939066 T C 3.13E-11 0.041 5 0.006 2 44.803 6 rs13167137 T G 2.82E-08 -0.032 8 0.005 9 30.906 1 rs1473115 T C 3.95E-10 0.039 6 0.006 3 39.510 2 rs15071 T C 1.01E-08 -0.042 8 0.007 5 32.566 0 rs1858828 T G 3.23E-08 0.032 7 0.005 9 30.717 9 rs3072 T C 1.86E-08 -0.034 5 0.006 1 31.987 4 rs62046253 T C 1.30E-08 -0.035 2 0.006 2 32.233 1 rs62442944 T G 3.49E-08 0.041 8 0.007 6 30.250 0 rs6683411 A G 4.82E-08 0.032 4 0.005 9 30.156 9 rs6710685 T C 1.96E-09 0.039 1 0.006 5 36.184 9 rs6762606 T C 4.18E-08 -0.035 9 0.006 5 30.504 4 rs6809836 A G 3.70E-09 0.038 3 0.006 5 34.719 3 rs6991878 T C 2.71E-08 -0.033 8 0.006 1 30.702 5 rs72704785 A G 6.81E-09 0.045 9 0.007 9 33.757 6 rs7552188 T C 1.07E-08 0.041 3 0.007 2 32.903 0 rs769671 T C 9.28E-10 -0.038 5 0.006 3 37.345 7 表 2 敏感性分析结果
暴露 结局 SNPs/个 异质性检验 MR-Egger多效性检验 MR-PRESSO离群值检测 Q P 截距值 P 残差平方和 P 离群SNP GERD COPD 18 17.926 12 0.393 5 -0.017 9 0.392 7 20.311 47 0.404 9 无 COPD GERD 7 5.513 072 0.479 9 0.009 4 0.222 2 7.259 081 0.524 4 无 GERD: 胃食管反流病; COPD: 慢性阻塞性肺疾病; SNPs: 单核苷酸多态性; MR-PRESSO: 孟德尔随机多态性残差和离群值。 -
[1] MARET-OUDA J, MARKAR S R, LAGERGREN J. Gastroesophageal Reflux Disease: A Review[J]. Jama, 2020, 324(24): 2536-2547. doi: 10.1001/jama.2020.21360
[2] 燕晶晶, 李颖, 于明娟, 等. 胃食管反流病的诊治研究进展[J]. 现代中西医结合杂志, 2023, 32(9): 1309-1314. doi: 10.3969/j.issn.1008-8849.2023.09.030 [3] RAHERISON C, GIRODET P O. Epidemiology of COPD[J]. Eur Respir Rev, 2009, 18(114): 213-221. doi: 10.1183/09059180.00003609
[4] CHEN Y. Gastroesophageal reflux disease and non-digestive tract diseases[J]. Expert Rev Gastroenterol Hepatol, 2015, 9(5): 685-692. doi: 10.1586/17474124.2015.1012495
[5] 樊建勇, 秦燕. 慢性阻塞性肺疾病与胃食管反流病相互作用的研究进展[J]. 中国呼吸与危重监护杂志, 2020, 19(01): 88-91. [6] GARCíA RODRíGUEZ L A, RUIGóMEZ A, MARTíN-MERINO E, et al. Relationship between gastroesophageal reflux disease and COPD in UK primary care[J]. CHEST, 2008, 134(6): 1223-1230. doi: 10.1378/chest.08-0902
[7] LICCARDI G, SALZILLO A, CALZETTA L, et al. Gastroesophageal reflux and COPD exacerbations: Is cholinergic-mediated oesophago-bronchial reflex a possible link[J]. RESPIROLOGY, 2016, 21(8): 1496-1497. doi: 10.1111/resp.12896
[8] AN J, GHARAHKHANI P, LAW M H, et al. Gastroesophageal reflux GWAS identifies risk loci that also associate with subsequent severe esophageal diseases[J]. Nat Commun, 2019, 10(1): 4219. doi: 10.1038/s41467-019-11968-2
[9] KURKI M I, KARJALAINEN J, PALTA P, et al. FinnGen provides genetic insights from a well-phenotyped isolated population[J]. NATURE, 2023, 613(7944): 508-518. doi: 10.1038/s41586-022-05473-8
[10] ZAGKOS L, DIB M J, PINTO R, et al. Associations of genetically predicted fatty acid levels across the phenome: A mendelian randomisation study[J]. PLoS Med, 2022, 19(12): e1004141. doi: 10.1371/journal.pmed.1004141
[11] CHEN X, KONG J, DIAO X, et al. Depression and prostate cancer risk: A Mendelian randomization study[J]. Cancer Med, 2020, 9(23): 9160-9167. doi: 10.1002/cam4.3493
[12] WANG S, ZHU H, PAN L, et al. Systemic inflammatory regulators and risk of acute-on-chronic liver failure: A bidirectional mendelian-randomization study[J]. Front Cell Dev Biol, 2023, 11: 1125233. doi: 10.3389/fcell.2023.1125233
[13] 张晓莉, 李晗瑜, 郑松柏. 重视老年人胃食管反流病及其相关疾病的诊治[J]. 国际老年医学杂志, 2023, 44(4): 385-389. [14] LEE A S, LEE J S, HE Z, et al. Reflux-Aspiration in Chronic Lung Disease[J]. Ann Am Thorac Soc, 2020, 17(2): 155-164. doi: 10.1513/AnnalsATS.201906-427CME
[15] LEE A S, RYU J H. Aspiration Pneumonia and Related Syndromes[J]. Mayo Clin Proc, 2018, 93(6): 752-762. doi: 10.1016/j.mayocp.2018.03.011
[16] SAKAE T M, PIZZICHINI M M, TEIXEIRA P J, et al. Exacerbations of COPD and symptoms of gastroesophageal reflux: a systematic review and meta-analysis[J]. J Bras Pneumol, 2013, 39(3): 259-271. doi: 10.1590/S1806-37132013000300002
[17] 李路, 杨阳, 孙亚男, 等. 慢性阻塞性肺疾病急性加重期患者心功能不全相关危险因素及其与预后的关系[J]. 实用临床医药杂志, 2021, 25(15): 43-48, 52. doi: 10.7619/jcmp.20211756 [18] LI X, LIN S, WANG Z, et al. Gastroesophageal reflux disease and chronic cough: A possible mechanism elucidated by ambulatory pH-impedance-pressure monitoring[J]. Neurogastroenterol Motil, 2019, 31(12): e13707. doi: 10.1111/nmo.13707
[19] CIBELLA F, CUTTITTA G. Nocturnal asthma and gastroesophageal reflux[J]. Am J Med, 2001, 111(Suppl 8A): 31s-36s.
[20] 阿卜杜喀迪尔·阿卜杜热合曼, 柔孜麦麦提·艾则孜, 合贝尔江·力提甫. 胃食管反流病相关呼吸系统疾病研究进展[J]. 新疆医学, 2022, 52(2): 207-210. [21] REYNOLDS C J, DEL GRECO M F, ALLEN R J, et al. The causal relationship between gastro-oesophageal reflux disease and idiopathic pulmonary fibrosis: a bidirectional two-sample Mendelian randomisation study[J]. Eur Respir J, 2023, 61(5): 2201585. doi: 10.1183/13993003.01585-2022
[22] ZHU J, ZHOU D, WANG J, et al. A Causal Atlas on Comorbidities in Idiopathic Pulmonary Fibrosis: A Bidirectional Mendelian Randomization Study[J]. CHEST, 2023, 164(2): 429-440. doi: 10.1016/j.chest.2023.02.038
[23] LEE A L, GOLDSTEIN R S. Gastroesophageal reflux disease in COPD: links and risks[J]. Int J Chron Obstruct Pulmon Dis, 2015, 10: 1935-1949.
[24] BECKER B S, BURAKOFF R. The effect of verapamil on the lower esophageal sphincter pressure in normal subjects and in achalasia[J]. Am J Gastroenterol, 1983, 78(12): 773-775.
[25] HONGO M, TRAUBE M, MCALLISTER R G JR, et al. Effects of nifedipine on esophageal motor function in humans: correlation with plasma nifedipine concentration[J]. GASTROENTEROLOGY, 1984, 86(1): 8-12. doi: 10.1016/0016-5085(84)90583-3
[26] BERQUIST W E, RACHELEFSKY G S, KADDEN M, et al. Effect of theophylline on gastroesophageal reflux in normal adults[J]. J Allergy Clin Immunol, 1981, 67(5): 407-411. doi: 10.1016/0091-6749(81)90087-7
[27] STEIN M R, TOWNER T G, WEBER R W, et al. The effect of theophylline on the lower esophageal sphincter pressure[J]. Ann Allergy, 1980, 45(4): 238-241.
[28] JOHANNESSON N, ANDERSSON K E, JOELSSON B, et al. Relaxation of lower esophageal sphincter and stimulation of gastric secretion and diuresis by antiasthmatic xanthines. Role of adenosine antagonism[J]. Am Rev Respir Dis, 1985, 131(1): 26-30.
[29] 顾章明, 孙丽. 氟哌噻吨美利曲辛片联合舒肝解郁胶囊对难治性胃食管反流患者疗效及焦虑、抑郁状态的影响[J]. 实用临床医药杂志, 2019, 23(12): 32-35. doi: 10.7619/jcmp.201912010 [30] 殷江龙, 彭卓嵛, 石林韬, 等. 基于Citespace中医药治疗胃食管反流病相关研究的可视化分析[J]. 实用临床医药杂志, 2022, 26(22): 65-71. doi: 10.7619/jcmp.20221681 -
期刊类型引用(4)
1. 韩秀燕,许华,张沁丽. 血清尿酸水平与脑血管病因果关系的双向两样本孟德尔随机化研究. 实用临床医药杂志. 2025(01): 66-72 .  本站查看
本站查看
2. 刘莲莲,于会勇,李磊,郭雨菲,聂天旸,满天,位式祥,谢楚溪,陈天韵,王成祥. 支气管哮喘与骨密度因果关联的孟德尔随机化分析. 实用临床医药杂志. 2024(14): 24-29 .  本站查看
本站查看
3. 朱静欣,马锐,柴泽锟,董雨然,王乐. 社会压力与耳鸣发病之间因果关系的孟德尔随机化研究. 实用临床医药杂志. 2024(19): 55-59+67 .  本站查看
本站查看
4. 董魁,吴洁,燕静,刘海涛,乔冠恩. 饮食因素与胃食管反流病因果关系的孟德尔随机化研究. 实用临床医药杂志. 2024(23): 75-80+86 .  本站查看
本站查看
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号