Relation between intact fibroblast growth factor 23 and renal anemia in maintenance hemodialysis patients
-
摘要:目的 探讨全段成纤维细胞生长因子23(iFGF23)与维持性血液透析(MHD)患者肾性贫血的相关性。方法 根据纳入标准和排除标准筛选研究对象,收集其一般资料及实验室检查资料。采用酶联免疫吸附法检测透析患者血清iFGF23,并做相关性和多重线性回归分析。结果 本研究共纳入MHD患者138例,平均血红蛋白(Hb)水平为(105.0±19.0)g/L,其中79例Hb水平超过110 g/L,肾性贫血控制达标率为57.2%。按肾性贫血控制达标情况将患者分为2组,达标组的iFGF23水平低于未达标组,差异有统计学意义(P < 0.05)。MHD患者Hb水平与红细胞比容(HCT)、血清白蛋白(Alb)、白细胞(WBC)呈正相关(P < 0.05),与收缩压(SBP)、血肌酐(Scr)、铁蛋白(Fer)、Ln(iFGF23)呈负相关(P < 0.05)。多重线性回归分析显示,低血清Alb、高Scr、高Ln(iFGF23)是MHD患者发生肾性贫血的独立预测因子。结论 Ln(iFGF23)与MHD患者肾性贫血的发生风险有关,其机制有待进一步阐明。
-
关键词:
- 全段成纤维细胞生长因子23 /
- 血液透析 /
- 肾性贫血 /
- 血肌酐 /
- 白蛋白
Abstract:Objective To investigate the correlation between intact fibroblast growth factor 23 (iFGF23) and renal anemia in patients with maintenance hemodialysis (MHD).Methods Subjects were screened according to inclusion and exclusion criteria, and their general information and laboratory examination data were collected. Serum iFGF23 of dialysis patients was detected by enzyme linked immunosorbent assay, and correlation and multiple linear regression analysis were performed.Results A total of 138 MHD patients were included in this study. The overall hemoglobin (Hb) level was (105.0±19.0) g/L, and exceeded 110 g/L in 79 (57.2%) cases, with the standardization rate of renal anemia control of 57.2%. Patients were divided into two groups according to the standard of renal anemia control, and the level of iFGF23 in the standard group was lower than that in the non-standard group (P < 0.05). The level of Hb in MHD patients was positively correlated with erythrocyte volume (HCT), serum albumin (Alb), white blood cell (WBC) (P < 0.05), and negatively correlated with systolic blood pressure (SBP), serum creatinine (Scr), ferritin (Fer), and Ln(iFGF23) (P < 0.05). Multiple linear regression analysis showed that low serum Alb, high Scr, and high Ln (iFGF23) were independent predictors of renal anemia in MHD patients.Conclusion Ln (iFGF23) is associated with risk of renal anemia in MHD patients, and its mechanism needs to be further elucidated.-
Keywords:
- intact fibroblast growth factor 23 /
- hemodialysis /
- renal anemia /
- creatinine /
- albumin
-
肾性贫血是终末期肾病(ESRD)患者最常见的并发症之一,发生于超过90%的透析患者中,严重影响维持性血液透析(MHD)患者的生活质量和远期预后[1]。铁缺乏和促红细胞生成素缺乏一般被认为是ESRD患者发生贫血的主要原因,亦是有效的治疗靶点[2]。然而越来越多的横断面研究[3-4]表明,矿物质代谢紊乱相关指标与贫血之间可能存在联系。成纤维细胞生长因子23(FGF23)是正常生理过程中最重要的磷脂激素之一,主要由骨细胞和成骨细胞分泌,也可由骨髓分泌[5]。在肾脏中,FGF23主要通过结合FGF23受体(FGFR)-αKlotho共受体抑制肾小管上皮细胞表达钠磷共转运蛋白-Ⅱa(NaPi-Ⅱa)和钠磷共转运蛋白-Ⅱc(NaPi-Ⅱc),抑制磷酸盐重吸收,刺激尿磷酸盐排泄,调节1, 25-二羟基维生素D的产生和降解[6]。晚期慢性肾脏病(CKD)患者中,磷的蓄积可导致血清FGF23水平不断升高。相关研究[7]发现, FGF23、炎症、铁代谢和红细胞生成之间存在着意想不到的相互作用。本研究探讨了全段FGF23(iFGF23)与MHD患者肾性贫血的相关性,现报告如下。
1. 对象与方法
1.1 研究对象
选择2020年9月—2021年3月在扬州友好医院血液净化中心规律血液透析的成年患者作为研究对象。纳入标准: ①年龄>18岁者; ②每周透析2~3次,每次4 h者; ③透析血流量200~300 mL/min者; ④被诊断为慢性肾衰竭者。排除标准: ①透析龄 <3个月者; ②正在服用免疫抑制剂或其他影响骨髓造血功能的药物者; ③近3个月内有消化道出血史或接受过输血治疗者; ④近1个月内有手术或创伤史、急性心肌梗死、急性脑梗死、主动脉夹层、动脉瘤等患者; ⑤既往有血液系统疾病、恶性肿瘤、肝硬化史者; ⑥临床资料不完整者。
1.2 研究方法
1.2.1 一般资料收集
收集研究对象的性别、年龄、透析龄、体质量指数(BMI)、收缩压(SBP)、舒张压(DBP)等资料,并记录既往高血压、糖尿病等基础疾病情况。计算周促红细胞生成素(EPO)用量=周总剂量(IU)/体质量(kg)。
1.2.2 实验室检查
检测所有研究对象透析前空腹外周血血红蛋白(Hb)、红细胞(RBC)、红细胞比容(HCT)、红细胞平均体积(MCV)、红细胞平均血红蛋白量(MCH)、红细胞分布宽度(RDW)、白细胞(WBC)、血小板(PLT)、血小板分布宽度(PDW)和甘油三酯(TG)、总胆固醇(TC)、尿酸(UA)、血肌酐(Scr)、白蛋白(Alb)、钙(Ca)、磷(P)、碱性磷酸酶(ALP)、全段甲状旁腺激素(iPTH)、高敏C反应蛋白(hs-CRP)、铁蛋白(Fer)等指标水平。
1.2.3 血清iFGF23检测
抽取所有研究对象1周内第1次上机前的空腹静脉血,室温放置半小时,待血清析出后低温离心,取上层血清于-80 ℃冰箱冻存。采用夹心酶联免疫吸附法检测透析患者血清iFGF23水平,试剂盒购自安徽巧伊生物技术公司。将待测标本在常温下解冻30 min后严格按照试剂盒说明书要求进行测定。
1.2.4 肾性贫血的评估及分组
依据《中国肾性贫血诊治临床实践指南》[8],将肾性贫血控制达标定义为Hb≥110 g/L。根据是否肾性贫血控制达标将所有患者分为达标组与未达标组。
1.3 统计学分析
分类变量以[n(%)]表示,组间比较采用卡方检验。对连续性变量行正态性检验,并按照分布情况表示为(x±s)或[M(P25, P75)], 组间比较采用t检验或Wilcoxon秩和检验。使用Spearman或Pearson相关分析法筛选出可能与Hb相关的因素,制作散点图矩阵可视化Hb与各变量间的相关关系。采用多重线性回归分析评估可能影响Hb水平的因素,为满足线性关系,将SBP和iFGF23进行自然对数变换,即Ln(SBP)和Ln(iFGF23)。使用输入法建模,并对线性回归模型行残差独立及方差齐性检验。所有数据采用SPSS 22.0统计学软件进行分析,P <0.05为差异有统计学意义。采用R 4.0.3软件进行统计结果的可视化。
2. 结果
2.1 MHD患者临床资料分析
本研究最终纳入138例MHD患者,其中男82例、女56例,中位透析时间为50.5个月,平均Hb水平为(105.0±19.0) g/L, 其中79例患者Hb≥110 g/L, 肾性贫血控制达标率为57.2%(79/138)。未达标组中,轻度贫血(Hb 90~ <110 g/L)29例(49.2%), 中度贫血(Hb 60~<90 g/L)27例(占45.8%), 重度贫血(Hb<60 g/L)3例(占5.1%)。未达标组外周血RBC、WBC、HCT、Hb、Alb水平低于达标组,iFGF23水平、Ln(iFGF23)高于达标组,差异有统计学意义(P <0.05)。2组周EPO用量及Scr、UA、P水平比较,差异无统计学意义(P>0.05)。见表 1。
表 1 MHD患者一般资料及实验室指标比较(x±s)[n(%)][M(P25, P75)]指标 全组(n=138) 达标组(n=79) 未达标组(n=59) χ2/ t/Z P 年龄/岁 57.8±12.9 58.1±12.4 57.1±13.4 -0.004 0.997 性别 男 82(59.4) 50(63.3) 32(54.2) 1.148 0.284 女 56(40.6) 29(36.7) 27(45.8) 血压 SBP/mmHg 145.0(136.0, 148.0) 145.0(135.0, 157.0) 147.0(140.0, 160.0) 1.510 0.131 DBP/mmHg 83.0(78.0, 85.0) 84.0(78.0, 92.0) 81.0(75.0, 89.0) -1.829 0.067 BMI/(kg/m2) 23.6±3.1 23.9±3.2 23.1±2.9 1.640 0.103 基础疾病 高血压 119(86.2) 69(87.3) 50(84.7) 0.192 0.661 2型糖尿病 29(21.0) 16(20.3) 13(22.0) 0.047 0.829 透析龄/月 50.5(27.0, 78.0) 48.0(23.0, 62.0) 54.0(27.0, 73.0) 1.674 0.094 周EPO用量/(U/kg) 138.5(114.8, 157.9) 133.3(109.1, 155.2) 138.5(121.6, 171.4) 1.333 0.183 Hb/(g/L) 105.0±19.0 117.6±9.2 88.1±15.3 13.177 < 0.001 RBC/(×1012/L) 3.4(3.0, 3.7) 3.6(3.4, 3.9) 3.0(2.6, 3.2) -8.341 < 0.001 WBC/(×109/L) 5.8±1.7 6.1±1.7 5.3±1.6 2.807 0.006 MCV/fL 91.8(88.4, 96.5) 92.2(88.6, 96.6) 91.4(87.4, 96.7) -0.706 0.480 MCH/pg 31.1(29.8, 32.1) 31.1(29.8, 32.0) 31.0(29.8, 32.4) -0.142 0.887 HCT 0.32(0.29, 0.36) 0.36(0.33, 0.38) 0.29(0.26, 0.30) -9.755 < 0.001 RDW/% 13.3(12.7, 32.1) 13.2(12.7, 13.9) 13.6(12.8, 14.2) 1.962 0.050 PLT/(×109/L) 174.4±53.9 176.0±53.2 172.2±55.4 0.412 0.681 PDW/% 11.9(10.9, 14.3) 12.2(11.3, 14.1) 11.5(10.4, 14.3) -1.434 0.152 TG/(mmol/L) 1.3(1.0, 2.0) 1.4(1.0, 2.0) 1.2(0.9, 2.0) -1.218 0.223 TC/(mmol/L) 4.2(3.6, 5.0) 4.2(3.6, 5.0) 4.14(3.6, 4.9) -0.265 0.791 Scr/(μmol/L) 917.0±281.0 880.0±292.5 966.6±259.0 -1.804 0.073 UA/(mmol/L) 393.0±77.2 403.4±73.6 379.1±80.3 1.843 0.068 Alb/(g/L) 37.2±4.9 38.6±4.3 35.5±5.1 3.681 0.001 Ca/(mmol/L) 2.13±0.19 2.14±0.17 2.10±0.22 1.405 0.162 P/(mmol/L) 1.5(1.3, 1.6) 1.5(1.3, 1.8) 1.6(1.4, 2.0) 1.775 0.076 hs-CRP/(mg/L) 1.9(0.6, 5.3) 1.9(0.6, 5.4) 1.7(0.8, 5.4) 0.183 0.855 Fer/(ng/mL) 256.5(152.5, 395.4) 239.9(125.9, 392.5) 297.9(134.5, 459.9) 1.108 0.268 ALP/(U/L) 82.4(65.2, 101.1) 85.9(63.8, 111.5) 77.4(65.6, 113.7) -0.693 0.488 iPTH/(ng/L) 363.1(237.7, 582.5) 358.0(235.5, 553.0) 384.4(213.2, 628.7) 0.133 0.894 iFGF23/(ng/mL) 841.2(296.6, 4 281.8) 554.8(223.3, 3 154.3) 1 186.1(525.3, 9 206.6) 2.526 0.012 Ln(iFGF23) 7.1±1.9 6.7±2.0 7.5±1.8 -2.506 0.013 SBP: 收缩压; DBP: 舒张压; BMI: 体质量指数; EPO: 促红细胞生成素; Hb: 血红蛋白; RBC: 红细胞; WBC: 白细胞;
MCV: 红细胞平均体积; MCH: 红细胞平均血红蛋白量; HCT: 红细胞比容; RDW: 红细胞分布宽度; PLT: 血小板;
PDW: 血小板分布宽度; TG: 甘油三酯; TC: 总胆固醇; Scr: 血肌酐; UA: 尿酸; Alb: 白蛋白; Ca: 钙; P: 磷;
hs-CRP: 高敏C反应蛋白; Fer: 铁蛋白; ALP: 碱性磷酸酶; iPTH: 全段甲状旁腺激素; iFGF23: 全段成纤维细胞生长因子23。2.2 MHD患者Hb水平与其他临床指标的相关性分析
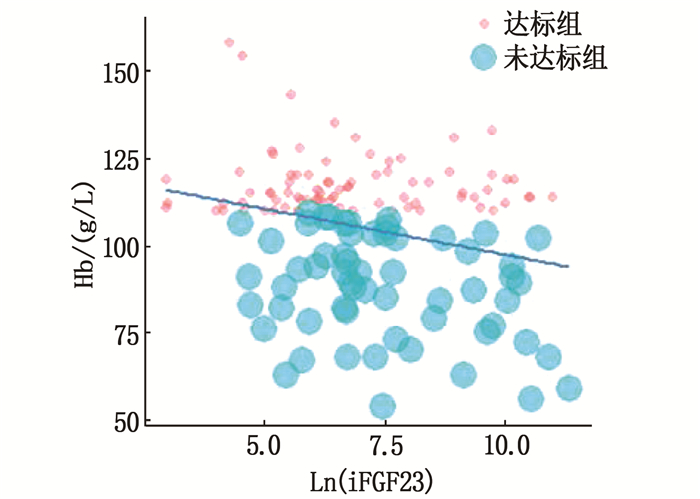
相关性分析结果显示,全组MHD患者的Hb与HCT、WBC、血清Alb均呈正相关(P <0.05), 与SBP、Scr、Fer、Ln(iFGF23)均呈负相关(P <0.05), 见表 2、图 1。按照肾性贫血控制情况分组情况进一步行相关性分析发现,未达标组MHD患者的Hb仍与Ln(iFGF23)呈负相关(r=-0.266, P <0.05)。
表 2 全组MHD患者Hb水平与其他临床指标的相关性分析指标 r P SBP -0.170 0.046 HCT 0.861 < 0.001 WBC 0.231 0.006 Scr -0.241 0.004 Alb 0.347 < 0.001 Fer -0.183 0.041 Ln(iFGF23) -0.264 0.002 SBP: 收缩压; HCT: 红细胞比容; WBC: 白细胞;
Scr: 血肌酐; Alb: 白蛋白; Fer: 铁蛋白;
iFGF23: 全段成纤维细胞生长因子23。2.3 MHD患者Hb水平的影响因素分析
散点图矩阵结果显示, Hb与Ln(SBP)、WBC、Alb、Scr、Fer、Ln(iFGF23)存在较强的线性趋势。将这些因素纳入多重线性回归分析,回归模型具有显著性(P <0.001); 共线性诊断提示,自变量之间不存在较强的线性相关关系(方差膨胀因子均 <5)。Alb与Hb呈正相关(P <0.001), 标准化偏回归系数为0.377; Ln(iFGF23)与Hb呈负相关(P=0.027), 标准化偏回归系数为-0.218; Scr与Hb呈负相关(P=0.029), 标准化偏回归系数为-0.222。见表 3。行德宾-沃森检验,德宾-沃森统计量为2.372, 提示残差独立。绘制标准化预测值与标准化残差的散点图,标准化残差的波动范围基本保持稳定,残差具有方差齐性。
表 3 MHD患者Hb水平的影响因素分析变量 β t P 方差膨胀因子 Ln(SBP) -0.001 -0.014 0.989 1.157 WBC -0.025 -0.286 0.775 1.238 Scr -0.222 -2.208 0.029 1.583 Alb 0.377 4.085 < 0.001 1.330 Fer -0.104 -1.277 0.204 1.046 Ln(iFGF23) -0.218 -2.237 0.027 1.483 SBP: 收缩压; WBC: 白细胞计数; Scr: 肌酐; Alb: 白蛋白;
Fer: 铁蛋白; iFGF23: 全段成纤维细胞生长因子23。3. 讨论
肾性贫血是严重影响ESRD患者心血管事件发生及预后的最常见并发症,受到人们的高度关注。本研究中,肾性贫血控制达标率为57.2%。未达标患者中,重度贫血(Hb < 60 g/L)3例,占5.1%。本研究发现, Hb与HCT、WBC、Alb呈正相关,与SBP、Scr、Fer、Ln(iFGF23)呈负相关; 多重线性回归分析显示,低Alb、高Scr、高Ln (iFGF23)是肾性贫血发生的独立预测因子。
FGF23是一种重要的调节P代谢和维生素D水平的成纤维细胞生长因子(FGF)家族成员,其作用超出了维持矿物质代谢稳态的范围,例如FGF23可通过激活心肌细胞FGF受体4诱导左室肥厚[9]。FGF23可分为iFGF23和从179位精氨酸与180位丝氨酸间被切割产生的cFGF23[5]。CKD和ESRD患者Ca、iPTH等水平异常均会使循环中FGF23水平升高[10-11], 且iFGF23裂解受到抑制,故iFGF23升高。本研究亦选择测定了MHD患者的iFGF23。
FGF23影响Hb的可能机制如下: 一方面,FGF23可通过影响EPO的产生、损害骨髓造血、促进红细胞凋亡等负性调控Hb; 敲除FGF23基因可促进红细胞生成,且不依赖于活性维生素D, 说明FGF23水平升高可能对造血系统有直接影响[4, 12]。另一方面, CKD患者多存在绝对缺铁或功能性铁缺乏,铁缺乏可刺激骨髓产生大量FGF23, 从而进入恶性循环。动物实验[13]结果也表明,铁缺乏小鼠的iFGF23水平显著升高。由于血清FGF23水平在CKD早期即开始升高,推测FGF23升高可能是CKD患者发生贫血的新机制。亦有研究[4]表明,抑制FGF23可改善肾性贫血。本研究证实了Ln (iFGF23)与MHD患者肾性贫血的发生风险有关,推测FGF23亦可能成为临床评估及干预肾性贫血的有效靶点。
一项针对53例CKD 3期、4期患者的横断面研究[14]显示, FGF23水平升高与Hb水平降低独立相关。另一项纳入3 869例CKD患者的前瞻性队列研究[15]显示,基线FGF23与肾性贫血发生风险独立相关。本研究也证实血清Ln (iFGF23)与Hb呈显著负相关,且高Ln (iFGF23)是患者发生肾性贫血的独立预测因子。血清Alb可反映MHD患者的整体健康状况,既往研究[16]显示,血清Alb与Hb呈正相关。导致低蛋白血症的营养不良、炎症等事件也可能通过抑制红细胞生成而引起贫血[17]。本研究亦发现,血清Alb与Hb呈正相关,且低血清Alb是患者发生肾性贫血的独立预测因子。本研究还发现,高Scr是患者发生肾性贫血的独立预测因子,这可能与高毒素水平破坏红细胞、骨髓抑制有关,亦有研究[18]指出贫血与中国中老年人肾功能下降相关。
本研究尚存在局限性: ①本研究未纳入转铁蛋白饱和度(TSAT)、铁调素、EPO等肾性贫血相关指标,可能导致结果偏倚; ②本研究为单中心小样本的横断面研究,不能提示iFGF23与肾性贫血的因果关系。2019年,首种低氧诱导因子-脯氨酸羟化酶抑制剂(HIF-PHI)作为治疗肾性贫血的新药在中国上市,其可促进EPO合成、改善铁代谢、直接刺激造血干细胞等[19], 采用HIF-PHI纠正贫血可能调节FGF23的生成。纠正肾性贫血的不同治疗方式会否影响血清FGF23水平,值得临床进一步探讨。
-
表 1 MHD患者一般资料及实验室指标比较(x±s)[n(%)][M(P25, P75)]
指标 全组(n=138) 达标组(n=79) 未达标组(n=59) χ2/ t/Z P 年龄/岁 57.8±12.9 58.1±12.4 57.1±13.4 -0.004 0.997 性别 男 82(59.4) 50(63.3) 32(54.2) 1.148 0.284 女 56(40.6) 29(36.7) 27(45.8) 血压 SBP/mmHg 145.0(136.0, 148.0) 145.0(135.0, 157.0) 147.0(140.0, 160.0) 1.510 0.131 DBP/mmHg 83.0(78.0, 85.0) 84.0(78.0, 92.0) 81.0(75.0, 89.0) -1.829 0.067 BMI/(kg/m2) 23.6±3.1 23.9±3.2 23.1±2.9 1.640 0.103 基础疾病 高血压 119(86.2) 69(87.3) 50(84.7) 0.192 0.661 2型糖尿病 29(21.0) 16(20.3) 13(22.0) 0.047 0.829 透析龄/月 50.5(27.0, 78.0) 48.0(23.0, 62.0) 54.0(27.0, 73.0) 1.674 0.094 周EPO用量/(U/kg) 138.5(114.8, 157.9) 133.3(109.1, 155.2) 138.5(121.6, 171.4) 1.333 0.183 Hb/(g/L) 105.0±19.0 117.6±9.2 88.1±15.3 13.177 < 0.001 RBC/(×1012/L) 3.4(3.0, 3.7) 3.6(3.4, 3.9) 3.0(2.6, 3.2) -8.341 < 0.001 WBC/(×109/L) 5.8±1.7 6.1±1.7 5.3±1.6 2.807 0.006 MCV/fL 91.8(88.4, 96.5) 92.2(88.6, 96.6) 91.4(87.4, 96.7) -0.706 0.480 MCH/pg 31.1(29.8, 32.1) 31.1(29.8, 32.0) 31.0(29.8, 32.4) -0.142 0.887 HCT 0.32(0.29, 0.36) 0.36(0.33, 0.38) 0.29(0.26, 0.30) -9.755 < 0.001 RDW/% 13.3(12.7, 32.1) 13.2(12.7, 13.9) 13.6(12.8, 14.2) 1.962 0.050 PLT/(×109/L) 174.4±53.9 176.0±53.2 172.2±55.4 0.412 0.681 PDW/% 11.9(10.9, 14.3) 12.2(11.3, 14.1) 11.5(10.4, 14.3) -1.434 0.152 TG/(mmol/L) 1.3(1.0, 2.0) 1.4(1.0, 2.0) 1.2(0.9, 2.0) -1.218 0.223 TC/(mmol/L) 4.2(3.6, 5.0) 4.2(3.6, 5.0) 4.14(3.6, 4.9) -0.265 0.791 Scr/(μmol/L) 917.0±281.0 880.0±292.5 966.6±259.0 -1.804 0.073 UA/(mmol/L) 393.0±77.2 403.4±73.6 379.1±80.3 1.843 0.068 Alb/(g/L) 37.2±4.9 38.6±4.3 35.5±5.1 3.681 0.001 Ca/(mmol/L) 2.13±0.19 2.14±0.17 2.10±0.22 1.405 0.162 P/(mmol/L) 1.5(1.3, 1.6) 1.5(1.3, 1.8) 1.6(1.4, 2.0) 1.775 0.076 hs-CRP/(mg/L) 1.9(0.6, 5.3) 1.9(0.6, 5.4) 1.7(0.8, 5.4) 0.183 0.855 Fer/(ng/mL) 256.5(152.5, 395.4) 239.9(125.9, 392.5) 297.9(134.5, 459.9) 1.108 0.268 ALP/(U/L) 82.4(65.2, 101.1) 85.9(63.8, 111.5) 77.4(65.6, 113.7) -0.693 0.488 iPTH/(ng/L) 363.1(237.7, 582.5) 358.0(235.5, 553.0) 384.4(213.2, 628.7) 0.133 0.894 iFGF23/(ng/mL) 841.2(296.6, 4 281.8) 554.8(223.3, 3 154.3) 1 186.1(525.3, 9 206.6) 2.526 0.012 Ln(iFGF23) 7.1±1.9 6.7±2.0 7.5±1.8 -2.506 0.013 SBP: 收缩压; DBP: 舒张压; BMI: 体质量指数; EPO: 促红细胞生成素; Hb: 血红蛋白; RBC: 红细胞; WBC: 白细胞;
MCV: 红细胞平均体积; MCH: 红细胞平均血红蛋白量; HCT: 红细胞比容; RDW: 红细胞分布宽度; PLT: 血小板;
PDW: 血小板分布宽度; TG: 甘油三酯; TC: 总胆固醇; Scr: 血肌酐; UA: 尿酸; Alb: 白蛋白; Ca: 钙; P: 磷;
hs-CRP: 高敏C反应蛋白; Fer: 铁蛋白; ALP: 碱性磷酸酶; iPTH: 全段甲状旁腺激素; iFGF23: 全段成纤维细胞生长因子23。表 2 全组MHD患者Hb水平与其他临床指标的相关性分析
指标 r P SBP -0.170 0.046 HCT 0.861 < 0.001 WBC 0.231 0.006 Scr -0.241 0.004 Alb 0.347 < 0.001 Fer -0.183 0.041 Ln(iFGF23) -0.264 0.002 SBP: 收缩压; HCT: 红细胞比容; WBC: 白细胞;
Scr: 血肌酐; Alb: 白蛋白; Fer: 铁蛋白;
iFGF23: 全段成纤维细胞生长因子23。表 3 MHD患者Hb水平的影响因素分析
变量 β t P 方差膨胀因子 Ln(SBP) -0.001 -0.014 0.989 1.157 WBC -0.025 -0.286 0.775 1.238 Scr -0.222 -2.208 0.029 1.583 Alb 0.377 4.085 < 0.001 1.330 Fer -0.104 -1.277 0.204 1.046 Ln(iFGF23) -0.218 -2.237 0.027 1.483 SBP: 收缩压; WBC: 白细胞计数; Scr: 肌酐; Alb: 白蛋白;
Fer: 铁蛋白; iFGF23: 全段成纤维细胞生长因子23。 -
[1] ECKARDT K U, AGARWAL R, ASWAD A, et al. Safety and efficacy of vadadustat for anemia in patients undergoing dialysis[J]. N Engl J Med, 2021, 384(17): 1601-1612. doi: 10.1056/NEJMoa2025956
[2] BABITT J L, LIN H Y. Mechanisms of anemia in ckd[J]. J Am Soc Nephrol, 2012, 23(10): 1631-1634. doi: 10.1681/ASN.2011111078
[3] PATEL N M, GUTIE RREZ O M, ANDRESS D L, et al. Vitamin D deficiency and anemia in early chronic kidney disease[J]. Kidney Int, 2010, 77(8): 715-720. doi: 10.1038/ki.2009.551
[4] AGORO R, MONTAGNA A, GOETZ R, et al. Inhibition of fibroblast growth factor 23(FGF23) signaling rescues renal anemia[J]. FASEB J, 2018, 32(7): 3752-3764. doi: 10.1096/fj.201700667R
[5] EDMONSTON D, WOLF M. FGF23 at the crossroads of phosphate, iron economy and erythropoiesis[J]. Nat Rev Nephrol, 2020, 16(1): 7-19. doi: 10.1038/s41581-019-0189-5
[6] CHEN G, LIU Y, GOETZ R, et al. A-Klotho is a non-enzymatic molecular scaffold for FGF23 hormone signalling[J]. Nature, 2018, 553(7689): 461-466. doi: 10.1038/nature25451
[7] TORO L, BARRIENTOS V, LEÓN P, et al. Erythropoietin induces bone marrow and plasma fibroblast growth factor 23 during acute kidney injury[J]. Kidney Int, 2018, 93(5): 1131-1141. doi: 10.1016/j.kint.2017.11.018
[8] 中国医师协会肾脏内科医师分会肾性贫血指南工作组. 中国肾性贫血诊治临床实践指南[J]. 中华医学杂志, 2021, 101(20): 1463-1502. doi: 10.3760/cma.j.cn112137-20210201-00309 [9] FAUL C, AMARAL A P, OSKOUEI B, et al. FGF23 induces left ventricular hypertrophy[J]. J Clin Invest, 2011, 121(11): 4393-4408. doi: 10.1172/JCI46122
[10] DAVID V, DAI B, MARTIN A, et al. Calcium regulates FGF-23 expression in bone[J]. Endocrinology, 2013, 154(12): 4469-4482. doi: 10.1210/en.2013-1627
[11] MEIR T, DURLACHER K, PAN Z, et al. Parathyroid hormone activates the orphan nuclear receptor Nurr1 to induce FGF23 transcription[J]. Kidney Int, 2014, 86(6): 1106-1115. doi: 10.1038/ki.2014.215
[12] BABITT J L, SITARA D. Crosstalk between fibroblast growth factor 23, iron, erythropoietin, and inflammation in kidney disease[J]. Curr Opin Nephrol Hypertens, 2019, 28(4): 304-310. doi: 10.1097/MNH.0000000000000514
[13] DAVID V, MARTIN A, ISAKOVA T, et al. Inflammation and functional iron deficiency regulate fibroblast growth factor 23 production[J]. Kidney Int, 2016, 89(1): 135-146. doi: 10.1038/ki.2015.290
[14] TSAI M H, LEU J G, FANG Y W, et al. High fibroblast growth factor 23 levels associated with low hemoglobin levels in patients with chronic kidney disease stages 3 and 4[J]. Medicine: Baltimore, 2016, 95(11): e3049. doi: 10.1097/MD.0000000000003049
[15] MEHTA R, CAI X, HODAKOWSKI A, et al. Fibroblast growth factor 23 and anemia in the chronic renal insufficiency cohort study[J]. Clin J Am Soc Nephrol, 2017, 12(11): 1795-1803. doi: 10.2215/CJN.03950417
[16] GUTIÉRREZ O M, MANNSTADT M, ISAKOVA T, et al. Fibroblast growth factor 23 and mortality among patients undergoing hemodialysis[J]. N Engl J Med, 2008, 359(6): 584-592. doi: 10.1056/NEJMoa0706130
[17] STEINMAN T I. Serum albumin: its significance in patients with ESRD[J]. Semin Dial, 2000, 13(6): 404-408. doi: 10.1046/j.1525-139x.2000.00110.x
[18] YANG C, MENG Q, WANG H, et al. Anemia and kidney function decline among the middle-aged and elderly in China: a population-based national longitudinal study[J]. Biomed Res Int, 2020, 2020: 2303541. http://www.researchgate.net/publication/346103092_Anemia_and_Kidney_Function_Decline_among_the_Middle-Aged_and_Elderly_in_China_A_Population-Based_National_Longitudinal_Study/download
[19] 曹婧媛, 刘必成. 低氧诱导因子-脯氨酸羟化酶轴在肾性贫血中的作用机制研究进展[J]. 生理学报, 2018, 70(6): 623-629. https://www.cnki.com.cn/Article/CJFDTOTAL-SLXU201806006.htm -
期刊类型引用(8)
1. 万正红,周莉. 慢性肾脏病维持性血液透析患者相关贫血发病机制与治疗研究进展. 疑难病杂志. 2024(12): 1515-1518 .  百度学术
百度学术
2. 冯钰,张开贵,朱茂才,邹兆华,卿伟. 终末期肾脏病血液透析患者肾性贫血的危险因素分析及个性化预防策略探讨. 实用临床医药杂志. 2024(24): 103-109 .  本站查看
本站查看
3. 李育栋,廖文建,罗雍航,陈秋宇,苏勇. 慢性肾脏病患者肾性贫血治疗的研究进展. 新医学. 2023(05): 321-325 .  百度学术
百度学术
4. 杨洁,边宇,张蕊. 非透析慢性肾脏病患者发生肾性贫血风险预测模型的开发与验证. 实用临床医药杂志. 2023(10): 72-78 .  本站查看
本站查看
5. 黄倩倩,孙继青,刘军,李景然. 妊娠期糖尿病患者血清葡萄糖依赖性促胰岛素释放肽、成纤维细胞生长因子-23水平与产后糖代谢异常的关系. 实用临床医药杂志. 2023(18): 113-117+122 .  本站查看
本站查看
6. 李正理. 慢性肾病维持性血液透析与肾性贫血相关性分析. 智慧健康. 2023(29): 52-55 .  百度学术
百度学术
7. 王新梓,邱溢博,邓雨,于思明. 维持性血液透析患者血管钙化治疗的研究进展. 实用临床医药杂志. 2022(22): 144-148 .  本站查看
本站查看
8. 生玉平,马晓迎,孙福云,杨星梦,王娜,张浩然,徐海平. 血小板衍生生长因子、Beclin1与血液透析患者血管钙化的关系. 实用临床医药杂志. 2022(21): 60-64 .  本站查看
本站查看
其他类型引用(2)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号